ABSTRAK
Meningkatnya bakteri yang resistan terhadap antibiotik telah meningkatkan minat global terhadap peptida antimikroba (AMP) sebagai aditif pakan yang menjanjikan. Meskipun AMP awalnya dianggap kurang rentan terhadap resistensi karena aktivitas spektrum luasnya, penelitian terkini telah mengungkapkan peningkatan yang mengkhawatirkan dalam resistensi bakteri terhadap AMP, meskipun mekanismenya masih kurang dipahami. Dalam penelitian ini, kami menunjukkan bahwa Staphylococcus aureus dapat mengembangkan resistensi yang stabil terhadap AMP NZ2114 yang berasal dari plectasin, serta nisin dan basitrasin, setelah 35 hari paparan berturut-turut. Analisis genomik komparatif mengidentifikasi lima gen kandidat yang terkait dengan resistensi, dengan uji fungsional yang mengungkapkan mutasi signifikan pada ndh (Gln287*), lytD (Ala138Thr), dan braS (Asn130Asp) sebagai kontributor utama. Studi knockout menunjukkan bahwa galur Δ ndh menunjukkan peningkatan resistensi terhadap NZ2114, basitrasin, dan nisin, di samping penurunan kadar ROS intraseluler dan tingkat mutasi rifampisin. Sebaliknya, mutan Δ lytD dan Δ braS menunjukkan resistensi yang berkurang terhadap NZ2114 dan basitrasin, dengan peningkatan pembentukan biofilm pada Δ lytD dan penurunan kapasitas biofilm pada Δ braS . Untuk menyelidiki lebih lanjut mutasi ini, kami menghasilkan galur komplementasi in situ ∆ :: lytD- A138T dan ∆ :: braS- N130D, yang keduanya menunjukkan resistensi yang meningkat dibandingkan dengan tipe liar, yang menunjukkan bahwa perubahan fungsional, bukan hilangnya gen, memediasi resistensi. Khususnya, fenotipe resistensi berkorelasi terbalik dengan kadar anion permukaan bakteri, yang menekankan pentingnya interaksi elektrostatik antara AMP kationik dan anion permukaan bakteri dalam kemanjuran antimikroba. Temuan ini memberikan wawasan baru tentang mekanisme resistensi AMP pada S. aureus , yang menyoroti risiko resistensi silang dan menggarisbawahi perlunya kontrol ketat penggunaan AMP untuk mengurangi munculnya resistensi.
1 Pendahuluan
Staphylococcus aureus ( S. aureus ) adalah patogen terkemuka yang bertanggung jawab untuk spektrum luas penyakit ternak seperti mastitis sapi dan abses kulit dan juga merupakan salah satu patogen bawaan makanan yang paling umum terkait dengan wabah penyakit bawaan makanan, terutama dalam industri daging dan susu [ 1 , 2 ]. Patogen tersebut telah mengembangkan mekanisme resistensi antibiotik multifaset, yang mempersulit strategi intervensi. Khususnya, S. aureus menunjukkan resistensi daptomycin melalui produksi berlebihan lysyl-phosphatidylglycerol [ 3 ]; resistensi vankomisinnya dapat dikategorikan menjadi resistensi lengkap yang dimediasi oleh gen vanA dan resistensi intermediet yang terkait dengan sistem regulasi seperti vraSR , walKR , dan graSR [ 4 ]. Selain itu, gen mecA memberikan resistensi spektrum luas terhadap antibiotik β-laktam [ 5 ]. Ancaman yang ditimbulkan oleh S. aureus yang resistan terhadap antibiotik ditegaskan oleh data terbaru dari The Lancet, yang mengidentifikasi S. aureus sebagai bakteri penyebab kematian terbanyak secara global pada tahun 2019, dengan perkiraan 1.176.000 kematian [ 6 ]. Yang mengkhawatirkan, tingkat kematian 30 hari akibat bakteremia S. aureus tetap setinggi 30% di Amerika Serikat, dengan S. aureus terkait dengan risiko kematian tertinggi di antara patogen penyebab bakteremia [ 7 ].
Peptida antimikroba (AMP) adalah peptida kecil bermuatan positif yang secara alami diekspresikan oleh hewan, tumbuhan, dan mikroorganisme [ 8 ]. Sebagian besar AMP memiliki domain hidrofilik dan hidrofobik, yang memungkinkannya untuk mengikat komponen lipid dan gugus fosfolipid, sehingga memungkinkan penetrasi membran dan aksi bakterisida [ 8 ]. AMP menunjukkan aktivitas bakterisida yang kuat secara independen, dengan beberapa telah disetujui untuk aditif makanan atau menjalani uji coba lanjutan [ 9 , 10 ]. Nisin, yang diisolasi dari Lactococcus lactis , adalah AMP pertama yang disetujui oleh FDA AS sebagai pengawet alami untuk banyak produk makanan [ 11 ], sedangkan basitrasin, yang diproduksi oleh Bacillus subtilis dan Bacillus licheniformis , memiliki spektrum antibakteri yang sama dengan penisilin [ 12 ]. NZ2114, turunan dari defensin jamur plectasin, telah menunjukkan peningkatan aktivitas terhadap patogen Gram-positif [ 13 ], termasuk S. aureus , dan menunjukkan kemanjuran yang lebih unggul dibandingkan dengan mupirocin dan ofloxacin terhadap MRSA yang resistan terhadap banyak obat dan strain klinis yang sangat virulen. Akibatnya, NZ2114 telah banyak dieksplorasi sebagai kandidat yang menjanjikan untuk aditif pakan dan kedokteran hewan [ 13 , 14 ].
Tidak seperti antibiotik tradisional, bakteri cenderung tidak mengembangkan resistensi terhadap AMP, terutama karena farmakodinamiknya yang berbeda, yang mengurangi jendela evolusi untuk resistensi [ 15 ]. Studi kinetika kematian sel tunggal telah menunjukkan bahwa AMP dapat menghilangkan bakteri dalam hitungan detik hingga menit, secara drastis meminimalkan waktu untuk resistensi yang didorong oleh mutasi [ 16 ]. Lebih jauh lagi, evolusi resistensi AMP biasanya memerlukan mutasi pada beberapa lokus genetik, seringkali pada lima atau lebih situs [ 17 ], dan resistensi ini umumnya tidak spesifik, yang mempersulit penyebarannya melalui transfer gen horizontal [ 18 ]. Namun, resistensi AMP tetap menjadi masalah kritis. Model tradisional menunjukkan bahwa AMP bertindak secara nonspesifik dengan mengganggu membran bakteri pada konsentrasi tinggi [ 19 ]. Namun, bukti yang muncul selama 5 tahun terakhir menunjukkan bahwa AMP dapat sangat spesifik dalam mekanisme kerjanya, dan bakteri dapat memperoleh resistensi melalui mutasi pada situs targetnya [ 19 ]. Bakteri telah mengembangkan resistensi terhadap AMP melalui mekanisme seperti sekresi protease, pembentukan biofilm, aktivasi pompa efluks, dan modifikasi muatan permukaan sel [ 20 ]. Misalnya, Escherichia coli , di bawah tekanan AMP, mengembangkan resistensi dengan memproduksi fibril amiloid yang terkait dengan pembentukan biofilm [ 21 ], sedangkan bakteri mikrobiota usus tertentu menunjukkan resistensi intrinsik yang tinggi terhadap AMP [ 22 ]. Selain itu, paparan berkelanjutan terhadap konsentrasi tinggi AMP telah terbukti meningkatkan konsentrasi penghambatan minimum (MIC) AMP hingga 32 kali lipat pada S. aureus [ 23 ].
Mengingat temuan-temuan yang muncul ini, sangat penting untuk menjelaskan mekanisme resistensi AMP untuk memandu penerapan AMP yang rasional dan efektif dalam bahan tambahan pangan. Dalam penelitian ini, kami menginduksi resistensi yang stabil pada S. aureus melalui 35 hari berturut-turut tekanan seleksi dengan AMP. Analisis genomik komparatif antara strain tipe liar dan strain resisten mengidentifikasi lima gen kandidat utama. Melalui penghapusan gen, mutagenesis yang diarahkan pada lokasi, dan uji fenotipik—termasuk penentuan MIC, pengukuran ROS intraseluler, pembentukan biofilm, dan autolisis—kami menemukan bahwa mutasi pada tiga gen secara signifikan meningkatkan resistensi bakteri terhadap AMP. Secara khusus, penghapusan ndh , serta mutasi titik pada lytD (∆:: lytD- A138T) dan braS (∆:: braS- N130D), secara dramatis meningkatkan resistensi S. aureus terhadap nisin, NZ2114, dan basitrasin. Lebih jauh lagi, resistensi ini berkorelasi negatif dengan kadar anion pada permukaan bakteri, yang menunjukkan bahwa S. aureus dapat menghindari pembunuhan AMP dengan mengurangi kandungan anion permukaan.
2 Bahan dan Metode
2.1 Strain Bakteri dan Plasmid
Galur dan plasmid yang digunakan dalam penelitian ini tercantum dalam Informasi Pendukung S1 : Tabel S1. S. aureus BA01611 tipe liar adalah galur MRSA yang berasosiasi dengan ternak (nomor akses Genbank CP019945). AMP NZ2114, nisin, dan basitrasin disediakan oleh Peneliti Wang Jianhua dari Feed Research Institute, Chinese Academy of Agricultural Sciences. Antibiotik benzylpenicillin, vancomycin, dan erythromycin dibeli dari Sigma–Aldrich. Kit ekstraksi plasmid dan EasyPure Genomic DNA Kit dibeli dari Beijing TransGen Biotech Co. Ltd. DCFH-DA dan 2,2-dipyridyl diperoleh dari Sigma–Aldrich, dan kit ekstraksi RNA dibeli dari Omega Bio-Tek (USA).
2.2 Penentuan Konsentrasi Hambat Minimum (KHM) untuk Strain
MIC dari setiap galur yang berevolusi ditentukan menggunakan metode mikrodilusi kaldu dalam pelat 96-sumur. Secara singkat, tiga koloni yang secara morfologis serupa dari setiap galur disuspensikan kembali dalam kaldu kedelai triptik (TSB) dan diinkubasi semalam pada suhu 37°C. Setelah pertumbuhan semalam, kultur disesuaikan dengan kepadatan optik pada 600 nm (OD600 = 0,16–0,18), memastikan sekitar 1 × 108 CFU /mL, kemudian diencerkan 100 kali dengan kaldu Mueller–Hinton (Sigma, AS). Inokulum standar ini diinokulasi dalam media MHB yang mengandung AMP (NZ2114, nisin, basitrasin) atau antibiotik (oksasilin, vankomisin, eritromisin) pada pengenceran serial dua kali lipat AMP (NZ2114, nisin, basitrasin) atau antibiotik (oksasilin, vankomisin, eritromisin) dalam MHB, dengan konsentrasi akhir berkisar antara 128 mg/L hingga 0,25 mg/L. Setelah 24 jam inkubasi pada suhu 37°C dalam pelat 96-sumur, konsentrasi terendah yang sepenuhnya menghambat pertumbuhan bakteri yang terlihat dicatat sebagai nilai MIC. Semua percobaan dilakukan dalam rangkap tiga.
2.3 Induksi Resistensi AMP
Nilai MIC untuk galur tipe liar ditentukan dan dicatat terlebih dahulu. Setelah inkubasi, serial passaging dimulai dengan memindahkan sel bakteri yang tumbuh pada konsentrasi AMP tertinggi (tepat di bawah MIC) ke dalam TSB segar. Inokulum ini dikenai uji MIC lainnya. Setelah masa inkubasi 18–24 jam, sel yang tumbuh pada konsentrasi AMP tertinggi dari passage sebelumnya dipanen dan digunakan untuk passage berikutnya. Proses ini diulang selama 35 passage, dengan konsentrasi AMP disesuaikan menurut nilai MIC yang meningkat.
2.4 Pengujian Stabilitas Resistensi
Untuk menilai stabilitas resistensi, rangkaian uji strain resisten dilakukan tanpa seleksi AMP, berdasarkan metode yang dijelaskan sebelumnya. Setelah pertumbuhan semalam di bawah seleksi, kultur diencerkan 1:1000 ke dalam TSB segar dan diinkubasi tanpa tekanan seleksi. Setelah setiap uji, nilai MIC ditentukan, seperti yang dijelaskan sebelumnya. Proses ini berlanjut selama 10 uji, dan nilai MIC dicatat pada setiap langkah.
2.5 Pengurutan Genom dan Analisis Genom Komparatif
DNA genom diekstraksi menggunakan EasyPure Genomic DNA Kit mengikuti protokol pabrik pembuatnya. Setelah ekstraksi, DNA genom dikirim untuk pengurutan genom lengkap menggunakan platform Nanopore PromethION dan Illumina NovaSeq PE150 di Beijing Novogene Bioinformatics Technology Co. Ltd. Perakitan campuran data Nanopore generasi ketiga dan data generasi kedua dilakukan menggunakan perangkat lunak Unicycler (v0.4.7). Analisis genom komparatif dilakukan antara galur tipe liar dan galur resistan NZ2114 untuk mengidentifikasi gen kandidat yang terlibat dalam resistensi, yang selanjutnya dikonfirmasi oleh PCR dan pengurutan Sanger.
2.6 Kinetika Pertumbuhan
Untuk mengevaluasi dampak penghapusan gen pada pertumbuhan bakteri, kinetika pertumbuhan diukur. Inokulum 1% dari kultur semalam dimasukkan ke dalam media segar, dan OD600 dipantau pada interval 1 jam selama 10 jam menggunakan spektrofotometer UV-VIS ganda. Kaldu nutrisi steril digunakan sebagai kontrol kosong. Kurva pertumbuhan dibuat untuk membandingkan laju pertumbuhan galur penghapusan dengan galur tipe liar.
2.7 Konstruksi Strain Knocking Out dan Komplementasi Gen
Knocking out dan komplementasi gen dilakukan pada galur S. aureus BA01611. Gen ndh, lytD, dan braS di-knock out menggunakan vektor pKZ2 (nomor akses Genbank KY615709). Plasmid shuttle pKZ2 masing-masing dengan gen knockout digunakan untuk memulihkan ndh, lytD, dan braS dalam kromosom mutan null gen yang sesuai. Galur dengan ekspresi berlebih dihasilkan dengan memperkenalkan vektor pSE1 (nomor akses Genbank KY615710) yang mengandung setiap gen. Semua primer yang digunakan untuk amplifikasi dan kloning tercantum dalam Informasi Pendukung S1 : Tabel S2. Vektor dilinearisasi menggunakan EcoR I dan Kpn I, dan kemudian dimurnikan menggunakan kit pemurnian DNA universal (Tiangen, Beijing, Cina). Vektor yang dilinearisasi dan gen yang diperkuat dirakit menggunakan pEASY-Basic Seamless Cloning and Assembly Kit (TransGen). Vektor yang telah dirakit ditransformasikan ke dalam sel kompeten E. coli DH5α (TransGen). Vektor ekspresional, knockout, dan overekspresi yang dikonstruksi terlebih dahulu ditransformasikan ke dalam IM08B dan kemudian vektor yang diverifikasi ke dalam galur S. aureus yang ditargetkan melalui elektroporasi. Untuk mengintegrasikan vektor ke dalam kromosom, satu koloni dari pelat transformasi diinokulasi ke dalam 2 mL TSB + Cm (50 μg/mL) dan diinkubasi semalaman pada suhu 43°C. Kultur kemudian digoreskan pada TSA + Cm (25 μg/mL) dan diinkubasi selama malam kedua pada suhu 43°C. Koloni besar disuspensikan kembali ke dalam TSB, diinkubasi selama malam berikutnya pada suhu 30°C, dan selanjutnya ditanamkan ke dalam TSA yang mengandung 1 μg/mL anhidrotetrasiklin. Pelat kemudian diinkubasi pada suhu 30°C semalaman. Koloni besar ditempelkan pada TSA dan TSA + Cm (25 μg/mL) dan ditumbuhkan pada suhu 37°C semalaman. Koloni yang rentan terhadap kloramfenikol disaring melalui PCR dengan oligonukleotida untuk menentukan apakah klon mengandung mutasi yang diinginkan.
2.8 Pembentukan Biofilm
Strain pertama kali diinkubasi dalam TSB pada suhu 37°C selama 24 jam. Kemudian, 20 μL suspensi sel dan 180 μL kaldu TSB segar ditambahkan ke pelat mikrotiter polistirena steril 96-sumur. Sebagai kontrol negatif, 200 μL TSB saja digunakan. Setelah inkubasi pada suhu 37°C selama 24 jam, sumur rangkap tiga dicuci dengan 200 μL PBS, dibalik selama 15 menit hingga kering, dan diwarnai dengan 200 μL kristal violet 1% selama 15 menit. Sumur kemudian dicuci dua kali dengan PBS dan diisi dengan 200 μL larutan aseton-etanol (20:80, vol/vol). Kepadatan optik (OD) pada 595 nm diukur menggunakan pembaca mikroplat (Molecular Devices Co., Sunnyvale, CA). Nilai batas OD (ODc) ditetapkan sebagai tiga standar deviasi di atas rata-rata OD dari kontrol negatif. Kemampuan membentuk biofilm diklasifikasikan menurut Pieniz et al. (2015) sebagai berikut: OD ≤ ODc sebagai penghasil nonbiofilm (0), ODc < OD ≤ 2 ODc sebagai penghasil biofilm lemah (+), 2 ODc < OD ≤ 4 ODc sebagai penghasil biofilm sedang (++), dan OD ≥ 4 ODc sebagai penghasil biofilm kuat (+++).
2.9 Triton X-100 Autolisis Terinduksi
Lima puluh mililiter sel bakteri dikumpulkan dari kultur yang tumbuh secara eksponensial awal (OD600 = 0,7) dan diobati dengan basitrasin pada konsentrasi 1 MIC (64 μg/mL) atau NZ2114 (4 μg/mL). Kelompok kontrol tanpa pengobatan AMP diinkubasi pada suhu 37°C selama 1 jam. Sel dicuci dua kali dengan 50 mL air dingin dan disuspensikan kembali dalam 50 mL Tris-HCl (pH 7,2) yang mengandung 0,05% (vol/vol) Triton X-100. Autolisis diukur selama inkubasi pada suhu 37°C sebagai penurunan kekeruhan pada 600 nm menggunakan pembaca mikroplat.
2.10 Uji Pengikatan Sitokrom c
Strain diperlakukan dengan basitrasin pada konsentrasi 1 MIC (64 μg/mL) atau NZ2114 (4 μg/mL), sedangkan kelompok kontrol tanpa perlakuan AMP diinkubasi pada suhu 37°C selama 1 jam. Kultur fase stasioner dicuci dua kali dengan buffer asam morfolinpropanasulfonat (MOPS) (20 mM, pH 7,0) dan dipekatkan hingga OD600 sekitar 7,0. Suspensi sel (1 mL) diinkubasi dengan sitokrom c (0,5 mg/mL) selama 15 menit pada suhu ruangan, lalu dipanen dengan sentrifugasi pada kecepatan 13.000 × g selama 5 menit. Sitokrom c yang tersisa dalam supernatan diukur secara spektrofotometri pada 530 nm. Jumlah sitokrom c yang terikat pada sel dihitung dan dinyatakan sebagai persentase.
2.11 Pengukuran ROS Intraseluler
Kandungan ROS intraseluler diukur menggunakan probe DCFH-DA (5 μM). Bakteri dicuci dua kali dengan PBS untuk menghilangkan DCFH-DA ekstraseluler. Intensitas fluoresensi direkam menggunakan pembaca mikroplat multifungsi TECAN Infinite F200 dengan panjang gelombang eksitasi 485 nm dan panjang gelombang emisi 535 nm. Akumulasi ROS diukur dengan membandingkan intensitas fluoresensi sel yang diobati dengan nisin (256 μg/mL) atau NZ2114 (4 μg/mL) dengan sel kontrol yang tidak diobati. Sebanyak 100 μM 2,2 ′- bipiridina ditambahkan untuk mengurangi konsentrasi ion besi, dan eksperimen anaerobik dilakukan di stasiun kerja anaerobik.
2.12 Estimasi Tingkat Mutasi
Tingkat mutasi bakteri ditentukan menggunakan metode penyaringan resistensi rifampisin. Tiga koloni dari setiap galur diinokulasi ke dalam media TSB dan diinkubasi selama 24 jam. Kultur kemudian diencerkan 10 7 – kali lipat untuk meminimalkan keberadaan mutan fase stasioner yang sudah ada sebelumnya. Kultur bakteri yang diencerkan digunakan untuk membuat delapan kultur replikasi untuk setiap koloni. Setelah inkubasi semalam pada suhu 37 °C, 5 mL dari setiap kultur replikasi diencerkan 10 7 – atau 10 8 – kali lipat dan ditanam pada pelat agar TSB untuk memperkirakan kepadatan populasi. Secara paralel, 100 μL dari setiap kultur ditanam pada pelat agar TSB yang mengandung rifampisin 100 mg/L. Pelat TSB diinkubasi pada suhu 37 °C selama 24 jam, sedangkan pelat rifampisin selektif diinkubasi pada suhu 37 °C selama 48–72 jam. Frekuensi mutasi dihitung dengan membagi CFU/mL pada pelat antibiotik selektif dengan pelat bebas antibiotik. Sebanyak 100 μM 2,2 ′- bipiridina ditambahkan untuk mengurangi konsentrasi ion besi, dan percobaan anaerobik dilakukan di stasiun kerja anaerobik.
2.13 Uji Konsumsi Oksigen
Suspensikan kembali S. aureus semalaman dalam KPN (20 mM kalium fosfat, 140 mM NaCl, pH 7,2), hancurkan dalam mesin pres 16.000 psi, dan sentrifus pada 6000 × g selama 30 menit. Sentrifus supernatan menggunakan ultracentrifuge pada 150.000 × g selama 40 menit. Suspensikan kembali presipitat yang diperoleh dan sentrifus pada 12.000 × g selama 30 menit. Konsentrasi protein diperkirakan menggunakan kit uji protein BCA (Beyotime Biotechnology, Shanghai, Cina). Vesikel membran (0,2 mg/mL) disuspensikan dalam buffer kalium fosfat (pH 7,4) pada suhu 37°C dan konsumsi oksigen diukur dengan polarografi. Konsentrasi oksigen awal ditetapkan menjadi 100%, dan hasil penentuan dinyatakan sebagai kandungan oksigen relatif. 1 mM NADH ditambahkan untuk memulai respirasi. Selanjutnya, NZ2114 ditambahkan ke campuran reaksi, diikuti dengan penambahan dithiothreitol dan ubiquinone-10.
2.14 Uji Rasio NAD+/NADH Bakteri
Rasio NAD+/NADH pada S. aureus ditentukan menggunakan metode WST-8 dengan kit uji rasio NAD+/NADH (Beyotime Biotechnology, Shanghai, Tiongkok). Lisat disiapkan dengan menginkubasi suspensi sel (OD600 = 0,5) dengan 400 μL buffer ekstraksi selama 10 menit. Setelah sentrifugasi, 50 μL supernatan direaksikan pada suhu 60°C selama 30 menit untuk menguraikan NAD+. Setelah menambahkan 90 μL larutan kerja alkohol dehidrogenase, sel diinkubasi pada suhu 37°C dalam gelap selama 10 menit, dan kemudian ditambahkan dengan 10 μL larutan kromogenik untuk inkubasi tambahan selama 30 menit. Absorbansi diukur pada 450 nm, dan nilai NAD+/NADH dihitung.
2.15 Analisis Statistik
Data eksperimen diproses secara grafis menggunakan perangkat lunak GraphPad Prism 8.0 (GraphPad Prism Software Inc., San Diego, CA, AS). Analisis statistik dilakukan menggunakan uji – t antara dua kelompok, dengan signifikansi yang ditetapkan sebagai nilai- p < 0,05.
3 Hasil
3.1 NZ2114 Menginduksi Resistensi yang Stabil dan Dapat Diwariskan pada S. aureus
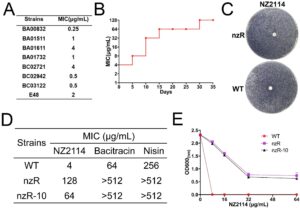
Untuk menilai potensi S. aureus untuk mengembangkan resistansi terhadap AMP NZ2114, kami secara acak memilih delapan galur S. aureus . Konsentrasi hambat minimum (MIC) NZ2114 terhadap galur-galur ini berkisar dari 0,25 hingga 4 μg/mL, yang menunjukkan aktivitas antibakteri yang poten (Gambar 1A ). Di antara galur-galur ini, BA01611 adalah satu-satunya galur yang resistan terhadap methicillin (MRSA) dan ditetapkan sebagai tipe liar (WT) untuk analisis lebih lanjut, dengan MIC awal 4 μg/mL. Untuk mengevaluasi perkembangan resistansi, galur WT diekspos ke konsentrasi sub-inhibitor NZ2114 selama 35 hari berturut-turut. Peningkatan signifikan dalam MIC diamati dari waktu ke waktu, meningkat dari 4 menjadi 8 μg/mL pada hari ke-5 dan mencapai 128 μg/mL pada hari ke-30, yang menunjukkan peningkatan resistansi sebanyak 32 kali lipat (Gambar 1B ). Peningkatan yang cepat ini menyoroti kemampuan S. aureus untuk memperoleh resistensi antimikroba yang substansial dalam waktu singkat. Untuk menentukan stabilitas resistensi yang diinduksi ini, kami mengisolasi isolat yang resistan terhadap satu koloni pada hari ke-35, yang dinamakan nzR. Dibandingkan dengan zona penghambatan dengan diameter 1,65 cm yang dihasilkan oleh NZ2114 pada WT, efek penghambatan NZ2114 pada galur nzR tidak signifikan (Gambar 1C ). Galur tersebut selanjutnya dilewatkan tanpa NZ2114 selama 10 hari, menghasilkan galur turunan, nzR-10 (satu koloni). Meskipun tidak adanya tekanan selektif, nzR-10 mempertahankan resistensi yang kuat, dengan MIC 64 μg/mL dibandingkan dengan 128 μg/mL untuk nzR (Gambar 1D ). Hal ini menunjukkan bahwa resistensi yang diperoleh bersifat stabil dan dapat diwariskan. Kami selanjutnya mengonfirmasi peningkatan kelangsungan hidup galur nzR dan nzR-10 dalam uji ko-inkubasi. Setelah 2,5 jam paparan 64 μg/mL NZ2114, sel WT dihambat sepenuhnya, sedangkan sekitar 50% sel nzR-10 bertahan hidup (Gambar 1E ). Hasil ini menggarisbawahi stabilitas dan heritabilitas resistensi terhadap AMP pada S. aureus . Selain itu, galur nzR-10 menunjukkan resistensi silang yang signifikan terhadap AMP lain, termasuk basitrasin dan nisin
3.2 Beberapa Faktor Genetik Berkontribusi pada Resistensi S. aureus terhadap NZ2114
Untuk menyelidiki mekanisme yang mendorong resistensi S. aureus terhadap AMP NZ2114, kami melakukan sekuensing genom utuh dari galur tipe liar (WT) dan galur resisten (nzR), yang mengungkap tiga mutasi missense dan dua mutasi nonsense pada galur nzR (Gambar 2A ). Secara khusus, kami mengidentifikasi mutasi missense pada gen tarL , lytD , dan braS , sedangkan mutasi nonsense ditemukan pada gen tarS dan ndh (Gambar 2A ). Untuk menjelaskan dampak fungsional dari mutasi ini, kami membuat galur overekspresi untuk masing-masing dari lima gen bermutasi dalam latar belakang nzR, yang ditetapkan sebagai nzR-p tarL , nzR-p lytD , nzR-p braS , nzR-p tarS , dan nzR-p ndh . Analisis kurva pertumbuhan tidak menunjukkan perbedaan signifikan dalam laju pertumbuhan di antara galur overekspresi dibandingkan dengan nzR (Informasi Pendukung S1 : Gambar S1A). Namun, uji konsentrasi hambat minimum (MIC) mengungkapkan bahwa ekspresi berlebih dari empat gen kecuali nzR-p tarS secara signifikan menurunkan nilai MIC NZ2114 terhadap strain ini, dengan MIC terhadap nzR-p lytD berkurang hingga 16 μ/mL (Gambar 2B ).
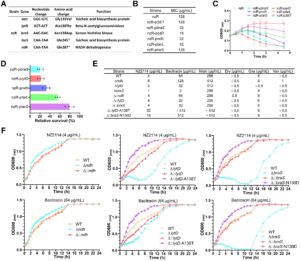
Uji time-kill pada konsentrasi NZ2114 sebesar 128 μg/mL menunjukkan bahwa konsentrasi bakteri dari kelima strain yang mengalami overekspresi menurun seiring waktu, dengan tingkat bakterisidal yang secara signifikan lebih tinggi dibandingkan dengan strain nzR (Gambar 2C ). Hitungan unit pembentuk koloni (CFU) setelah 4,5 jam pengobatan menunjukkan bahwa tingkat kelangsungan hidup relatif dari strain yang mengalami overekspresi menurun menjadi 19,4% (nzR-p braS ) dari 79,2% (nzR-p tarS ) dibandingkan dengan nzR (Gambar 2D ). Temuan ini menunjukkan bahwa hilangnya atau perubahan fungsi dari kelima gen ini berkontribusi terhadap resistensi NZ2114 pada S. aureus , dengan braS , ndh , dan lytD memainkan peran yang lebih signifikan, sedangkan tarS berkontribusi paling sedikit. Untuk menyelidiki lebih lanjut peran braS, ndh , dan lytD dalam resistensi antimikroba, kami membuat galur knockout gen dan galur komplementasi yang sesuai dalam latar belakang WT, yang diberi nama Δ ndh , Δ lytD , Δ braS , dan Δ:: ndh , Δ:: lytD , dan Δ:: braS , masing-masing. Analisis kurva pertumbuhan menunjukkan bahwa penghapusan gen-gen ini tidak memengaruhi pertumbuhan bakteri dibandingkan dengan galur WT (Informasi Pendukung S1 : Gambar S1B–D). Uji MIC menunjukkan bahwa knockout ndh meningkatkan resistensi terhadap NZ2114, basitrasin, dan nisin sebanyak dua kali lipat, sedangkan penghapusan lytD dan braS menurunkan resistensi terhadap NZ2114 dan basitrasin (Gambar 2E ). Khususnya, MIC basitrasin terhadap galur Δ braS menurun 32 kali lipat menjadi 2 μg/mL, dan MIC NZ2114 menurun empat kali lipat menjadi 1 μg/mL, sedangkan MIC nisin tetap tidak berubah. Nilai MIC untuk galur yang dilengkapi serupa dengan WT, yang mengonfirmasi peran spesifik gen-gen ini dalam resistensi antimikroba (Gambar 2E ).
Konsisten dengan hasil MIC, kurva pertumbuhan dengan adanya NZ2114 (4 μg/mL) atau bacitracin (64 μg/mL) menunjukkan bahwa galur Δ lytD dan Δ braS memperlihatkan penghambatan pertumbuhan yang signifikan, sedangkan galur Δ ndh memperlihatkan peningkatan pertumbuhan dibandingkan dengan WT dalam kondisi yang sama (Gambar 2F ). Laju pertumbuhan galur yang dilengkapi sebanding dengan WT, menunjukkan keberhasilan pemulihan fungsi (Gambar 2F ). Pada galur nzR, ndh mengandung mutasi pemotongan, sedangkan lytD dan braS mempunyai substitusi asam amino, yang menunjukkan bahwa perubahan fungsional daripada hilangnya fungsi pada lytD dan braS yang berkontribusi terhadap resistensi. Untuk menguji hipotesis ini, kami menyusun galur komplementasi mutan terarah-situs Δ ::lytD- A138T dan Δ ::braS- N130D dengan memperkenalkan perubahan asam amino spesifik yang diamati dalam nzR ke dalam latar belakang Δ lytD dan Δ braS , masing-masing. Alanin pada posisi 138 dari protein LytD dimutasi menjadi treonin, dan asparagin pada posisi 130 dari protein BraS dimutasi menjadi aspartat. Pengujian MIC mengungkapkan bahwa mutasi ini secara signifikan meningkatkan resistensi terhadap NZ2114, basitrasin, dan nisin dibandingkan dengan WT (Gambar 2E ). Secara khusus, nilai MIC terhadap Δ:: lytD -A138T meningkat menjadi 32 μg/mL untuk NZ2114 dan > 512 μg/mL untuk basitrasin dan nisin. Demikian pula, nilai MIC terhadap Δ::braS- N130D meningkat menjadi 16 μg/mL untuk NZ2114 dan 512 μg/mL untuk basitrasin (Gambar 2E ). Analisis kurva pertumbuhan menunjukkan bahwa NZ2114 dan basitrasin tidak menghambat pertumbuhan galur mutan ini secara signifikan (Gambar 2F ), yang mengonfirmasi bahwa substitusi asam amino spesifik dalam LytD dan BraS meningkatkan resistensi.
Untuk menilai efek ndh , braS , dan lytD pada kerentanan antibiotik, kami menentukan MIC dari berbagai antibiotik. Galur Δ lytD dan Δ braS menunjukkan penurunan resistensi terhadap oksasilin masing-masing sebesar 16 kali lipat dan 2 kali lipat, sedangkan resistensinya terhadap vankomisin dan eritromisin tetap sebanding dengan WT (Gambar 2E ). Galur Δ ndh menunjukkan sedikit peningkatan resistensi terhadap vankomisin (dari 0,5 μg/mL menjadi 1 μg/mL) tetapi tidak ada perubahan resistensi terhadap oksasilin dan eritromisin. Galur substitusi asam amino Δ ::lytD- A138T dan Δ ::braS- N130D menunjukkan profil resistensi antibiotik yang mirip dengan WT, yang menunjukkan bahwa mutasi ini secara khusus memengaruhi resistensi terhadap AMP daripada antibiotik konvensional.
3.3 AMP Berpengaruh terhadap Tingkat Anion Permukaan dan Pembentukan Biofilm pada S. aureus
AMP kationik memberikan efek bakterisidanya terutama melalui interaksi dengan komponen anionik pada permukaan bakteri. Untuk menyelidiki mekanisme ini pada S. aureus , kami mengukur pengikatan sitokrom c untuk menilai perubahan kadar anion permukaan pada strain tipe liar (WT) dan mutan turunannya. Penghapusan gen braS atau lytD secara signifikan meningkatkan kadar anion permukaan, sedangkan penghapusan ndh atau pengenalan mutasi asam amino pada braS atau lytD menurunkan kadar ini (Gambar 3A ). Pengamatan ini selaras dengan uji deteksi resistensi, yang menunjukkan bahwa peningkatan kadar anion permukaan meningkatkan pengikatan dan kemanjuran bakterisida AMP kationik dan bahwa modulasi muatan permukaan merupakan faktor kunci dalam resistensi AMP. Percobaan selanjutnya menunjukkan bahwa pengobatan dengan AMP NZ2114 dan bacitracin menurunkan kadar anion permukaan pada S. aureus WT (Gambar 3B,C ), yang menunjukkan bahwa bakteri tersebut dapat mengurangi efikasi AMP dengan mengurangi muatan anionik permukaan. Khususnya, strain mutan menunjukkan fenotip anionik permukaan yang beragam setelah pengobatan AMP (Gambar 3B,C ). Pengobatan NZ2114 secara signifikan meningkatkan kadar anion permukaan pada mutan Δ ndh , Δ braS , dan Δ:: lytD- A138T dibandingkan dengan WT yang diobati, sedangkan mutan Δ::braS- N130D menunjukkan penurunan yang signifikan, dan mutan Δ lytD tetap tidak terpengaruh (Gambar 3B ). Pengobatan basitrasin sedikit meningkatkan kadar anion permukaan pada mutan Δ ndh tetapi menurunkannya pada mutan Δ lytD , Δ braS , Δ ::lytD- A138T, dan Δ ::braS- N130D (Gambar 3C ). Hasil ini menunjukkan bahwa S. aureus dapat memodulasi kadar anion permukaan sebagai respons terhadap paparan AMP dan bahwa ndh , braS , dan lytD memainkan peran penting dalam mekanisme pengaturan ini. Ketiadaan faktor-faktor ini mengganggu kemampuan bakteri untuk menyesuaikan muatan permukaan dan melawan AMP.
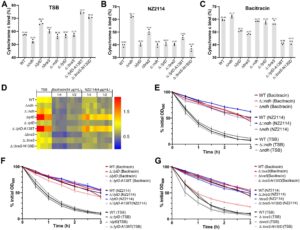
Di luar modulasi anion permukaan, pembentukan biofilm secara signifikan memengaruhi resistensi bakteri. Kami menilai kemampuan pembentukan biofilm dari strain WT, knockout gen, dan strain yang dilengkapi dengan atau tanpa AMP. Mutan Δ ndh , Δ braS , dan Δ ::braS- N130D menunjukkan pembentukan biofilm yang sedikit berkurang, sedangkan mutan Δ lytD dan Δ ::lytD- A138T menunjukkan pembentukan biofilm yang meningkat secara signifikan (Gambar 3D ). Pengobatan dengan basitrasin dan NZ2114 mengurangi pembentukan biofilm pada WT dan semua strain mutan, dengan basitrasin menunjukkan penghambatan yang sangat kuat pada strain Δ lytD dan Δ ::lytD- A138T (Gambar 3D ). Kami juga mengevaluasi autolisis bakteri, yang terkait dengan metabolisme dinding sel dan resistensi obat, menggunakan uji autolisis yang diinduksi Triton X-100. Dalam kondisi normal, profil autolisis semua strain knockout dan komplementasi mirip dengan WT, yang menunjukkan bahwa penghapusan ndh , lytD , atau braS tidak memengaruhi metabolisme dinding sel secara signifikan (Gambar 3E–G ). Namun, setelah pengobatan AMP, kapasitas autolitik WT dan turunannya menurun (Gambar 3E–G ). Khususnya, pengobatan basitrasin (64 μg/mL) secara signifikan mempercepat autolisis pada mutan Δ braS , sedangkan laju autolisis strain komplementasi kembali ke tingkat WT (Gambar 3G ). Temuan ini menunjukkan bahwa penghapusan braS dan pengobatan basitrasin dapat berdampak negatif pada kapasitas metabolisme dinding sel S. aureus , yang berpotensi memengaruhi kerentanannya terhadap AMP.
3.4 AMP Menghambat Kelangsungan Hidup S. aureus dengan Meningkatkan Tingkat ROS Intraseluler dan Tingkat Mutasi
Mengingat peran penting protein NDH-2, yang dikodekan oleh gen ndh , dalam metabolisme ROS bakteri [ 24 ], kami berusaha untuk menyelidiki bagaimana AMP memengaruhi kelangsungan hidup S. aureus dengan memodulasi kadar ROS intraseluler. Kami mengukur konsentrasi ROS intraseluler pada S. aureus tipe liar (WT) setelah pengobatan dengan berbagai konsentrasi AMP NZ2114 dan nisin. Hasil kami menunjukkan peningkatan kadar ROS intraseluler yang bergantung pada dosis dengan meningkatnya konsentrasi AMP (Gambar 4A ), yang menunjukkan bahwa peptida ini dapat menghambat kelangsungan hidup bakteri dengan meningkatkan akumulasi ROS. Untuk lebih jauh mengeksplorasi peran ndh dalam proses ini, kami memeriksa kadar ROS intraseluler pada strain knockout ndh (Δ ndh ) yang diobati dengan AMP yang sama. Berbeda dengan strain WT, kadar ROS intraseluler pada Δ ndh tetap tidak berubah setelah pengobatan dengan NZ2114 dan nisin (Gambar 4B ). Penemuan ini menunjukkan bahwa penghapusan gen ndh mengganggu kemampuan AMP untuk meningkatkan ROS intraseluler, sehingga berpotensi mengurangi efek penghambatannya terhadap kelangsungan hidup bakteri.
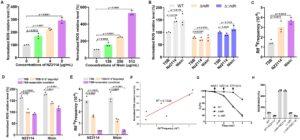
Karena tingkat ROS yang tinggi sering dikaitkan dengan peningkatan laju mutasi bakteri, selanjutnya kami menilai dampak AMP pada laju mutasi S. aureus menggunakan uji resistensi rifampisin. Dalam kondisi kultivasi dengan pengocokan, pengobatan dengan NZ2114 dan nisin menyebabkan peningkatan yang signifikan pada laju mutasi galur WT (Gambar 4C ). Untuk mengonfirmasi bahwa peningkatan laju mutasi ini didorong oleh peningkatan tingkat ROS intraseluler, kami mengurangi konsentrasi ion besi dan ketersediaan oksigen, yang keduanya diketahui memengaruhi produksi ROS. Dalam kondisi ini, produksi ROS pada galur WT menurun secara signifikan setelah pengobatan AMP (Gambar 4D ), dan laju mutasi rifampisin berkurang secara bersamaan (Gambar 4E ). Analisis regresi linear tingkat ROS dan laju mutasi rifampisin dalam berbagai kondisi mengungkapkan korelasi positif yang kuat antara keduanya ( R2 = 0,7538 ) (Gambar 4F ), memperkuat hubungan antara produksi ROS dan laju mutasi setelah pengobatan AMP.
Konsumsi oksigen dari vesikel membran yang berasal dari strain S. aureus yang berbeda telah ditentukan (Gambar 4G ). Ketika NADH ditambahkan, konsumsi oksigen linear langsung diamati pada WT dan Δ:: ndh . Konsumsi oksigen lebih lanjut ditingkatkan setelah perlakuan NZ2114 serta dithiothreitol/ubiquinone-10 (DTT + Q10). Namun, tidak ada perbedaan konsumsi oksigen pada strain Δ ndh setelah penambahan NADH atau NZ2114. Nilai tersebut ditingkatkan setelah perlakuan DTT + Q10, yang memperbaiki rantai pernapasan yang rusak yang disebabkan oleh mutasi ndh . Lebih lanjut, rasio NADH/NAD + diukur pada S. aureus yang berbeda dengan perlakuan NZ2114 atau tidak, 100% sesuai dengan rasio NADH/NAD + sebesar 0,003 (Gambar 4H ). AMP NZ2114 mempromosikan reoksidasi NADH menjadi NAD+, yang menghasilkan penurunan rasio NADH/NAD+ pada WT dan Δ:: ndh . Karena hilangnya fungsi NDH-2, rasio NADH/NAD+ pada galur Δ:: ndh meningkat secara signifikan dan tidak terpengaruh oleh pemrosesan NZ2114. Untuk menganalisis efek langsung AMP pada fungsi NDH-2, kami melakukan docking molekuler untuk NDH-2 dan NZ2114. Hasilnya menunjukkan bahwa asam amino yang bertanggung jawab untuk mengikat NZ2114 pada NDH-2 adalah Lys40, Glu42, Tye43, Gln80, Asn96, Ser113, Lys122, dan Glu129 (Informasi Pendukung S1 : Gambar S2). Residu asam amino ini semuanya terletak di celah pengikatan NDH-2 untuk substrat FAD [ 25 ], sehingga kemungkinan pengikatan NZ2114 ke NDH-2 dapat menghambat pengikatan FAD secara kompetitif. Secara kolektif, temuan ini menunjukkan bahwa AMP memberikan efek bakterisidanya dengan meningkatkan konsumsi oksigen intraseluler dan akumulasi ROS, serta meningkatkan laju mutasi pada S. aureus . Gangguan efek ini pada galur Δ ndh lebih lanjut menunjukkan bahwa gen ndh memainkan peran penting dalam memediasi aktivitas antimikroba peptida melalui jalur yang bergantung pada ROS ini.
4 Diskusi
Sampai saat ini, lebih dari 2500 AMP telah diidentifikasi, yang memperoleh perhatian signifikan dalam peternakan dan biomedis karena keuntungan mereka yang berbeda. Meskipun ada kemajuan ini, pemahaman dan pencegahan mekanisme resistensi AMP tetap menjadi tantangan penting. Dalam penelitian ini, kami menghasilkan strain S. aureus yang resistan terhadap AMP melalui paparan berkelanjutan terhadap NZ2114. Strain ini menunjukkan resistensi silang terhadap AMP lain, seperti nisin dan basitrasin, dengan sifat resistensi yang stabil dan dapat diwariskan. Analisis genomik komparatif mengungkapkan lima gen bermutasi yang terkait dengan resistensi AMP: ndh , braS , lytD , tarL , dan tarS . Yang penting, gen-gen ini berfungsi dalam berbagai jalur yang penting untuk kelangsungan hidup dan resistensi bakteri, termasuk transpor elektron, transduksi sinyal, dan sintesis dinding sel. Knockout gen ndh atau mutasi spesifik situs di braS dan lytD semakin meningkatkan resistensi bakteri terhadap AMP. Menariknya, meskipun resistensi terhadap AMP terus berkembang, galur yang resistan tidak mengembangkan resistensi silang terhadap antibiotik tradisional. Hal ini menunjukkan bahwa mekanisme resistensi terhadap AMP dan antibiotik mungkin melibatkan jalur atau target molekuler yang berbeda, sehingga berpotensi menjadikan penggunaan antibiotik dan AMP secara bersamaan sebagai strategi yang menjanjikan untuk memerangi infeksi S. aureus dan mencegah resistensi obat.
Bakteri biasanya resisten terhadap AMP melalui beberapa mekanisme, seperti modifikasi membran, aktivasi pompa efluks, sekresi protease, pembentukan biofilm, dan mutasi gen [ 26 ]. Pada S. aureus , resistensi terhadap lantibiotik dapat dimediasi oleh transporter AMP [ 27 ], sedangkan protease seperti aureolysin mendegradasi AMP, mencegah efek bakterisidanya [ 28 ]. Lebih jauh lagi, penggabungan molekul bermuatan positif ke dalam asam teikoat dinding (WTA) mengurangi muatan negatif keseluruhan permukaan bakteri, sehingga mengurangi pengikatan AMP [ 27 ]. WTA sangat penting untuk pembelahan sel bakteri, morfologi, dan virulensi [ 29 ], tetapi sifatnya yang bermuatan negatif menjadikannya target untuk AMP kationik. Studi kami mengungkapkan bahwa mutan yang resisten terhadap AMP telah mengurangi muatan permukaan negatif secara signifikan. Gen tarL dan tarS , yang terlibat dalam sintesis WTA, dan ndh , braS , dan lytD , yang memengaruhi sintesis peptidoglikan, kemungkinan berkontribusi terhadap perubahan ini. Dengan mengurangi muatan anionik pada permukaan bakteri, mutasi ini mengurangi pengikatan AMP dan meningkatkan resistensi. Ini sejalan dengan temuan sebelumnya bahwa muatan permukaan yang berkurang pada S. aureus menghambat pengikatan AMP, termasuk AMP seperti nisin, HNP1-3, dan gallidermin [ 30 ]. Selain itu, D-alanilasi membran sel bakteri mengurangi muatan permukaan negatifnya, yang selanjutnya mengurangi pengikatan AMP dan memfasilitasi perkembangan bakteri yang resistan terhadap obat [ 30 ]. Secara kolektif, temuan ini menunjukkan bahwa penurunan tingkat anion pada permukaan bakteri merupakan mekanisme penting bagi bakteri untuk mengembangkan resistensi terhadap AMP.
Dua ribitol fosfat polimerase (yang dikodekan oleh tarK dan tarL ) hadir di semua strain S. aureus , dengan identitas urutan 79%. Sebuah studi sebelumnya menemukan mutan di tarK atau tarL tidak dapat mempengaruhi kadar WTA di S. aureus , yang menunjukkan bahwa enzim tar K dan tar L secara fungsional redundan [ 31 ]. Selain itu, rantai ribitol fosfat terpolimerisasi (RboP) di WTA dapat diglikosilasi oleh tar S dan tar M dengan β-1,4-GlcNAc dan α-1,4-GlcNAc, masing-masing [ 32 ]. Kondisi lingkungan, seperti konsentrasi garam tinggi, mempengaruhi kelimpahan dan rasio dekorasi WTA α-1,4- dan -β1,4-GlcNAc, sehingga mempengaruhi sifat biologis seperti pengikatan antibodi dan infeksi fag [ 33 ]. Beberapa penelitian menunjukkan bahwa fag menginfeksi tarM tetapi tidak menginfeksi S. aureus mutant tarS [ 34 – 37 ]. Penelitian lain menemukan bahwa knockout tarS mengakibatkan resistensi β-lactam pada MRSA [ 38 ], dan kegagalan pengenalan Langerin [ 39 ] dan anti-WTA IgG [ 40 ], tetapi tidak mengalami defek pertumbuhan atau pembelahan sel [ 38 ]. Meskipun strain S. aureus intermediet vankomisin sebagian besar memiliki WTA terglikosilasi β, tetapi masih kurang bukti langsung yang menghubungkan tarS dengan resistensi vankomisin pada S. aureus [ 41 ].
Gen ndh mengkode NADH quinone oxidoreductase (NDH-2), komponen kunci dari rantai transpor elektron dari NADH ke quinone melalui FAD, serta produksi ROS intraseluler [ 24 ]. Mengingat peran pentingnya dalam sintesis ATP dan ketidakhadirannya pada mamalia, NDH-2 telah dikenal sebagai target antibiotik yang menjanjikan. Beberapa inhibitor NDH-2, seperti fenotiazin, kriptotanshinon, dan mirisetin, telah menunjukkan kemampuan untuk menghambat pertumbuhan S. aureus [ 42 – 44 ]. Sebuah studi sebelumnya menemukan inaktivasi ndh meningkatkan resistensi S. aureus terhadap gentamisin dari 1 μg/mL menjadi 3 μg/mL [ 45 ], dan studi lain menemukan tidak adanya ndh menghilangkan pembentukan biofilm, produksi toksin-a, dan mengurangi kemampuan untuk menjajah organ tertentu dalam model tikus infeksi sistemik [ 46 ]. Studi kami menunjukkan bahwa AMP menghambat S. aureus dengan meningkatkan produksi ROS dan meningkatkan laju mutasi, yang berkontribusi pada efek bakterisida AMP. Namun, knockout ndh mengurangi efek ini, memfasilitasi resistensi. Cacat pada rantai transpor elektron, seperti yang disebabkan oleh mutasi ndh , sebelumnya telah dikaitkan dengan resistensi AMP. Misalnya, cacat rantai transpor elektron memberikan resistensi terhadap laktoferisin B pada S. aureus [ 47 ]. Hubungan antara produksi ROS dan laju mutasi bakteri sangat penting untuk evolusi resistensi, seperti yang ditunjukkan dalam studi di mana polimiksin menginduksi pembunuhan bakteri yang cepat melalui pembentukan ROS [ 48 ], dan AMP LL-37 secara signifikan meningkatkan laju mutasi pada Pseudomonas aeruginosa dan E. coli [ 49 ]. Oleh karena itu, ndh kemungkinan merupakan gen target penting untuk resistensi AMP. Mutasi pada ndh mengubah rantai transpor elektron dan potensial membran, memengaruhi produksi ROS dan laju mutasi bakteri, yang pada akhirnya memfasilitasi perkembangan resistensi.
Remodeling peptidoglikan, yang penting untuk pertumbuhan dan pembelahan bakteri, juga memainkan peran penting dalam resistensi AMP. Peptidoglikan hidrolase LytD menghidrolisis ikatan β-(1,4)-glikosidik dalam polimer N-asetilglukosamin–N-asam asetilmuramat, memfasilitasi penyisipan monomer peptidoglikan baru selama ekspansi dinding sel [ 50 ]. Mutasi L139F pada LytD meningkatkan MIC sefarolin terhadap S. aureus dari 8 μg/mL menjadi 16 μg/mL [ 51 ]. Dalam penelitian kami, substitusi asam amino tunggal (A138T) pada LytD cukup untuk memberikan resistensi terhadap AMP, menyoroti pentingnya aktivitas peptidoglikan hidrolase dalam pertahanan bakteri terhadap kerusakan yang disebabkan AMP. Karena peptidoglikan memainkan peran penting dalam resistensi bakteri terhadap pembunuhan AMP, mutasi pada hidrolase peptidoglikan seperti LytD dapat memengaruhi pengikatan enzim dan efisiensi hidrolisis pada lokasi target dalam peptidoglikan. Penelitian selanjutnya harus difokuskan pada penjelasan struktur tiga dimensi LytD untuk lebih memahami mekanisme ini.
Histidin kinase braS, bagian dari sistem regulasi dua komponen BraRS, merasakan sinyal eksternal dan mengaktifkan braR, yang mengatur gen hilir yang terlibat dalam sintesis dinding sel, modifikasi lipid membran, dan fungsi transporter [ 52 ]. Laporan pertama BraRS (Bacitracin resistance associated), yang juga dikenal sebagai NsaRS (Nisin-associated-sensitivity-response-regulator), adalah karena peran pentingnya untuk resistensi basitrasin dan nisin [ 53 , 54 ]. BraRS juga telah terbukti mengaktifkan operon vraDE yang mengkode pompa efluks untuk ekspresi, yang memberi S. aureus resistensi terhadap nisin dan basitrasin [ 53 ]. Dalam penelitian kami, kami mengidentifikasi mutasi pada posisi 130 BraS (N130D), yang memberikan resistensi terhadap NZ2114, nisin, dan basitrasin. Mutasi ini, yang terletak di dalam domain histidin kinase, kemungkinan mengubah konformasi dan aktivitas kinase, yang mendukung peran BraRS dalam resistensi AMP. Khususnya, mutasi serupa (N130K) di braS telah dikaitkan dengan ekspresi konstitutif operon vraDE , yang berkontribusi pada resistensi nisin [ 55 ]. Selain itu, mutasi pada posisi 105 (A105T) dan 208 (A208E) di braS telah dikaitkan dengan strain S. aureus yang resistan terhadap nisin [ 54 ], dan inaktivasi BraRS secara signifikan meningkatkan kerentanan terhadap bakteriosin kelas I, nukacin ISK-1 dan nisin A [ 56 ], yang selanjutnya menggarisbawahi pentingnya BraRS dalam resistensi AMP.



Tinggalkan Balasan