ABSTRAK
Pencarian terapi antikanker yang efektif semakin difokuskan pada senyawa alami seperti Aloe vera , yang terkenal karena khasiat terapeutiknya. Studi ini menyelidiki khasiat antikanker Aloe vera pada spheroid tumor hati 3D melalui perangkat mikrofluida berbasis PDMS, yang menyediakan model yang lebih realistis secara fisiologis dibandingkan dengan kultur 2D tradisional. Sel HepG2 dikulturkan untuk menghasilkan spheroid 3D pada chip, setelah itu diberikan berbagai konsentrasi Aloe vera dan obat kemoterapi Doxorubicin untuk mengevaluasi efek sitotoksik. Sistem mikrofluida, yang divalidasi oleh simulasi COMSOL, memfasilitasi perfusi berkelanjutan dan penilaian viabilitas sel secara real-time selama durasi 10 hari. Hasilnya menunjukkan bahwa Aloe vera secara nyata mengurangi viabilitas sel dengan memicu apoptosis pada konsentrasi lebih dari 12,5 mg/mL. Nilai IC50 ditentukan pada 72 jam: 25 ± 0,10 mg/mL untuk Aloe vera dan 5,47 ± 0,03 µg/mL untuk Doxorubicin dalam kultur 2D, tetapi dalam kultur 3D, nilai IC50 adalah 31,25 ± 0,14 mg/mL untuk Aloe vera dan 8,33 ± 0,05 µg/mL untuk Doxorubicin. Studi ini menggarisbawahi janji Aloe vera sebagai agen antikanker alami dan menggambarkan kemanjuran platform mikrofluida untuk penyaringan obat yang ditingkatkan dan aplikasi pengobatan yang disesuaikan.
1 Pendahuluan
Kanker masih menjadi tantangan kesehatan masyarakat global yang utama sebagai penyebab kematian kedua, dengan dampak yang luas tidak hanya bagi individu tetapi juga bagi keluarga dan komunitas mereka (Siegel et al. 2024 ). Kebutuhan mendesak untuk mengembangkan perawatan yang efektif untuk penyakit yang kompleks dan multifaset ini telah mendorong upaya penelitian substansial untuk menjelaskan mekanisme yang mendasari karsinogenesis, mengidentifikasi target terapi baru, dan mengembangkan strategi pengobatan yang inovatif (Joshi et al. 2024 ). Kemajuan dalam penelitian antikanker diharapkan dapat meningkatkan tingkat kelangsungan hidup dan merevolusi metode deteksi dini, memberikan lebih banyak peluang untuk intervensi sebelum kanker berkembang ke stadium lanjut. Kemajuan ini juga berasal dari mengungkap jalur molekuler utama yang terlibat dalam perkembangan dan progresi kanker, sambil mendorong kolaborasi lintas berbagai disiplin ilmu dalam memerangi kanker. Para peneliti membuka jalan bagi terciptanya perawatan yang lebih tepat dan personal. Upaya ini didukung oleh penekanan yang semakin besar pada kolaborasi multidisiplin, yang sangat penting untuk menerjemahkan penemuan ilmiah menjadi aplikasi klinis (Carlberg dan Velleuer 2021 ).
Agen antikanker merupakan pusat dari upaya ini. Agen-agen ini secara khusus dirancang atau dipilih karena kemampuannya untuk menargetkan dan menghambat pertumbuhan sel kanker sambil meminimalkan kerusakan pada sel normal (Naeem et al. 2022 ). Berbagai agen antikanker saat ini tersedia, seperti obat kemoterapi (Yadav et al. 2021 ), terapi target (Min dan Lee 2022 ), imunoterapi (Petroni et al. 2021 ), nanopartikel (Kibar et al. 2023 ), dan senyawa alami (Naeem et al. 2022 ). Tujuan inklusif dari agen-agen ini adalah untuk mengganggu berbagai aspek pertumbuhan dan perkembangan kanker. Akibatnya, ada dorongan berkelanjutan untuk menemukan obat antikanker baru, meningkatkan terapi yang ada, dan mengeksplorasi strategi kombinasi baru untuk meningkatkan kemanjuran pengobatan dan mengurangi efek samping.
Bahasa Indonesia: Aloe vera , tanaman sukulen dengan sejarah panjang penggunaan obat tradisional, telah menarik perhatian karena potensinya sebagai antikanker dalam beberapa tahun terakhir. Beberapa penelitian telah menyelidiki berbagai senyawa bioaktif yang ditemukan dalam Aloe vera , termasuk polisakarida, antrakuinon, flavonoid, saponin, dan enzim, untuk menilai potensinya sebagai antikanker (Andrea et al. 2020 ; Palaniyappan et al. 2024 ). Hingga saat ini, temuan eksperimental telah mengungkapkan bahwa ekstrak Aloe vera dan senyawa yang diisolasi menunjukkan aktivitas antikanker terhadap berbagai jenis kanker, termasuk kanker payudara, usus besar, hati, paru-paru, dan kulit, dengan menyebabkan apoptosis, memodulasi sistem imun, mengurangi peradangan, menghambat angiogenesis dan siklus sel, dan penghambatan perbaikan DNA (Catalano et al. 2024 ).
Bahasa Indonesia: Dalam dekade terakhir, Aloe vera telah dieksplorasi dalam berbagai bentuk—ekstrak tanaman utuh, ekstrak daun, gel, pulp, dan bubuk—dalam penelitian kanker (Kumar et al. 2019 ). Misalnya, bentuk ekstrak Aloe vera yang dikeringkan beku dinilai dalam sel HepG2 untuk menunjukkan aktivitas antikanker yang bergantung pada waktu dan dosis (Shalabi et al. 2015 ). Ekstrak ini meningkatkan regulasi gen penekan tumor P53 dan menurunkan regulasi gen antiapoptotik Bcl-2, yang menunjukkan potensinya untuk menginduksi kematian sel kanker pada sel HepG2 dan MCF7 dengan memodulasi jalur kritis ini (Bagherian et al. 2021 ; Shalabi et al. 2015 ). Demikian pula, studi lain yang menyelidiki sifat antikanker ekstrak etanol daun Aloe vera pada lini sel kanker hati manusia (HepG2), serviks (HeLa), dan paru-paru (A549) menunjukkan aktivitas penghambatan proliferasi yang kuat di ketiga lini sel, yang menunjukkan perlunya penyelidikan lebih lanjut ke dalam subkomponen Aloe vera (Algarni 2021 ). Kemudian, sebuah studi yang menguji ekstrak tanaman Aloe vera pada lini sel kanker payudara manusia (MCF-7) dan paru-paru (A-549) melaporkan penghambatan yang signifikan terhadap proliferasi sel, induksi apoptosis melalui generasi spesies oksigen reaktif (ROS), penangkapan siklus sel, dan kerusakan DNA, yang menyoroti Aloe vera sebagai sumber alami potensial senyawa antikanker (Farshori et al. 2022 ). Laux et al. ( 2022 ) baru-baru ini menunjukkan bahwa gel Aloe vera menunjukkan aktivitas anti-melanoma yang signifikan terhadap sel melanoma A375; Namun, selektivitasnya dilaporkan lebih rendah daripada obat antikanker standar seperti dakarbazin. Penelitian selanjutnya pada senyawa bioaktif terisolasi dari Aloe vera , seperti Aloe-emodin—suatu antrakuinon—telah menunjukkan bahwa ia dapat meningkatkan radiosensitivitas pada sel kanker dengan menginduksi apoptosis dan menghambat proliferasi pada sel kanker serviks HeLa dan garis sel karsinoma hepatoseluler (Zhu et al. 2023 ). Selain itu, Luo et al. ( 2024 ) melaporkan bahwa Aloe-emodin dapat menekan migrasi, invasi, dan metastasis kanker payudara dan kanker paru non-kecil dengan memicu apoptosis. Investigasi kimia mengungkapkan bahwa Aloe vera mengandung beragam polisakarida dan senyawa fenolik, khususnya antrakuinon. Khususnya, Badan Internasional untuk Penelitian Kanker (IARC) telah mengklasifikasikan ekstrak daun utuh Aloe vera sebagai kemungkinan karsinogen manusia (Grup 2B) (Guo dan Mei 2016), yang menunjukkan bahwa profil keamanannya memerlukan pertimbangan yang cermat. Meskipun hasil awal menjanjikan, penelitian lebih lanjut diperlukan untuk sepenuhnya menetapkan kemanjuran dan keamanan Aloe vera dalam pengobatan kanker (Wu et al. 2021 ).
Untuk mengevaluasi efikasi dan keamanan senyawa antikanker, sangat penting untuk mengembangkan model kultur sel yang canggih dan relevan secara fisiologis yang menjembatani kesenjangan antara eksperimen in vitro dan hasil klinis (Tosca et al. 2023 ). Dalam beberapa tahun terakhir, kemajuan dalam sistem kultur sel tiga dimensi (3D) dan teknologi mikrofluida telah secara signifikan meningkatkan penelitian kanker dengan memungkinkan terciptanya model yang lebih akurat yang meniru lingkungan mikro tumor yang kompleks (Law et al. 2021 ). Sistem 3D memungkinkan interaksi sel-sel dan sel-matriks ekstraseluler yang lebih baik dibandingkan dengan model kultur dua dimensi (2D) tradisional (Kapałczyńska et al. 2018 ), sementara perangkat mikrofluida memberikan kontrol yang tepat atas lingkungan mikro seluler dan memungkinkan penyaringan obat dengan hasil tinggi (Cardoso et al. 2023 ). Platform ini juga mendukung miniaturisasi, pengaturan kokultur, pencitraan waktu nyata, dan diagnostik point-of-care, yang semuanya berkontribusi pada pengembangan terapi yang lebih personal dan efektif (Tevlek et al. 2023 ). Secara khusus, sistem kultur sel mikrofluida 3D telah banyak digunakan untuk menilai toksisitas obat, khususnya dengan memodelkan lingkungan jaringan seperti hati (Khot et al. 2020 ; Moradi et al. 2020 ; Polidoro et al. 2021 ). Dalam penelitian oleh Do et al. ( 2023 ), perangkat mikrofluida yang terbuat dari polimetilmetakrilat (PMMA) dikembangkan untuk memantau pertumbuhan kultur sel 3D HepG2 dan mengevaluasi sistem penghantaran obat. Dalam penelitian oleh Taroncher et al, perangkat mikrofluida dibuat menggunakan wafer silikon sebagai cetakan utama. Pendekatan ini memerlukan peralatan khusus dan kondisi terkendali, termasuk fasilitas ruang bersih, pelapisan putar, dan langkah pemanggangan (Taroncher et al. 2024 ). Dalam studi yang baru-baru ini dilaporkan oleh Hoyos-Vega et al. ( 2024 ), perangkat mikrofluida dengan unit bioanalisis berbasis tetesan terintegrasi dikembangkan untuk menganalisis volume pikoliter media yang dikondisikan sel yang memungkinkan deteksi glukosa dan albumin noninvasif dalam kultur 3D hati. Perangkat ini menampilkan 140 sumur mikro untuk pembentukan sferoid, bersama dengan generator tetesan dan katup mikromekanis untuk mendeteksi glukosa dan albumin melalui enzimatik dan immunoassays.
Tujuan dari penelitian ini adalah untuk merancang dan mengembangkan perangkat mikrofluidik yang hemat biaya, dapat direproduksi, dan biokompatibel untuk kultur sel 3D, yang dapat digunakan untuk mempelajari efek agen antikanker (seperti Aloe vera ) pada spheroid tumor. Untuk mencapai hal ini, kami memperkenalkan pendekatan baru untuk menghasilkan spheroid HepG2 menggunakan perangkat mikrofluidik untuk mengevaluasi, untuk pertama kalinya, kemanjuran antikanker Aloe vera dibandingkan dengan agen kemoterapi yang terkenal, Doxorubicin. Polydimethylsiloxane (PDMS) dipilih sebagai bahan untuk perangkat tersebut karena sifat-sifatnya yang menguntungkan, termasuk biokompatibilitas, transparansi optik, dan permeabilitas gas, yang semuanya membuatnya sangat cocok untuk aplikasi kultur sel (Khot et al. 2020 ). Lebih jauh lagi, sifat hidrofobik dan karakteristik permukaan PDMS yang melekat memfasilitasi pembentukan struktur sel 3D tanpa memerlukan perancah. Upaya signifikan juga telah dilakukan untuk merancang model hati lab-on-a-chip menggunakan perangkat mikrofluida berbasis PDMS, yang memungkinkan analisis toksisitas yang lebih efektif (Polidoro et al. 2021 ). Cetakan perangkat mikrofluida dibuat melalui pemesinan mekanis, yang merupakan alternatif praktis dan ekonomis untuk teknik berbasis litografi yang sering kali memerlukan peralatan ruang bersih, mahal dan memakan waktu (Çetin et al. 2014 ; Zeinali et al. 2015 ). Selain itu, setelah cetakan dibuat dari logam atau polimer, cetakan dapat digunakan berulang kali dalam pembuatan. Serangkaian eksperimen yang komprehensif—termasuk analisis simulasi COMSOL dan uji viabilitas dan sitotoksisitas beberapa sel seperti pencitraan hidup-mati, pengukuran konsumsi glukosa, aktivitas laktat dehidrogenase (LDH), dan analisis sekresi albumin—menunjukkan kelayakan dan keuntungan yang jelas dari pendekatan ini untuk pembentukan sferoid 3D dalam sistem aliran mikrofluida. Selain itu, kinerja kultur sel 3D kami juga dibandingkan dengan kinerja metode kultur sel 2D.
2 Bahan dan Metode
2.1 Desain dan Simulasi
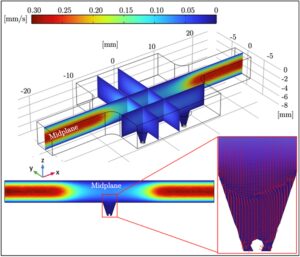
Perangkat mikrofluida tunggal yang berisi saluran aliran lurus yang menghubungkan saluran masuk dan saluran keluar dan dikembangkan dalam studi ini. SolidWorks (Dassault Systèmes, Vélizy-Villacoublay, Prancis) digunakan untuk membuat model CAD dari perangkat mikrofluida. Sumur kultur sel 3D ditempatkan di bagian tengah perangkat (lihat Gambar 1 ). Lebar saluran aliran lurus yang masuk dan keluar dari unit reservoir yang terletak di bagian tengah dipilih sebesar 5 mm. Persamaan Navier-Stokes digunakan untuk menilai medan aliran dalam perangkat mikrofluida melalui model COMSOL Multiphysics (versi 5.2). Kondisi batas tanpa selip ditetapkan pada dinding saluran, laju aliran volumetrik ditetapkan pada saluran masuk, dan kondisi batas tekanan nol ditetapkan pada saluran keluar mikrokanal. Dengan menggunakan pengaturan mesh yang berbeda, independensi mesh dari simulasi dipastikan. Setelah beberapa simulasi, tinggi kerucut terpotong ditentukan sebesar 5 mm, sedangkan jari-jari alas melingkar atas dan bawah masing-masing sebesar 0,5 mm dan 2 mm (yang sesuai dengan volume kerucut akhir sebesar 27,49 µL). Medan aliran di dalam desain akhir perangkat mikrofluida diilustrasikan pada Gambar 2 .

2.2 Pembuatan Perangkat Mikrofluida
Pembuatan perangkat mikrofluida dilakukan dengan mengikuti pemodelan PDMS (Zeinali et al. 2015 ). Cetakan induk PTFE yang dapat digunakan kembali (50 mm × 70 mm) yang berisi lima kerucut terpotong yang terbentuk dengan baik dirancang dan diproduksi dengan pemesinan mekanis (Universal Milling Machine-TOS, Republik Ceko). Kit elastomer Sylgard 184 yang tersedia secara komersial (Dow Corning, AS) digunakan sesuai dengan petunjuk pabrik dengan mencampur 10 bagian bahan dasar dengan 1 bagian bahan pengawet (b/b). Semua sampel dicampur secara menyeluruh dengan manik magnetik di bawah pengaduk magnetik (ISOLAB GmbH, Jerman) pada kecepatan 200 rpm selama 1 menit pada suhu ruangan. Selanjutnya, campuran yang belum diawetkan dituangkan ke dalam cetakan Teflon dan cawan petri plastik (120 × 17 mm, ISOLAB GmbH, Jerman) secara terpisah dan dikeluarkan gasnya dengan desikator untuk menghilangkan gelembung udara selama 45 menit pada suhu ruangan. Terakhir, sampel diawetkan pada suhu 80°C selama 80 menit dalam oven vakum (Nuve EV018, Turki). Pada akhir waktu pengawetan, sampel yang diawetkan dikupas dengan menggunakan spatula saat didinginkan pada suhu ruangan. Selanjutnya, membran PDMS dikenakan pembersihan dengan gas nitrogen bertekanan dalam lemari asam, diikuti dengan paparan perlakuan plasma oksigen (Atto, Diener, Jerman) selama 90 detik dalam kondisi kerja 100 W, aliran oksigen 50 mL/menit, dan 0,3 mBar untuk meningkatkan energi permukaannya dengan tujuan untuk meningkatkan ikatan ireversibel antara kedua membran. Terakhir, membran PDMS disegel dengan permukaan yang telah diolah saling berhadapan dan kontak konformal diperbaiki dengan cara menekannya perlahan di antara ibu jari dan jari telunjuk selama 10–15 detik pada suhu ruangan. Sebelum proses penyegelan, bagian saluran masuk dan keluar dibuka pada membran PDMS bagian atas dengan bantuan pelubang PDMS 1,25 mm (Elveflow, Prancis). Kemudian, pipa PTFE (OD 1/16” × ID 1/32”) (Elveflow, Prancis) dimasukkan ke dalam saluran masuk dan keluar. Gambar 2 menunjukkan cetakan induk yang dikembangkan, chip PDMS, dan chip yang disegel dengan pipa.
2.3 Pemeliharaan Sel
Garis sel karsinoma hepatoseluler manusia (HepG2) (HB8065, ATCC, Inggris) digunakan dalam penelitian ini. Sel-sel tersebut dikulturkan dalam cawan kultur sel standar dalam kondisi terkendali 37°C dan 5% CO 2 . Media kultur yang digunakan adalah medium Eagle yang dimodifikasi Dulbecco (DMEM) Glukosa Tinggi (D6429, Sigma Aldrich, Jerman) yang dilengkapi dengan 10% serum janin sapi (FBS) (FBS-12A, Capricorn, Jerman), larutan antibiotik-antimikotik 1% (A5955, Sigma Aldrich, Jerman). Setelah sel-sel mencapai konfluensi, mereka dibilas dengan garam penyangga fosfat Dulbecco (DPBS) (Biological Industries, AS) dan kemudian disalurkan. Perpindahan sel dilakukan dengan menggunakan larutan tripsin (Trypsin EDTA Solution A (0,25%), EDTA (0,02%) (Biological Industries, AS), yang kemudian dinetralkan dengan media kultur yang telah disiapkan yang disebutkan di atas. Selanjutnya, larutan suspensi sel mengalami sentrifugasi pada 2500 rpm selama 2,5 menit, setelah itu sel-sel disuspensikan kembali dalam media kultur. Konsentrasi suspensi sel ditentukan dengan menggunakan penghitung sel otomatis (EVE Cell Counter, NanoEntek, Korea).
2.4 Pembentukan dan Kultur Sferoid 3D
Pembentukan tumor sferoid dalam perangkat mikrofluida ditunjukkan oleh sel HepG2. Sebelum melakukan percobaan, perangkat mikrofluida dan membran PDMS menjalani serangkaian prosedur pembersihan dan sterilisasi. Pertama, perangkat dicuci dengan air deionisasi, etanol 70%, dan garam penyangga fosfat (PBS) masing-masing selama 5 menit dan dikeringkan menggunakan filter kertas autoklaf. Selanjutnya, kedua sisi perangkat mengalami perawatan UV selama 30 menit untuk memastikan sterilisasi. Sampel steril ditempatkan dengan hati-hati dalam perangkat plasma oksigen untuk modifikasi permukaan tanpa mengorbankan sterilisasinya dalam cawan petri, dan pada akhir proses, sampel dibawa kembali ke lemari laminar untuk budidaya sel dengan cara yang steril. Setelah prosedur sterilisasi, larutan polivinil alkohol (PVA) 0,5% (b/v) (Sigma Aldrich, AS) dalam air deionisasi digunakan untuk melapisi seluruh permukaan bagian dalam chip PDMS. Lapisan ini dibiarkan tidak terganggu selama 30 menit untuk mencegah sel menempel pada permukaan chip. Pada akhir masa inkubasi, larutan dikikis sepenuhnya dari permukaan chip, dan 10 3 sel HepG2 disemai ke dalam setiap sumur kerucut chip dalam 30 µL media kultur. Permukaan yang dirawat kemudian segera ditutup tanpa penundaan, dan chip yang disemai sel diinkubasi selama 6 jam tanpa gangguan apa pun untuk memungkinkan komunikasi dan pengaturan sel awal. Pada akhir masa inkubasi, tabung dimasukkan ke dalam chip dalam kondisi steril, dan media kultur dimasukkan ke dalam perangkat mikrofluida pada 200 µL/jam menggunakan pompa jarum suntik (Harvard Apparatus, PHD Ultra, AS). Secara paralel, pembentukan sferoid dalam perangkat mikrofluida dibandingkan dengan metode konvensional yang terkenal, tetes gantung. Tetesan dengan jumlah sel dan volume yang sama ditempatkan dengan hati-hati pada tutup cawan petri plastik 60 mm (ThermoFisher Scientific, AS). Untuk mencegah tetesan mengering, 6 mL d -PBS (ThermoFisher Scientific, AS) ditambahkan ke dasar cawan petri. Selanjutnya, suspensi sel yang disiapkan menggunakan teknik tetes gantung dan yang terbentuk di dalam chip ditempatkan dalam inkubator CO 2 (Memmert ICO105, AS) yang diatur pada 37 °C dan dikultur selama 7 hari. Jumlah sel yang dipilih, durasi inkubasi sebelum aliran dan laju aliran dalam chip mikrofluida diadopsi berdasarkan studi mikrofluida sebelumnya yang melaporkan pembentukan sferoid optimal dan viabilitas sel yang stabil menggunakan pengaturan yang sebanding (Miyamoto et al. 2015 ; Zuchowska et al. 2017 ).
2.5 Studi Biologi
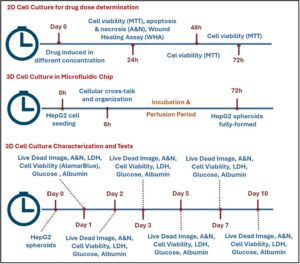
Bahasa Indonesia: Untuk memberikan gambaran menyeluruh tentang desain eksperimen dan perkembangan uji biologis yang dilakukan sepanjang studi, representasi skematis telah dikembangkan. Gambar ini menguraikan garis waktu dan pengaturan eksperimen untuk studi kultur sel 2D dan 3D, termasuk penentuan dosis obat, analisis sitotoksisitas, dan uji karakterisasi yang dilakukan pada spheroid HepG2. Uji ini mencakup pengukuran utama seperti viabilitas sel, apoptosis/nekrosis, aktivitas LDH, konsumsi glukosa, dan sekresi albumin di beberapa titik waktu. Skematis, yang disajikan dalam Gambar 3 , menawarkan ringkasan visual yang mudah diakses dari metodologi yang digunakan untuk mengevaluasi efek Doxorubicin dan Aloe vera pada sel HepG2 di lingkungan kultur 2D dan 3D.
2.5.1 Analisis Sitotoksisitas
Larutan Doksorubisin (Doksorubisin Hidroklorida, Sandoz, Turki) dan Aloe vera (Terra-Pure™ Beku Kering Aloe vera Juice Powder 200X, TN003, Melbourne, ABD) disiapkan dalam PBS steril. Untuk mengetahui nilai IC50 larutan Doksorubisin dan Aloe vera pada sel HepG2, volume 100 μL yang mengandung sel HepG2 pada kepadatan 1 × 103 dimasukkan ke dalam setiap sumur pelat 96 sumur untuk analisis sitotoksisitas 2D. Selanjutnya, pelat diinkubasi pada suhu 37°C selama 24 jam dalam 5% CO 2 % dan kelembaban 95% dalam inkubator (Memmert ICO105, AS). Sel-sel tersebut diberi berbagai konsentrasi Doxorubicin (0, 0,75, 1,5, 3,125, 6,25, 12,5, dan 25 μg/mL) dan Aloe vera (0, 3,125, 6,25, 12,5, 25, 50, dan 100 mg/mL). Obat tersebut diencerkan menggunakan media kultur, dan setiap perlakuan diulang dalam lima sumur mikro, dengan volume 200 μL per sumur. Sampel kemudian diinkubasi selama 24, 48, dan 72 jam. Viabilitas sel dinilai dengan menggunakan reagen 3-(4,5-dimetil-2-tiazolil)-2,5-difenil-2H-tetrazolium bromida (MTT) (ThermoFisher Scientific, Amerika Serikat). Singkatnya, 10 μL MTT dimasukkan ke dalam sel, diikuti dengan periode inkubasi tambahan selama 4 jam. Cairan tersebut dibuang, dengan menambahkan 150 μL dimetil sulfoksida (DMSO) ke setiap sumur. Absorbansi sumur diukur menggunakan pembaca mikroplat (Multiskan Sky-High Microplate Spectrophotometer, ThermoFisher Scientific, AS) pada panjang gelombang 570 nm, dan tingkat kelangsungan hidup sel ditentukan dengan membandingkannya dengan kontrol negatif. Penilaian toksisitas juga dilakukan menggunakan model 3D, mirip dengan investigasi 2D. Larutan yang terdiri dari reagen MTT 10% dimasukkan ke dalam chip, setelah itu aliran dihentikan untuk memungkinkan interaksi dengan spheroid selama 4 jam. Kemudian, media kultur dikeluarkan dengan bantuan sistem pemompaan, DMSO ditambahkan ke spheroid di dalam chip, dan 200 µL sampel yang diambil dari bagian outlet dibaca dalam kondisi yang sama.
2.5.2 Penentuan Apoptosis dan Nekrosis
Pewarnaan akridin oranye (AO)/propidium iodida (PI) digunakan untuk memeriksa efek apoptotik dan nekrotik dari molekul yang diobati pada sel HepG2 dalam kultur 2D. Pengujian dilakukan pada hari ketiga kultur untuk studi kultur 2D dan pada hari ke-1, ke-3, ke-5, ke-7, dan ke-10 kultur untuk studi kultur 3D. Secara singkat, 104 sel ditanam di setiap sumur pelat 48 sumur dalam media pertumbuhan untuk uji kultur 2D. Setelah 24 jam, media pertumbuhan diganti dengan media baru yang mengandung konsentrasi senyawa uji yang sama seperti dalam analisis sitotoksisitas. Media kultur dibuang pada akhir durasi inkubasi, dan sel dicuci sekali dengan PBS (Sigma Aldrich, Jerman). Sel-sel tersebut kemudian diwarnai dengan 200 L larutan pewarna yang mengandung 25 µg/mL AO dan 25 µg/mL PI selama 30 detik sebelum dilihat menggunakan mikroskop fluoresensi dengan filter FITC dan Texas Red (Leica DM IL Led, Belanda). Pada hari-hari analisis yang disebutkan di atas untuk studi kultur 3D, chip uji ditempatkan langsung di bawah mikroskop fluoresensi, dan gambar sferoid diperoleh segera setelah media kultur ditarik dan larutan pewarna dimasukkan. Dalam analisis kultur 3D, evaluasi apoptosis dan nekrosis dievaluasi dengan warna pewarnaan dan intensitas sel, sedangkan dalam analisis kultur 2D, jumlah sel apoptotik dan nekrotik dihitung dan dihitung dengan persamaan berikut:
![]()
2.5.3 Uji Penyembuhan Luka
Tujuan dari uji penyembuhan luka adalah untuk mengevaluasi efek dari berbagai dosis Doxorubicin dan Aloe vera terhadap penghambatan motilitas sel. Untuk mencapai tujuan yang diinginkan, 2,5 × 104 sel HepG2 dimasukkan ke dalam pelat 24-sumur. Setelah masa inkubasi 24 jam, lapisan sel yang terbentuk digores secara terkendali menggunakan ujung pipet. Selanjutnya, sisa-sisa sel dihilangkan menggunakan serangkaian tiga pencucian menggunakan PBS. Selanjutnya, dosis identik yang diperiksa dalam uji sitotoksisitas dimasukkan ke dalam sumur dan diinkubasi bersama selama durasi tambahan 24 jam. Selanjutnya, goresan ditangkap menggunakan mikroskop terbalik, dan tingkat penutupan di seluruh lebar dinilai untuk menentukan laju migrasi sel.
2.5.4 Analisis Viabilitas Sel pada Spheroid HepG2
Kelangsungan hidup sel ditentukan menggunakan Reagen Kelangsungan Hidup Sel AlamarBlue (Invitrogen, ThermoFisher Scientific, AS) mengikuti petunjuk pabrik pembuatnya. Singkatnya, media kultur yang mengandung larutan AlamarBlue 10% dimasukkan ke dalam chip berbasis PDMS dan diinkubasi dengan spheroid selama 2 jam dengan menghentikan aliran. Supernatan kemudian dikumpulkan dari outlet dengan melanjutkan aliran, dan 200 µL sampel diambil ( n = 3, 5 paralel) dan diukur pada 560/590 nm dengan pembaca mikroplat (Multiskan Sky-High Microplate Spectrophotometer, ThermoFisher Scientific, AS). Penghambatan kelangsungan hidup sel sebagai persentase dihitung dengan persamaan berikut:
![]()
2.5.5 Aktivitas Laktat Dehidrogenase (LDH) pada Spheroid HepG2
Supernatan media kultur sel bekas dikumpulkan dari perangkat mikrofluida pada hari pertama, ketiga, kelima, ketujuh, dan kesepuluh kultur hingga akhir periode pengobatan aliran kontinu Doxorubicin dan Aloe vera dan disimpan pada suhu -20°C. Kerusakan sel dievaluasi berdasarkan jumlah LDH yang dilepaskan ke dalam media kultur dengan uji aktivitas laktat dehidrogenase (LDH) kolorimetrik (Elabscience, AS). Secara singkat, 250 µL supernatan yang dikumpulkan diambil pada titik waktu yang disebutkan di atas, ditempatkan dalam pelat 6-sumur, dan diekspos dengan volume yang setara dengan penyangga substrat dalam kit uji. Selanjutnya, larutan Koenzim I dalam kit uji ditambahkan ke semua sumur, dan cawan kultur diinkubasi pada suhu 37°C selama 15 menit. Setelah itu, 250 µL larutan 2,4-dinitrofenilhidrazina ditambahkan ke semua sumur dan diinkubasi selama 15 menit pada suhu 37°C. Kemudian, 2,5 mL larutan NaOH 0,4 mol/L ditambahkan ke semua sumur dan diinkubasi selama 5 menit pada suhu RT. Akhirnya, 200 µL sampel diambil ke dalam cawan kultur 96 sumur sebagai enam sampel paralel dari setiap sampel ( n = 5) dan dibaca pada 440 nm dengan pembaca mikroplat (Multiskan Sky-High Microplate Spectrophotometer, ThermoFisher Scientific, AS).
Konsumsi Glukosa dalam Spheroid HepG2. Uji konsumsi glukosa juga diukur pada supernatan, mirip dengan penentuan dehidrogenase laktat, dan sampel yang disiapkan untuk dehidrogenase laktat juga digunakan untuk tujuan ini. Konsumsi glukosa dalam spheroid ditentukan oleh glukometer konvensional (ACON Biotech, Cina). Secara singkat, 10 μL media kultur diambil dari sampel yang dikumpulkan pada titik waktu yang disebutkan di atas dan langsung dibaca dalam glukometer. Konsumsi glukosa dihitung dengan perbedaan konsentrasi antara media kultur segar dan bekas ( n = 5).
Sekresi Albumin dalam Sferoid HepG2. Konsentrasi albumin dalam supernatan sferoid diukur dengan menggunakan Kit Uji Albumin Kolorimetri yang tersedia secara komersial (Metode Bromocresol Green) (Elabscience, AS) pada hari-hari kultur yang ditentukan. Percobaan dilakukan dengan mengikuti petunjuk pabrik pembuatnya. Sampel 15 µL dari supernatan yang terkumpul diambil, dan albumin yang dilepaskan oleh sferoid diukur ( n = 3, 5 paralel). Untuk menentukan albumin kuantitatif dari nilai absorbansi yang diperoleh, kurva standar dibuat menggunakan larutan albumin yang terdapat dalam kit, dan hasilnya dibuat grafiknya.
2.6 Analisis Statistik
Semua analisis statistik dilakukan untuk mengevaluasi efek dari berbagai kelompok perlakuan dan titik waktu terhadap viabilitas sel, aktivitas LDH, konsumsi glukosa, sekresi albumin. Awalnya, analisis varians pengukuran berulang (ANOVA) (dua arah) dilakukan untuk membandingkan aktivitas biokimia ini di beberapa titik waktu (Hari 1, Hari 3, Hari 5, Hari 7, dan Hari 10) dalam setiap kelompok perlakuan (Doxorubicin 5 µg/mL, Doxorubicin 10 µg/mL, Aloe vera 50 mg/mL, dan Aloe vera 100 mg/mL). Analisis ini dipilih untuk memperhitungkan sifat berkorelasi dari pengukuran berulang yang diambil dari unit eksperimen yang sama dari waktu ke waktu. Hal ini memungkinkan kami untuk menentukan apakah ada perbedaan signifikan dalam setiap aktivitas biokimia dari waktu ke waktu dalam kelompok. Selain itu, ANOVA satu arah diterapkan pada setiap titik waktu individu untuk menentukan perbedaan yang signifikan secara statistik antara kelompok perlakuan per hari. Setelah ANOVA dua arah, uji perbandingan berganda Tukey digunakan sebagai analisis post-hoc untuk mengidentifikasi titik waktu tertentu di mana perbedaan signifikan antara kelompok perlakuan terjadi. Uji Tukey dipilih karena mengendalikan tingkat kesalahan berdasarkan keluarga dan sesuai saat membuat beberapa perbandingan. Semua analisis statistik dilakukan menggunakan perangkat lunak GraphPad Prism 6, dan signifikansi ditetapkan pada p < 0,05. Hasil disajikan sebagai rata-rata ± simpangan baku kecuali dinyatakan lain. Nilai p yang berbeda dan tingkat signifikansinya adalah sebagai berikut: * p < 0,05, ** p < 0,01, *** p < 0,001, **** p < 0,0001. Kumpulan data yang digunakan dan/atau dianalisis selama studi saat ini tersedia dari penulis terkait atas permintaan yang wajar.
3 Hasil dan Pembahasan
Simulasi COMSOL Multiphysics memberikan wawasan berharga ke dalam dinamika fluida dalam perangkat mikrofluida, yang memainkan peran penting dalam mempertahankan kondisi yang tepat untuk kultur sel 3D. Medan aliran, seperti yang ditunjukkan pada Gambar 2 , menunjukkan profil aliran laminar dan seragam di sepanjang saluran lurus, dengan kecepatan puncak di dekat daerah masuk dan keluar. Kecepatan menurun dengan lancar menuju bagian tengah tempat sumur kultur sel 3D berada, meminimalkan tegangan geser pada sel. Lingkungan aliran yang terkendali ini sangat penting untuk memastikan pertumbuhan sel yang stabil dan mencegah efek negatif yang disebabkan oleh gaya geser yang berlebihan. Desain kerucut terpotong di bagian tengah lebih mengoptimalkan aliran, mengurangi kemungkinan zona mati dan memastikan bahwa nutrisi dan oksigen didistribusikan secara merata ke sel. Hasil simulasi mengonfirmasi bahwa parameter desain yang dipilih—seperti lebar saluran 5 mm dan dimensi kerucut terpotong—menciptakan medan aliran yang seimbang, penting untuk hasil eksperimen yang konsisten. Kondisi aliran yang seragam menyediakan fondasi yang stabil untuk percobaan selanjutnya yang mengevaluasi efek sitotoksik Aloe vera dan Doxorubicin pada sel HepG2.
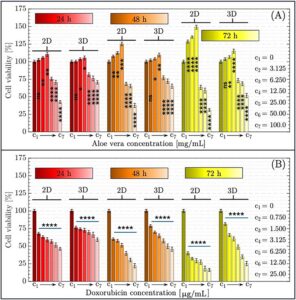
Efek sitotoksik Aloe vera dan Doxorubicin pada sel HepG2 dianalisis secara sistematis untuk menentukan nilai IC50 masing-masing. Dengan menggunakan pendekatan dua tingkat, sel-sel diekspos ke berbagai konsentrasi masing-masing agen dalam model kultur 2D dan 3D, seperti yang dijelaskan dalam Bagian 2. Data yang dihasilkan, digambarkan dalam Gambar 4 , menggambarkan viabilitas sel HepG2 yang bergantung pada dosis selama interval 24, 48, dan 72 jam. Nilai IC50 yang dihitung juga disajikan dalam Tabel 1 , yang memberikan penilaian kuantitatif terperinci dari profil sitotoksik untuk kedua senyawa dalam kondisi eksperimen yang berbeda.
| Lidah buaya (mg/ml) | Doksorubisin (µg/mL) | |||||
|---|---|---|---|---|---|---|
| 24 jam | 48 jam | 72 jam | 24 jam | 48 jam | 72 jam | |
| Bahasa Indonesia: 2D | 41,67 ± 0,15 | 33,33 ± 0,12 | 25,00 ± 0,10 | 8,33 ± 0,05 | 6,25 ± 0,04 | 5,47 ± 0,03 |
| Bahasa Indonesia: 3 dimensi | 58,33 ± 0,20 | 50,00 ± 0,18 | 31,25 ± 0,14 | 12,50 ± 0,07 | 10,42 ± 0,06 | 8,33 ± 0,05 |
Dampak Aloe vera pada viabilitas sel menunjukkan perbedaan signifikan tergantung pada konsentrasi dan waktu inkubasi, seperti yang dinilai dalam model kultur sel 2D dan 3D. Pada 24 jam, C4 ( 12,5 mg/mL) menghasilkan viabilitas sel tertinggi, mencapai sekitar 110% dalam 2D ( p < 0,01) dan sekitar 105% dalam kultur 3D jika dibandingkan dengan kelompok kontrol (C1 ) ( p < 0,05). Pada konsentrasi di atas C4 ( > 12,5 mg/mL), viabilitas menurun secara progresif, turun menjadi sekitar 25% pada C7 ( 100 mg/mL) ( p < 0,0001). Pada 48 jam, konsentrasi C4 yang sama mengakibatkan peningkatan viabilitas lebih lanjut (~125% dalam 2D [ p < 0,001], dan ~115% dalam 3D [ p < 0,01]), sementara dosis yang lebih tinggi kembali menyebabkan penurunan viabilitas ( p < 0,001 hingga p < 0,0001 tergantung pada dosis). Pada 72 jam, pengobatan Aloe vera pada C4 mencapai puncaknya pada sekitar 150% dalam 2D ( p < 0,0001) dan sekitar 125% dalam 3D ( p < 0,001), menandai viabilitas maksimal di semua titik waktu. Namun, pada konsentrasi di atas C4 ( > 12,5 mg/mL), respons apoptosis dan nekrotik menjadi jelas, dengan viabilitas menurun secara signifikan—mencapai hampir 25% pada C7 ( p < 0,0001). Perilaku yang bergantung pada dosis dan waktu ini sejalan dengan prinsip hormesis, fenomena dosis-respons bifasik di mana dosis rendah suatu senyawa dapat merangsang kelangsungan hidup dan proliferasi sel, sedangkan dosis yang lebih tinggi menjadi penghambat atau sitotoksik (Calabrese et al. 2025 ; Fonseca et al. 2025 ; Wang et al. 2024 ). Di sisi lain, temuan ini sejalan dengan laporan sebelumnya yang juga menunjukkan bahwa Aloe vera meningkatkan viabilitas seluler pada konsentrasi rendah tetapi menginduksi efek sitotoksik saat dosis meningkat (Catalano et al. 2024 ).
Efek sitotoksik Doksorubisin pada viabilitas sel HepG2 menunjukkan pola yang jelas bergantung pada dosis dan waktu dalam kultur 2D dan 3D. Dalam 24 jam pertama, pengurangan substansial dalam viabilitas diamati mulai dari C2 ( p < 0,0001), dengan viabilitas turun hingga di bawah 50% pada C3 , dan selanjutnya menurun hingga sekitar 25% pada konsentrasi yang lebih tinggi (C6 – C7 , p < 0,0001). Pada 48 jam, efek sitotoksik meningkat: viabilitas sel turun hingga hampir 25% bahkan pada konsentrasi menengah (C3 – C4 ) , dan mendekati nol pada konsentrasi yang lebih tinggi (C6 – C7 , p < 0,0001) dalam model 2D dan 3D. Pada 72 jam, kematian sel yang diinduksi Doksorubisin menjadi lebih jelas. Dalam kultur 2D, viabilitas hampir tidak terdeteksi dari C5 dan di atasnya ( p < 0,0001), sementara dalam kultur 3D, viabilitas residual minimal (~10%–15%) bertahan pada beberapa konsentrasi (C6 – C7 , p < 0,0001), yang menunjukkan respons sitotoksik yang sedikit melemah tetapi masih sangat efektif dalam model 3D. Temuan ini mengonfirmasi bahwa Doksorubisin memberikan sitotoksisitas yang kuat dan berkelanjutan terlepas dari sistem kultur, meskipun sferoid 3D dapat menunjukkan tingkat resistensi temporal yang sederhana. Secara keseluruhan, data tersebut konsisten dengan profil Doksorubisin yang mapan sebagai agen kemoterapi poten yang mampu menginduksi kematian sel tumor yang cepat dan luas dalam rentang konsentrasi yang luas (Sun et al. 2025 ; Tabbasam et al. 2025 ).
Selain perbandingan dalam kelompok, analisis statistik dilakukan untuk membandingkan efek Aloe vera dan Doxorubicin antara model kultur sel 2D dan 3D pada setiap titik waktu dan konsentrasi. Meskipun perbandingan ini tidak ditampilkan dalam gambar utama untuk menjaga kejelasan visual, temuan signifikan diuraikan di bawah ini. Untuk kelompok yang diobati dengan Aloe vera , pada konsentrasi C4 (12,5 mg/mL), kultur 2D menunjukkan viabilitas sel yang jauh lebih tinggi daripada kultur 3D pada 48 jam ( p < 0,05) dan 72 jam ( p < 0,01). Perbedaan ini konsisten dengan viabilitas puncak yang terlihat pada lapisan tunggal 2D pada dosis ini, mungkin karena peningkatan respons proliferatif dalam pengaturan 2D dengan difusi nutrisi yang tidak terbatas. Namun, tidak ditemukan perbedaan signifikan pada 24 jam (C4–2D vs. C4–3D, p > 0,05), yang menunjukkan bahwa divergensi menjadi lebih jelas seiring berjalannya waktu. Sebaliknya, pengobatan Doxorubicin tidak menghasilkan perbedaan yang signifikan secara statistik antara model 2D dan 3D pada konsentrasi yang lebih rendah (C2–C4) di semua titik waktu ( p > 0,05). Pada konsentrasi yang lebih tinggi (C6–C7), kultur 3D mempertahankan viabilitas yang sedikit lebih tinggi (~10%–15%) daripada 2D, tetapi perbedaannya hanya sedikit signifikan pada 72 jam ( p < 0,05) dan tidak pada titik waktu sebelumnya. Hal ini menunjukkan bahwa meskipun struktur 3D dapat memberikan beberapa derajat penyangga temporal terhadap kemotoksisitas, Doxorubicin secara efektif menekan viabilitas sel di kedua sistem.
Setelah studi sitotoksisitas, efek apoptosis dan nekrotik molekul pada sel HepG2 diperiksa menggunakan pewarnaan ganda AO/PI. Pengujian dilakukan pada hari ketiga kultur untuk studi kultur 2D. Gambar pewarnaan dan persentase sel yang hidup, sel yang mengalami apoptosis dini, sel yang mengalami apoptosis lanjut, dan sel nekrotik yang dihitung berdasarkan hasil pewarnaan disajikan pada Gambar 5 .
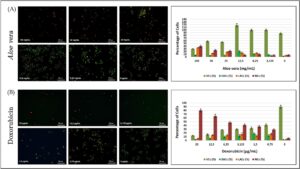
Perlakuan lidah buaya menginduksi respons proliferatif pada sel HepG2 pada konsentrasi yang lebih rendah (≤ 12,5 mg/mL), sebagaimana tercermin dari peningkatan yang nyata pada jumlah sel hidup yang diwarnai hijau. Efek ini paling menonjol pada 12,5 mg/mL, berkorelasi dengan viabilitas tertinggi yang diamati pada grafik batang yang menyertainya. Namun, pada konsentrasi yang melebihi 12,5 mg/mL, peningkatan populasi sel apoptosis yang bergantung pada dosis terdeteksi, dengan apoptosis dini dan akhir menjadi lebih menonjol. Pada dosis tertinggi yang diuji sebesar 100 mg/mL, apoptosis dan nekrosis akhir terjadi pada tingkat yang sebanding, dan viabilitas sel secara keseluruhan turun hingga sekitar 30%. Sebaliknya, Doksorubisin menunjukkan efek antiproliferatif dan sitotoksik yang kuat, yang memicu penurunan cepat pada kepadatan sel hidup mulai dari 0,75 µg/mL. Seiring dengan peningkatan dosis, proporsi sel nekrotik meningkat tajam, menjadi mekanisme kematian sel yang dominan pada 25 µg/mL, di mana viabilitas berkurang hingga sekitar 10%. Temuan ini menunjukkan bahwa sementara Aloe vera memberikan efek proliferatif yang bergantung pada konsentrasi pada dosis yang lebih rendah dan menginduksi apoptosis pada konsentrasi yang lebih tinggi, Doxorubicin lebih dominan menginduksi nekrosis, terutama pada dosis yang lebih tinggi, dan menunjukkan efek sitotoksik yang lebih kuat dibandingkan dengan Aloe vera .
Uji penyembuhan luka dilakukan untuk menilai kapasitas migrasi sel yang diobati dan tidak diobati, dengan penutupan goresan dipantau pada 24 jam dan disajikan dalam Gambar 6 .

Seperti yang ditunjukkan pada Gambar 6 , pengobatan Aloe vera menunjukkan efek yang bergantung pada konsentrasi pada migrasi sel dalam uji penyembuhan luka. Pada dosis yang lebih rendah (3,125–12,5 mg/mL), penutupan daerah goresan yang signifikan dicatat setelah 24 jam, yang menunjukkan peningkatan kemampuan migrasi dan potensi bantuan proliferatif. Meskipun demikian, pada dosis yang lebih tinggi (≥ 25 mg/mL), dampak ini terus berkurang, sehingga menghasilkan pengurangan yang nyata dalam penutupan luka. Data ini menunjukkan bahwa Aloe vera dapat meningkatkan migrasi sel pada dosis rendah, sementara menghambat motilitas pada konsentrasi yang lebih tinggi. Pengobatan doksorubisin menyebabkan penyembuhan luka yang dapat diabaikan, bahkan pada dosis terendah yang diperiksa (0,75 µg/mL), dengan celah goresan sebagian besar tetap terbuka dalam semua kondisi. Tidak adanya pergerakan sel ini menguatkan karakteristik antimigrasi dan sitotoksik Doksorubisin yang kuat, konsisten dengan temuan viabilitas dan apoptosis. Meskipun tidak adanya kuantifikasi statistik, perbedaan kualitatif yang dicatat menggarisbawahi perbedaan perilaku bergantung dosis antara Aloe vera dan Doxorubicin.
Pada tahap akhir penelitian, efek komparatif Aloe vera dan Doxorubicin diperiksa dalam kultur 3D dengan menggunakan chip mikrofluida. Untuk tujuan ini, spheroid berhasil dibuat di dalam chip, dan untuk mengevaluasi efisiensi pembentukan spheroid, spheroid tersebut dibandingkan dengan spheroid yang diproduksi menggunakan teknik tetes gantung konvensional dengan kepadatan sel yang sama. Gambar mikroskop cahaya diambil dalam kondisi yang identik selama periode kultur 7 hari untuk memungkinkan perbandingan langsung morfologi spheroid dan integritas struktural antara kedua metode, dan gambar yang sesuai disajikan dalam Gambar 7 .
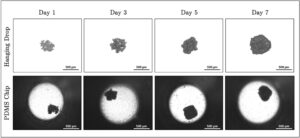
Perbandingan antara bola-bola yang dibentuk oleh teknik tetes gantung konvensional dan bola-bola yang dibentuk dalam chip mikrofluida PDMS mengungkapkan pengamatan penting mengenai pembentukan bola dari waktu ke waktu. Dalam teknik tetes gantung konvensional, spheroid secara bertahap menjadi lebih padat saat kultur berlangsung. Bola-bola ini mempertahankan struktur 3D yang seragam dan padat, yang mengonfirmasi keandalan metode ini untuk membentuk spheroid dalam lingkungan statis. Demikian pula, spheroid yang dibentuk dalam chip mikrofluida PDMS juga menunjukkan struktur yang terorganisasi dengan baik dan padat, yang menyoroti kemampuan chip untuk mendukung arsitektur seperti jaringan 3D. Sementara spheroid tampak lebih kecil pada titik waktu selanjutnya dalam kelompok chip, hal ini dikaitkan bukan dengan degradasi struktural tetapi dengan peningkatan pemadatan dan organisasi seluler yang difasilitasi oleh penghilangan sel-sel yang melekat longgar atau apoptotik melalui aliran. Interpretasi ini didukung oleh analisis simulasi aliran COMSOL kami, yang mengonfirmasi bahwa tegangan geser dalam chip tetap di bawah ambang batas yang diketahui menyebabkan gangguan fisik pada spheroid. Penelitian sebelumnya juga telah menunjukkan bahwa perfusi terkontrol dalam sistem mikrofluida dapat meningkatkan kualitas sferoid dengan mendorong pembersihan serpihan seluler dan meningkatkan kohesivitas mekanis (Huang et al. 2020 ; Nashimoto et al. 2017 ; Ong et al. 2017 ). Selain itu, keberadaan sel mati dan serpihan di sekitar bola dalam sumur merupakan pengamatan penting, yang menunjukkan pergantian sel alami dan interaksi dinamis dengan lingkungan mikro di sekitarnya. Oleh karena itu, chip PDMS tidak hanya memfasilitasi pembentukan sferoid, tetapi juga berkontribusi untuk menjaga stabilitas sferoid dengan memungkinkan pembersihan material seluler yang tidak diinginkan dengan bantuan aliran dan geser rendah.
Bahasa Indonesia: Untuk lebih memahami efek sitotoksik Aloe vera dan Doxorubicin dalam lingkungan 3D yang lebih relevan secara fisiologis, uji apoptosis dan nekrosis dilakukan pada spheroid yang dihasilkan dalam chip mikrofluida, dan hasil pewarnaan disajikan dalam Gambar 8. Uji ini bertujuan untuk mengevaluasi tingkat kematian sel, apoptosis, dan nekrosis yang disebabkan oleh berbagai konsentrasi agen ini, memberikan wawasan tentang efektivitasnya dalam sistem kultur 3D yang sangat meniru perilaku tumor in vivo. Dasar pemikiran untuk memilih dosis Aloe vera (100 mg/mL dan 50 mg/mL) dan Doxorubicin (10 µg/mL dan 5 µg/mL) didasarkan pada nilai IC50 yang sebelumnya diperoleh dalam penelitian kami dalam kondisi kultur 3D. Untuk Aloe vera , nilai IC50 pada 72 jam dalam kultur 3D ditetapkan sebesar 31,25 mg/mL. Berdasarkan hal ini, kedua dosis yang dipilih (50 mg/mL dan 100 mg/mL) berada di atas ambang batas IC50. Namun, dosis ini sengaja dipilih untuk mencerminkan transisi dari aktivitas apoptosis sedang ke respons nekrotik yang lebih jelas, seperti yang diamati dalam data viabilitas dan mikroskopi fluoresensi kami. Mengingat sifat Aloe vera yang kompleks dan berasal dari tumbuhan serta perilaku dosis-respons bifasiknya (hormesis), konsentrasi supra-IC50 ditemukan lebih tepat untuk mengevaluasi mekanisme kematian sel yang bergantung pada dosis untuk memvisualisasikan perubahan apoptosis-nekrotik pada spheroid. Dengan demikian, dosis 50 mg/mL menunjukkan tingkat yang cukup tinggi relatif terhadap IC50, yang memungkinkan pengamatan efek apoptosis dini, sementara 100 mg/mL memberikan tanda nekrotik yang jelas. Untuk Doksorubisin, nilai IC50 dalam kultur 3D pada 72 jam ditemukan sebesar 8,33 µg/mL. Dengan demikian, dosis 5 µg/mL dipilih untuk mengevaluasi efek di bawah IC50, di mana tingkat sitotoksisitas yang lebih rendah diharapkan, sementara dosis 10 µg/mL dipilih untuk mengeksplorasi efek di atas IC50, di mana kematian sel yang signifikan melalui apoptosis dan nekrosis diantisipasi. Dosis ini dipilih secara strategis untuk menganalisis secara komprehensif efek kedua agen pada viabilitas sferoid, apoptosis, dan nekrosis dalam sistem kultur 3D, memastikan penilaian menyeluruh terhadap mekanisme sitotoksik, meskipun dosis Aloe vera berada dalam kisaran supra-IC50.
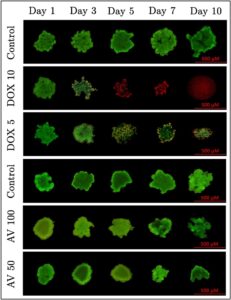
Pada kelompok Aloe vera (100 mg/mL), ukuran spheroid secara bertahap menurun seiring waktu, dan apoptosis dan nekrosis meningkat secara signifikan. Apoptosis, ditunjukkan dengan pewarnaan oranye, sangat dominan pada Hari ke-5 dan ke-7, yang menunjukkan bahwa kematian sel terutama dipicu melalui jalur apoptosis. Namun, karena dosis yang tinggi, nekrosis juga terlihat jelas. Viabilitas sel lebih terjaga pada kelompok Aloe vera 50 mg/mL , dan spheroid sebagian besar mempertahankan ukurannya. Tingkat apoptosis lebih rendah pada kelompok ini, meskipun masih mendekati nilai IC50 72 jam sebesar 31,25 mg/mL, yang mencerminkan efek sitotoksik sedang. Pada kelompok Doxorubicin (10 µg/mL), hampir tidak ada sel yang tersisa di lingkungan sejak Hari ke-5 dan seterusnya. Nekrosis, ditunjukkan dengan pewarnaan merah, sangat dominan, dengan sebagian besar sel menjadi nekrotik. Sebaliknya, kelompok Doxorubicin 5 µg/mL mempertahankan viabilitas sel pada tingkat yang lebih besar, dengan tingkat apoptosis dan nekrosis yang lebih rendah diamati. Mengingat nilai IC50 sebesar 8,33 µg/mL, hasil ini menunjukkan bahwa efek sitotoksik lebih terbatas pada dosis yang lebih rendah. Secara keseluruhan, hasil yang diperoleh menunjukkan bahwa Aloe vera terutama menginduksi apoptosis, sementara Doxorubicin memicu lebih banyak nekrosis. Penyusutan spheroid dan munculnya nekrosis dalam kelompok Aloe vera 100 mg/mL mencerminkan efek konsentrasi tinggi, sementara kematian sel yang cepat dan luas yang diamati sejak Hari ke-5 dan seterusnya dalam kelompok Doxorubicin 10 µg/mL menyoroti dampak sitotoksik yang kuat dan cepat dari dosis ini. Temuan ini selaras dengan nilai IC50 yang diperoleh dalam kultur 3D, yang mengonfirmasi efek ketergantungan dosis dari kedua agen.
Efek penghambatan Aloe vera dan Doxorubicin pada proliferasi sel dalam spheroid dinilai selama periode kultur menggunakan analisis Alamar Blue, dengan hasil yang disajikan pada Gambar 9A . ANOVA ukuran berulang (dua arah) mengungkapkan bahwa waktu dan pengobatan secara signifikan mempengaruhi penghambatan viabilitas sel ( p < 0,0001), dengan interaksi yang penting antara kedua variabel ( p = 0,0021). Perbandingan post hoc Tukey menunjukkan perbedaan yang signifikan antara titik waktu awal (Hari 1) dan tahap selanjutnya (Hari 5, Hari 7, dan Hari 10) di antara semua kelompok perlakuan. Sel yang diobati dengan Doxorubicin (Dox 10 dan Dox 5) menunjukkan peningkatan yang cepat dan dramatis dalam penghambatan, dengan perbedaan signifikan yang diamati dari Hari 1 hingga Hari 5 dan Hari 10 ( p < 0,0001). Perawatan Aloe vera menunjukkan efek penghambatan yang bertahap tetapi berkelanjutan, dengan perbedaan signifikan yang terlihat dari Hari ke-1 hingga Hari ke-7 dan Hari ke-10 ( p < 0,0001). Kelompok kontrol menunjukkan peningkatan penghambatan secara bertahap dari waktu ke waktu, meskipun pada tingkat yang lebih rendah. Secara signifikan, untuk Doxorubicin, penghambatan mencapai keseimbangan setelah Hari ke-7, karena tidak ada variasi substansial yang terdeteksi antara Hari ke-7 dan Hari ke-10 ( p > 0,05). Data menunjukkan bahwa Doxorubicin menimbulkan reaksi sitotoksik yang kuat dan langsung, sedangkan Aloe vera menunjukkan efek yang lebih tertunda, dengan potensi yang meningkat seiring waktu. Temuan ini menyoroti efektivitas perawatan yang berfluktuasi dari waktu ke waktu, dengan implikasi untuk meningkatkan pendekatan terapeutik. Pada akhir periode kultur 10 hari, kelompok kontrol menunjukkan penghambatan viabilitas sekitar 20%, yang disebabkan oleh kematian sel yang disebabkan oleh tantangan bawaan dan kendala difusi dalam perpindahan massa dari zona proliferasi pada dinding luar spheroid ke zona nekrotik paling dalam selama pertumbuhan spheroid (Bull et al. 2020 ; Khan et al. 2022 ).

Gambar 9B menggambarkan hasil pengukuran LDH dalam supernatan yang dikumpulkan dari spheroid yang terpapar pada berbagai perawatan obat. LDH adalah enzim sitoplasma stabil yang ada di semua sel dan dilepaskan dengan cepat ke dalam media kultur ketika membran plasma terganggu, menjadikannya penanda sitotoksisitas dan kerusakan sel yang andal, termasuk apoptosis dan nekrosis (Castiglione et al. 2024 ). Berdasarkan temuan statistik ANOVA (dua arah) ukuran berulang, baik kelompok waktu maupun perawatan memiliki efek signifikan pada aktivitas LDH ( p < 0,0001), dengan interaksi signifikan antara kedua faktor ini, yang menunjukkan bahwa efek perawatan pada pelepasan LDH bervariasi dari waktu ke waktu. Perbandingan post hoc Tukey mengungkapkan bahwa pelepasan LDH meningkat secara signifikan antara titik waktu awal (Hari 1) dan tahap selanjutnya (Hari 5, Hari 7, dan Hari 10) ( p < 0,001), yang menunjukkan kerusakan sel kumulatif selama percobaan. Namun, tidak ada perbedaan signifikan yang diamati antara Hari ke-7 dan Hari ke-10 ( p > 0,05), yang menunjukkan bahwa pelepasan LDH stabil pada tahap selanjutnya. Dalam hal efek pengobatan, Doksorubisin menyebabkan peningkatan aktivitas LDH yang lebih langsung dan substansial, yang mencerminkan tingkat nekrosis yang lebih tinggi dan kematian sel yang cepat. Sebaliknya, pengobatan Aloe vera menghasilkan peningkatan pelepasan LDH yang lebih bertahap, konsisten dengan induksi apoptosis daripada nekrosis. Temuan mikroskop fluoresensi juga menguatkan pengamatan ini, yang menunjukkan tingkat nekrosis yang lebih rendah pada sferoid yang diobati dengan Aloe vera , tempat apoptosis atau apoptosis awal mendominasi. Kadar LDH yang lebih rendah pada kelompok yang diobati dengan Aloe vera menunjukkan bahwa sel-sel tersebut menjalani jalur apoptosis primer, yang tidak melibatkan kerusakan membran sel pada tingkat yang sama seperti nekrosis. Hasilnya, lebih sedikit LDH yang dilepaskan ke lingkungan dibandingkan dengan kelompok yang diobati dengan Doxorubicin, di mana kematian sel nekrotik menyebabkan pelepasan LDH yang lebih jelas ke dalam media kultur. Secara keseluruhan, temuan ini menyoroti berbagai cara kematian sel yang disebabkan oleh Doxorubicin dan Aloe vera , dengan Doxorubicin menyebabkan nekrosis cepat dan Aloe vera menyebabkan proses apoptosis yang lebih lambat.
Gambar 9C menggambarkan hasil pengukuran glukosa yang dilakukan pada supernatan yang sama yang diperoleh dari spheroid yang dikenai berbagai obat pada konsentrasi yang berbeda untuk analisis LDH. Analisis statistik ANOVA (dua arah) pengukuran berulang mengungkapkan bahwa kelompok waktu dan perlakuan memiliki dampak substansial pada kadar glukosa residual dalam media kultur ( p < 0,0001). Perbandingan post-hoc Tukey menunjukkan bahwa dalam kelompok kontrol, kadar glukosa residual menurun drastis dari Hari 1 hingga titik waktu berikutnya (Hari 3, Hari 5, dan Hari 7, semua p < 0,05), yang menunjukkan penggunaan glukosa aktif oleh sel hidup. Konsentrasi glukosa yang sangat rendah yang diamati dalam media kultur yang terus diisi ulang menunjukkan bahwa spheroid yang tidak diobati mempertahankan viabilitasnya dan secara konsisten memetabolisme glukosa selama periode kultur. Tidak ada variasi signifikan yang dicatat antara Hari 1 dan Hari 10 ( p = 0,6078), yang menunjukkan stabilisasi kadar glukosa, mungkin disebabkan oleh kematian sel yang diamati pada fase kultur selanjutnya. Pada kelompok yang diobati dengan Doxorubicin, khususnya Dox 10 dan Dox 5, kadar glukosa residual meningkat secara dramatis seiring berjalannya waktu, dengan perbedaan yang cukup besar diamati antara Hari 1 dan semua titik waktu berikutnya ( p < 0,05), yang menunjukkan penurunan penggunaan glukosa yang disebabkan oleh apoptosis sel. Perawatan Aloe vera (baik AV 100 dan AV 50) menunjukkan peningkatan progresif pada kadar glukosa residual, dengan perbedaan signifikan yang dicatat antara Hari 1 dan Hari 7 dan 10 pada kelompok AV 100 ( p < 0,05), yang menunjukkan penekanan penggunaan glukosa yang tertunda meskipun konsisten. Data ini menunjukkan bahwa Doxorubicin dengan cepat mengurangi asupan glukosa dengan mendorong kematian sel, sedangkan Aloe vera memiliki dampak penghambatan yang lebih bertahap pada aktivitas metabolisme dari waktu ke waktu.
Gambar 9D mengilustrasikan hasil kuantifikasi albumin yang dilakukan pada supernatan yang diperoleh dari spheroid yang dikenai berbagai dosis obat selama periode kultur. Albumin adalah protein esensial yang mempertahankan tekanan dari sel onkotik dan memfasilitasi transportasi molekuler dalam darah; pelepasannya sering digunakan sebagai indikator fungsi hati dan viabilitas seluler dalam model kultur tiga dimensi. Analisis statistik ANOVA (dua arah) pengukuran berulang mengungkapkan bahwa kelompok waktu dan kelompok perlakuan memiliki dampak substansial pada sekresi albumin ( p < 0,0001). Perbandingan post hoc Tukey menunjukkan bahwa pada kelompok kontrol, penurunan signifikan dalam sekresi albumin terjadi antara Hari 1 dan periode waktu berikutnya, terutama antara Hari 1 dan Hari 5 ( p < 0,0001). Penurunan ini menunjukkan bahwa seiring dengan kemajuan kultur, aktivitas metabolik secara inheren menurun. Pada kelompok yang diobati dengan Doxorubicin (Dox 10 dan Dox 5), sekresi albumin menurun secara signifikan dari waktu ke waktu, dengan perubahan yang nyata diamati antara Hari ke-1 dan titik waktu berikutnya ( p < 0,05). Penurunan ini kemungkinan disebabkan oleh efek sitotoksik Doxorubicin, yang mengakibatkan kematian sel dan penurunan aktivitas metabolik yang signifikan. Sebaliknya, kelompok yang diobati dengan Aloe vera mengalami penurunan sekresi albumin yang lebih bertahap, dengan penurunan yang nyata terjadi sebagian besar antara Hari ke-1 dan Hari ke-7, serta Hari ke-10 ( p < 0,05), yang menunjukkan penekanan aktivitas seluler yang lebih lambat. Penurunan sekresi albumin pada spheroid 3D yang terkena obat antikanker menyoroti penurunan viabilitas dan fungsi sel, karena spheroid ini mengalami stres dan apoptosis yang cukup besar saat terpapar agen tersebut. Data ini menunjukkan bahwa Doxorubicin memiliki efek yang cepat dan kuat pada aktivitas seluler, sedangkan Aloe vera menunjukkan dampak yang lebih bertahap dan terkendali pada pembentukan albumin dan metabolisme seluler dari waktu ke waktu.
Hasil uji penghambatan viabilitas sel, aktivitas LDH, konsumsi glukosa, dan sekresi albumin secara kolektif menunjukkan efek sitotoksik yang bervariasi dari Doxorubicin dan Aloe vera pada spheroid 3D dari waktu ke waktu. Doxorubicin, terutama pada dosis yang lebih tinggi, memiliki efek yang cepat dan signifikan di semua uji, ditandai dengan penekanan viabilitas sel yang cepat dan substansial, peningkatan pelepasan LDH, dan penurunan konsumsi glukosa dan sekresi albumin. Temuan tersebut menunjukkan kematian sel yang disebabkan oleh nekrosis, seperti yang terlihat dari peningkatan kadar LDH dan penurunan yang signifikan dalam konsumsi glukosa dan sekresi albumin, yang menunjukkan penghentian metabolisme dan integritas seluler yang terganggu. Perawatan Aloe vera menunjukkan dampak yang lebih progresif pada metabolisme spheroid, menunjukkan penekanan yang tertunda meskipun konsisten terhadap kelangsungan hidup sel dan fungsi metabolisme. Dibandingkan dengan Doxorubicin, pelepasan LDH meningkat lebih lambat, yang menunjukkan apoptosis daripada nekrosis, yang didukung oleh data mikroskop fluoresensi. Penurunan progresif dalam penggunaan glukosa dan pelepasan albumin menegaskan gagasan bahwa Aloe vera mendorong proses kematian sel yang lebih bertahap dan dimediasi apoptosis, mempertahankan fungsi metabolisme untuk jangka waktu lebih lama dibandingkan dengan Doksorubisin.
Pertimbangan penting dalam menginterpretasikan hasil ini adalah efek keterbatasan penetrasi obat dalam kultur spheroid 3D (LaBonia et al. 2016 ). Karena struktur spheroid yang padat, difusi obat mungkin dibatasi, terutama pada lapisan yang lebih dalam (Biju et al. 2023 ). Keterbatasan difusi ini kemungkinan berkontribusi pada efek sitotoksik yang lebih langsung yang diamati dengan Doxorubicin pada lapisan spheroid luar, sedangkan lapisan dalam menunjukkan kematian sel yang tertunda. Ini menjelaskan dataran tinggi dalam pelepasan LDH dan konsumsi glukosa pada fase-fase akhir periode kultur. Dalam nada yang sama, efek bertahap Aloe vera mungkin telah dipengaruhi oleh tantangan penetrasi ini, karena obat tersebut mungkin memerlukan waktu lebih lama untuk mencapai pusat spheroid, sehingga menghasilkan akumulasi penanda apoptosis yang lebih lambat. Hasil ini menggarisbawahi pentingnya mempertimbangkan keterbatasan penetrasi obat saat mengevaluasi kemanjuran agen antikanker dalam model kultur 3D, karena mereka dapat secara substansial memengaruhi waktu dan besarnya efek sitotoksik yang diamati. Doksorubisin, khususnya pada dosis yang lebih tinggi, menunjukkan dampak yang cepat dan signifikan dalam semua pengujian, yang mengakibatkan penghambatan dini dan substansial terhadap viabilitas sel, peningkatan pelepasan LDH, dan penurunan konsumsi glukosa dan sekresi albumin. Hasil ini menunjukkan bahwa kematian sel yang disebabkan oleh nekrosis adalah penyebabnya, sebagaimana dibuktikan oleh penurunan signifikan dalam konsumsi glukosa dan sekresi albumin dan peningkatan kadar LDH. Ini menunjukkan penutupan metabolik dan hilangnya integritas seluler. Sebaliknya, metabolisme sferoid lebih bertahap dipengaruhi oleh perawatan Aloe vera , yang menunjukkan penurunan progresif tetapi konsisten dalam viabilitas sel dan fungsi metabolik. Hasil mikroskopi fluoresensi menguatkan gagasan bahwa apoptosis lebih prevalen daripada nekrosis, karena pelepasan LDH meningkat pada kecepatan yang lebih lambat daripada Doksorubisin. Gagasan bahwa Aloe vera menginduksi mekanisme kematian sel yang lebih lambat, didorong oleh apoptosis, yang mempertahankan fungsi metabolisme untuk durasi yang lebih lama daripada Doxorubicin, lebih lanjut diilustrasikan oleh penurunan progresif dalam konsumsi glukosa dan sekresi albumin.
Efektivitas penetrasi obat dalam spheroid 3D dipengaruhi oleh beberapa faktor, termasuk ukuran molekul, mekanisme penyerapan seluler, dan sifat struktural spheroid itu sendiri (Sokolova et al. 2019 ). Doksorubisin, dengan berat molekul sekitar 543,52 g/mol, mampu menembus sel relatif cepat karena kemampuannya untuk berdifusi secara pasif melalui membran sel dan keterlibatannya dalam mekanisme transpor aktif (Kciuk et al. 2023 ). Hal ini menghasilkan efek sitotoksik yang cepat dan parah, terutama pada lapisan luar spheroid. Sebaliknya, komponen bioaktif Aloe vera yang lebih besar , yang meliputi polisakarida dan senyawa fenolik, diserap oleh sel pada tingkat yang lebih lambat melalui mekanisme seperti endositosis yang dimediasi reseptor. Hal ini menyebabkan respons sitotoksik yang tertunda, yang sesuai dengan efek yang didorong apoptosis yang diamati dalam penelitian ini.
Lebih jauh lagi, ukuran dan kepadatan spheroid 3D, yang merupakan karakteristik struktural yang melekat, selanjutnya memengaruhi penetrasi obat (Singh et al. 2020 ). Konsentrasi obat dapat dikurangi secara substansial di inti nekrotik bagian dalam spheroid yang lebih besar, yang menghadirkan penghalang yang lebih besar terhadap difusi yang efektif. Stabilitas obat juga merupakan faktor penting, karena senyawa yang kurang stabil dapat terdegradasi sebelum mencapai sel terdalam, sehingga mengurangi kemanjurannya (Ashutosh Kumar Yadav et al. 2023 ). Kemanjuran obat dapat lebih terganggu oleh faktor lingkungan mikro, termasuk hipoksia dan pH asam, yang mengganggu metabolisme seluler dan mengurangi stabilitas obat dari waktu ke waktu (Bakshi et al. 2024 ). Secara kolektif, faktor-faktor ini menggarisbawahi pentingnya mempertimbangkan karakteristik molekuler dan arsitektur spheroid saat menilai potensi terapeutik agen antikanker, karena mereka memiliki dampak langsung pada distribusi obat, penyerapan seluler, dan efektivitas keseluruhan dalam model 3D.
Berdasarkan hasil penelitian saat ini, penelitian mendatang harus menyelidiki berbagai cara untuk lebih memahami manfaat terapeutik Aloe vera dan Doxorubicin dalam model spheroid 3D. Fokus kritisnya adalah pemeriksaan mekanisme molekuler yang mengatur jalur kematian sel apoptotik dan nekrotik yang dipicu oleh agen-agen ini. Mengidentifikasi jalur pensinyalan spesifik, termasuk aktivasi caspase dan respons kerusakan DNA, akan meningkatkan pemahaman tentang berbagai efek sitotoksik yang diamati. Selain itu, memprioritaskan optimalisasi strategi penghantaran obat untuk mengatasi tantangan penetrasi obat dalam spheroid 3D padat sangatlah penting. Ini melibatkan penyelidikan pembawa obat tingkat lanjut, seperti sistem berbasis nanopartikel, untuk meningkatkan distribusi dan kemanjuran obat. Faktor lingkungan mikro, termasuk hipoksia, gradien pH, dan ketersediaan nutrisi dalam spheroid, memerlukan penyelidikan lebih lanjut karena dampak potensialnya pada kemanjuran obat dan jalur kematian sel. Transisi temuan ini ke dalam studi in vivo sangat penting untuk mengevaluasi interaksi perawatan ini dengan lingkungan mikro tumor dan untuk menilai potensi klinisnya.
4 Kesimpulan
Studi ini menunjukkan kemungkinan signifikan Aloe vera sebagai agen antikanker alami, terutama jika dibandingkan dengan agen kemoterapi yang sudah mapan, Doxorubicin. Dengan memanfaatkan platform mikrofluida berbasis PDMS, kami menunjukkan pembentukan spheroid HepG2 3D yang kompak dan layak, yang menawarkan model yang relevan secara fisiologis untuk pengujian obat. Perbandingan Aloe vera dan Doxorubicin dalam kultur spheroid 3D menunjukkan efek yang berbeda, dengan Aloe vera menunjukkan sitotoksisitas yang bergantung pada konsentrasi dan Doxorubicin menunjukkan efek antiproliferatif yang lebih nyata. Studi ini mengonfirmasi kemanjuran Aloe vera dalam sistem kultur 3D dan menggambarkan penerapan perangkat mikrofluida berbasis PDMS dalam penelitian kanker. Platform ini memberikan pendekatan yang hemat biaya, dapat direproduksi, dan dapat diskalakan untuk skrining obat dan aplikasi pengobatan yang dipersonalisasi, terutama yang berkaitan dengan kanker hati. Studi ini menawarkan wawasan tentang potensi senyawa alami, seperti Aloe vera , untuk terapi antikanker di masa depan dan menekankan manfaat penggunaan sistem mikrofluida untuk meningkatkan akurasi dan keandalan dalam pengujian obat dalam model tumor tiga dimensi.



Tinggalkan Balasan