ABSTRAK
Infeksi yang berhubungan dengan implan gigi merupakan komplikasi serius setelah operasi yang dapat menyebabkan kendurnya atau bahkan hilangnya implan secara keseluruhan. Meskipun medan listrik endogen (EEF) memainkan peran integral dalam tubuh manusia, metode saat ini yang melibatkan stimulasi listrik eksternal bersifat invasif dan tidak cocok untuk aplikasi klinis. Dalam studi ini, kami menggunakan DC magnetron sputtering, menyelidiki efek pelapisan tantalum-perak (Ta-Ag) pada permukaan paduan titanium (TC4), dengan fokus pada potensinya untuk memengaruhi EEF yang meningkatkan aktivitas antibakteri. Dalam desain ini, konfigurasi Ta-Ag secara efektif meningkatkan perbedaan potensial permukaan TC4, dan selanjutnya, mendorong pelepasan ion Ta/Ag dan mengurangi adhesi bakteri. Studi ini menyimpulkan bahwa pelapisan Ta-Ag, khususnya implan TT/A, mendorong EEF yang stabil, meningkatkan sifat antibakteri dan osteogenik implan jangka panjang. Pekerjaan ini memberikan strategi yang menjanjikan untuk mengembangkan bahan implan canggih dengan efikasi klinis yang lebih baik.
1 Pendahuluan
Data epidemiologi menunjukkan bahwa peri-implantitis mempengaruhi sekitar 22% implan gigi, yang menghadirkan tantangan signifikan dalam praktik klinis [ 1 , 2 ]. Prevalensi yang tinggi ini sering mengakibatkan komplikasi yang parah, termasuk peningkatan biaya perawatan kesehatan, waktu pemulihan pasien yang lama, dan bahkan kegagalan implan [ 3 – 5 ]. Sebenarnya, infeksi peri-implan dapat muncul di semua titik waktu, mulai dari saat implan dimasukkan [ 6 – 8 ]. Namun, 4 minggu pertama setelah implantasi adalah periode puncak infeksi [ 9 – 11 ] karena antarmuka osseointegrasi belum terbentuk dan kemampuan anti-infeksi antarmuka cukup lemah, mungkin menyebabkan hilangnya implan lebih awal sebelum restorasi supra-konstruksi.
Untuk mengatasi tantangan infeksi terkait implan, berbagai strategi telah dikembangkan untuk meningkatkan sifat antibakteri bahan implan. Berbagai strategi telah diusulkan untuk memberikan implan sifat antibakteri yang ideal. Seperti antibiotik ke permukaan implan. Namun, pelepasan agen antimikroba yang terus menerus dapat menyebabkan resistensi bakteri [ 12 , 13 ], mengurangi kemanjuran dari waktu ke waktu. Modifikasi permukaan implan menggunakan nanopartikel telah menjadi topik populer dalam beberapa tahun terakhir. Sayangnya, nanopartikel mungkin memiliki toksisitas terhadap sel dan jaringan manusia, terutama dalam kasus konsentrasi tinggi atau paparan yang lama, yang dapat menyebabkan kerusakan sel atau respons inflamasi [ 11 ]. Biomakromolekul juga dapat diterapkan untuk tujuan antibakteri, tetapi ketidakstabilannya in vitro atau in vivo dapat menyebabkan degradasi, yang memengaruhi kemanjurannya [ 14 – 16 ]. Oleh karena itu, sifat antibakteri permukaan implan yang tahan lama untuk mencegah infeksi hingga antarmuka osseointegrasi terbentuk sepenuhnya sangat dibutuhkan.
Mengingat keterbatasan ini, ada peningkatan minat dalam strategi alternatif yang tidak hanya bergantung pada pelepasan zat antimikroba. EEF ada di jaringan dan organ manusia, dan medan ini memainkan peran penting dalam berbagai proses biologis, termasuk pertahanan mikroba. Di masa lalu, para sarjana telah menemukan bahwa medan listrik eksogen memiliki prospek penelitian yang luas dalam aplikasi antibakteri dan telah terbukti menghambat pertumbuhan bakteri dan pembentukan biofilm. Dengan menerapkan medan listrik, adalah mungkin untuk mengganggu transmisi sinyal bakteri, mempengaruhi permeabilitas membran sel, dan bahkan menginduksi efek elektroporasi, sehingga mencapai efek antibakteri [ 17 , 18 ]. Namun, penerapan EEF juga memiliki keterbatasan yang signifikan, termasuk kompleksitas operasional, ketergantungan pada peralatan, kesulitan dalam mencapai aplikasi in vivo jangka panjang yang stabil, dan potensi kerusakan pada sel normal di sekitarnya [ 19 – 21 ]. Masalah-masalah ini menimbulkan tantangan untuk aplikasi klinis praktis dari medan listrik eksogen. Penelitian telah menunjukkan bahwa medan listrik dapat memengaruhi perilaku bakteri, memandu pergerakan mereka dan memengaruhi pertumbuhan dan adhesi mereka [ 22 – 24 ]. Penerapan medan listrik yang tepat dapat mengganggu membran sel bakteri, yang menyebabkan kebocoran isi dan akhirnya kematian. Dalam konteks peri-implantitis, cedera jaringan lokal sering mengakibatkan ekstravasasi cairan dan perubahan sinyal kimia lokal [ 25 , 26 ], yang mengubah potensial dan menciptakan medan listrik yang berfluktuasi. Medan listrik endogen ini dianggap sebagai faktor penting dalam mengatur respons imun dan mencegah kolonisasi bakteri di area yang terluka. Merancang bahan yang dapat menghasilkan atau memanfaatkan EEF dapat menawarkan pendekatan yang menjanjikan untuk meningkatkan sifat antimikroba dan mendorong regenerasi jaringan tanpa kerumitan stimulasi listrik eksternal [ 24 ]. Mengembangkan bahan implan yang mengintegrasikan kemampuan ini dapat secara signifikan membantu mencegah infeksi selama proses penyembuhan.
Ta telah menerima perhatian yang semakin meningkat karena sifat biokompatibilitas dan osseointegrasinya yang sangat baik. Implan tulang yang terbuat dari Ta memiliki sifat osseointegrasi yang sangat baik dan stabilitas kimia jangka panjang [ 25 , 26 ], dan dapat dipertahankan secara permanen di jaringan inang, tetapi harga yang mahal telah membatasi promosi dan aplikasinya yang luas di pasaran. Dalam hal sifat antimikroba, Ag dikenal karena sifat antimikrobanya yang berspektrum luas dan sangat efektif. Ion Ag dapat mengikat enzim dalam bakteri, menghambat aktivitasnya, dan memengaruhi proses metabolisme bakteri. Ion Ag dapat meningkatkan pembentukan spesies oksigen reaktif (seperti hidrogen peroksida) dalam sel bakteri [ 27 , 28 ], yang dapat menyebabkan kerusakan pada DNA, protein, dan lipid bakteri.
Oleh karena itu, penelitian ini bertujuan untuk mengeksplorasi susunan spasial lapisan Ta dan Ag pada permukaan TC4 guna mengidentifikasi implan tulang yang dapat menghasilkan EEF stabil jangka panjang dalam organisme biologis. Hasil penelitian ini akan berkontribusi pada pengembangan material implan canggih dengan sifat antibakteri yang lebih baik, yang pada akhirnya meningkatkan kemanjuran dan keamanan klinisnya.
2 Metode
2.1 Persiapan Spesimen
Lapisan Ta-Ag diendapkan menggunakan sistem sputtering magnetron DC (DISCOVERY635, Denton Vacuum Equipment Co., Ltd., Tiongkok) yang dilengkapi dengan target berdiameter 76,2 mm dengan kemurnian 99,99%. Substrat paduan Ti6Al4V (TC4, Beijing Zhongnuo Advanced Materials Technology Co., Ltd.) berbentuk cakram, dengan dimensi Ф10 × 1,5 mm dan Ф15 × 10 mm, disiapkan dari material bermutu medis. Sebelum pengendapan, substrat menjalani pembersihan ultrasonik dalam aseton, alkohol, dan air deionisasi, diikuti dengan pemasangan pada dudukan substrat. Ruang dievakuasi ke tekanan dasar 1 × 10 −5 Pa. Untuk menghilangkan oksida permukaan, target dipra-sputtering dengan argon selama 10 menit. Selama pengendapan, arus target dipertahankan pada 0,3 A, dengan substrat dijaga pada suhu ruangan dan laju aliran argon 20 sccm. Waktu pengendapan ditetapkan sebagai berikut: 10 menit untuk film Ag (ketebalan 0,25 mm), 18 menit untuk film Ta (ketebalan 0,25 mm), dan 12 menit untuk film Ta-Ag yang di-co-sputter (ketebalan 0,5 mm). Kelompok kontrol adalah TC4.
2.2 Karakterisasi Spesimen
Morfologi permukaan dan patahan sampel dikarakterisasi menggunakan mikroskop elektron pemindaian emisi medan (FESEM, JSM-7900F, JEOL, Jepang). Kekasaran permukaan diukur dengan mikroskop gaya atom (AFM, SHIMADZU, Jepang), sedangkan hidrofilisitas dievaluasi melalui pengukuran sudut kontak air. Sudut kontak air dan diiodometana (KRUSS, DSA100, Jerman) ditentukan menggunakan meteran sudut kontak. Untuk pengukuran ini, 2 µL air deionisasi dituang ke permukaan sampel pada suhu ruangan, dan gambar diambil setelah tetesan stabil. Eksperimen pelepasan ion dilakukan dengan merendam sampel TC4, TT-A, TA/T, dan TT/A dalam cairan tubuh simulasi (SBF) dan menginkubasinya dalam osilator termostatik pada suhu 37°C. Setelah 5 hari perendaman, konsentrasi ion Ta dan Ag dalam SBF diukur menggunakan spektrometri massa plasma yang diinduksi (NexION 350D ICP-MS, PerkinElmer, AS). Potensi permukaan sampel yang tidak digunakan dinilai dengan AFM dalam mode mikroskopi probe Kelvin pemindaian (SKPM). Area permukaan sampel berukuran 5 µm × 5 µm dipindai dengan probe konduktif Pt, dan potensi kontak area ini dicitrakan.
2.3 Kultur Sel
Sel punca mesenkimal sumsum tulang (MSC) diisolasi dari cairan sumsum tulang tikus Sprague–Dawley jantan dengan berat 100–120 g. Rongga sumsum tulang femur tikus dibilas dengan larutan garam penyangga fosfat (PBS) yang mengandung larutan antibiotik 10% (Servicebio, Wuhan, Tiongkok). Cairan sumsum tulang yang terkumpul disentrifugasi pada 1000 rpm selama 5 menit, dan pelet yang dihasilkan disuspensikan kembali dalam medium MSC yang terdiri dari medium Eagle yang dimodifikasi Dulbecco (DMEM, Servicebio, Wuhan, Tiongkok) yang ditambah dengan 1% penisilin-streptomisin dan 10% serum sapi janin (FBS, 04-001-1ACS, Israel). Sel dikultur pada suhu 37°C dalam inkubator humidifikasi dengan 5% CO 2 . Setelah 24 jam, sel yang tidak melekat dibuang, dan medium baru ditambahkan, dengan penggantian medium terjadi setiap 2–3 hari. Kultur primer disubkultur pada rasio 1:2 saat rBMSC mencapai sekitar 80% konfluensi. Untuk percobaan berikutnya, sel pada lintasan 3–5 (P3-P5) disemai pada kepadatan 1 × 10⁴ sel per sumur ke dalam pelat 48 sumur yang berisi sampel TC4, Ta-Ag, Ag/Ta, dan Ta/Ag. Sebelum disemai, sampel disterilkan di bawah sinar ultraviolet selama 2 jam. Sel dikultur dengan penggantian medium setiap 2 hari, dan perlekatan sel pada perancah dipantau menggunakan mikroskop cahaya Zeiss.
2.3.1 Sitokompatibilitas
Setelah membudidayakan rBMSC pada berbagai sampel selama 7 hari, viabilitas sel dinilai menggunakan Kit Pewarnaan Ganda calcein-AM/PI (Solarbio Science & Technology Co., Beijing, Tiongkok). Metode pewarnaan ini membedakan sel hidup, yang berpendar hijau, dari sel mati, yang berpendar merah. Sel yang diwarnai kemudian divisualisasikan menggunakan mikroskop konfokal laser (TCS SP8, Leica, Jerman).
2.3.2 Adhesi Sel dan Morfologi
Pewarnaan fluoresensi juga dilakukan pada rBMSC yang dikultur pada sampel yang berbeda. Setelah 72 jam kultur, sel difiksasi dengan 4% paraformaldehida selama 30 menit pada suhu 4°C. Sel kemudian dipermeabilisasi dengan 0,1% Triton X-100 (Solarbio Science & Technology Co., Beijing, Cina) selama 10 menit. Setelah tiga kali pencucian dengan PBS, 10% serum sapi (Solarbio Science & Technology Co., Beijing, Cina) diaplikasikan untuk memblokir tempat pengikatan non-spesifik. Alexa Fluor 488 phalloidin (CA1620, Solarbio, Wuhan, Cina) ditambahkan dan diinkubasi selama 1 jam dalam gelap. Sel kemudian diwarnai dengan 4′,6-diamidino-2-phenylindole hydrochloride (DAPI, Solarbio, Cina) selama 5 menit, diikuti oleh tiga kali pembilasan PBS tambahan. Sel yang diwarnai diamati menggunakan mikroskop confocal laser (Olympus, Jepang).
2.3.3 Deteksi Potensial Membran Sel
Perubahan potensial membran sel dinilai dengan memantau variasi intensitas fluoresensi. Setelah membudidayakan rBMSC pada sampel yang berbeda dalam pelat 48-sumur selama 24 jam, sel-sel dilepaskan dari permukaan material untuk memperoleh endapan sel. DiBAC4(3) (Solaibio, CAS: 70363-83-6, Beijing, Tiongkok) ditambahkan pada kisaran konsentrasi 1–5 µmol L −1 . Perubahan intensitas fluoresensi setelah stimulasi diamati menggunakan mikroskop fluoresensi (PE-300, AXIO, Jerman). Karena fluoresensi DiBAC4(3) sensitif terhadap suhu, pengukuran dilakukan pada suhu 37°C.
2.3.4 Penjepit Patch Sel Utuh
Untuk penilaian elektrofisiologis, BMSC (3 × 103 sel cm – 2 ) dikultur dalam medium Neurobasal dengan setiap kelompok sampel selama 3 hari. Rekaman dibuat menggunakan amplifier Axon 700B (Axon Instruments, CA). Untuk mengukur Potensi Membran Istirahat (RMP), sel ditahan pada -70 mV dalam kondisi penjepit tegangan. Langkah arus dari -70 ke 0 pA, berlangsung selama 500 ms, diterapkan untuk mengamati fluktuasi tegangan sebagai respons terhadap arus ini. Resistansi masukan ditentukan menggunakan persamaan:

Untuk Analisis Bidang Fase, pulsa arus masuk sebesar 5 pA diperkenalkan, diikuti oleh perintah bertahap dari 0 hingga 200 pA dengan durasi 15 ms. Potensial membran di bawah ambang batas dicatat untuk sel-sel dalam kelompok kontrol dan TC4-Ta/Ag pada 200 pA. Selanjutnya, plot bidang fase dibuat untuk menganalisis laju perubahan tegangan selama fase depolarisasi dan repolarisasi.
2.4 Aktivitas Antibakteri In Vitro
Untuk percobaan antimikroba, Staphylococcus aureus (ATCC 25923) dan Escherichia coli (ATCC 25922) dikultur dalam medium Luria–Bertani (LB) (Beijing Luqiao, Tiongkok). Kultur bakteri disiapkan dengan menginokulasi medium LB dengan bakteri menggunakan loop inokulasi untuk membuat suspensi bakteri. Suspensi ini kemudian diencerkan dengan PBS steril untuk mencapai konsentrasi 1 × 107 sel mL −1 . Volume 500 µL dari setiap suspensi bakteri diaplikasikan ke sampel yang berbeda dalam pelat 24-sumur dan diinkubasi secara statis pada 37°C selama 12 jam untuk menilai morfologi bakteri. Setelah inkubasi, sampel dicuci tiga kali dengan PBS. Bakteri yang menempel difiksasi dengan 2,5% (v/v) glutaraldehida selama 30 menit pada suhu 4°C, diikuti dengan dehidrasi dengan peningkatan konsentrasi etanol (20%, 40%, 60%, 80%, dan 100%) selama masing-masing 15 menit, dan kemudian didehidrasi lebih lanjut dengan butanol tersier selama 30 menit. Sampel kemudian dikeringkan dalam vakum, dilapisi emas, dan diamati menggunakan mikroskop elektron pemindaian emisi medan (FE-SEM, JSM-7900F, JEOL, Jepang). Khasiat antibakteri dievaluasi menggunakan metode penghitungan pelat. Singkatnya, 100 µL dari setiap suspensi bakteri disebarkan pada sampel yang berbeda dalam pelat 24 sumur dan diinkubasi secara statis pada suhu 37°C selama 24 jam. Setelah inkubasi, bakteri dilepaskan dari permukaan sampel dengan perawatan ultrasonik dengan garam pembilas, dan permukaan kemudian dicuci tiga kali dengan PBS steril. Eluat bakteri diencerkan hingga konsentrasi yang sesuai dengan PBS steril, dan 100 µL pengenceran ini ditaburkan pada pelat agar LB. Setelah inkubasi selama 24 jam pada suhu 37°C, unit pembentuk koloni (CFU) dihitung dan difoto. Tingkat antimikroba dihitung menggunakan rumus:
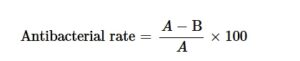
di mana A menyatakan jumlah rata-rata CFU dalam kelompok kontrol, dan B menyatakan jumlah rata-rata CFU dalam kelompok eksperimen.
2.5 Pemodelan In Vivo
Empat puluh tikus Sprague–Dawley jantan, berusia 5 minggu dengan berat rata-rata 250 ± 30 g, secara acak dimasukkan ke dalam lima kelompok: TC4, TT-A, TA/T, TT/A, dan kelompok kontrol Blank, dengan lima tikus di setiap kelompok. Protokol percobaan hewan disetujui oleh komite etik hewan Universitas Xi’an Jiaotong (Xi’an, Tiongkok). Untuk menyiapkan implan, S. aureus (2 × 10 3 bakteri dalam 20 µL PBS) dioleskan secara merata ke permukaan, dan implan diinkubasi dalam lingkungan lembap pada suhu 37°C selama 4 jam untuk meningkatkan adhesi bakteri. Dalam kondisi steril, setiap tikus menerima dua implan di femur distal. Prosedur dimulai dengan membius tikus menggunakan suntikan intraperitoneal kloral hidrat 10% (0,1 mL/100 g, #P3761, Sigma-Aldrich, AS). Sayatan longitudinal sepanjang 10 mm dibuat di sepanjang aspek medial sendi lutut, dan mekanisme ekstensor didislokasi ke arah lateral bersama patela. Lutut ditekuk, dan terowongan tulang berdiameter 2 mm dan panjang 10 mm dibor dari takik interkondilaris menggunakan handpiece berkecepatan rendah. Larutan garam normal digunakan selama prosedur untuk pendinginan dan irigasi. Implan dari berbagai kelompok dimasukkan melalui epifisis femoralis distal ke dalam kanalis femoralis hingga ujung implan diposisikan di bawah permukaan sendi. Patela kemudian diposisikan ulang, dan analgesik diberikan dalam air minum tikus selama 3 hari.
Pada 8 minggu pasca-operasi, tikus (5 ekor per kelompok) disuntik mati dengan kloral hidrat (Sigma-Aldrich, AS), dan tulang paha mereka diambil untuk analisis lebih lanjut. Jaringan tulang peri-implan ( n = 5 ekor per kelompok) diperiksa menggunakan mikro-CT resolusi tinggi (AX-2000, ALWAYS, Ningbo, Tiongkok) dengan parameter pemindaian ditetapkan pada 8,68 µm per irisan, tegangan 120 kV, dan arus 100 µA.
2.6 Evaluasi Histologi dan Kontak Implan Tulang
Tulang paha yang diimplan difiksasi dalam formalin fosfat 4% selama 48 jam, diikuti oleh dehidrasi dalam serangkaian larutan etanol dengan berbagai konsentrasi (70%, 80%, 85%, 90%, 95%, dan 100%, v/v) sebelum ditanamkan dalam PMMA. Spesimen dipotong tegak lurus terhadap sumbu panjang implan pada ketebalan 150 µm menggunakan mikrotom Leica SP1600 (Leica, Jerman) dan kemudian dipoles hingga ketebalan 20 µm. Pewarnaan picrofuchsin Van Gieson diaplikasikan untuk memvisualisasikan jaringan tulang yang termineralisasi, yang muncul dalam warna merah atau biru. Bersamaan dengan itu, analisis histologis dilakukan menggunakan mikroskop cahaya (Olympus, WILD MP5, Jepang), dan indeks kontak tulang-implan (BIC) dinilai melalui analisis histometrik menggunakan perangkat lunak BIOQUANT OSTEO (AS).
2.7 Analisis Statistik
Data dinyatakan sebagai rata-rata ± simpangan baku dan dianalisis menggunakan GraphPad Prism (GraphPad Software 9.4.0, San Diego, CA, AS). Setiap percobaan dilakukan minimal tiga kali. Perbandingan antara dua kelompok dilakukan menggunakan uji- t Student dua sisi yang tidak berpasangan , sementara beberapa perbandingan dinilai menggunakan ANOVA satu arah bersarang diikuti oleh uji post-hoc Tukey. Signifikansi statistik didefinisikan sebagai * p < 0,05.
3 Hasil dan Pembahasan
3.1 Karakterisasi dan Sifat Sampel TC4
Pengenalan lapisan Ta-Ag telah mengubah sifat fisiko-kimia permukaan TC4. Ta dikenal karena biokompatibilitas dan stabilitas kimianya yang baik dan dapat membentuk lapisan oksida stabil yang meningkatkan ketahanan korosi material dan memberikan perlindungan antimikroba [ 29 ]. Ag selanjutnya meningkatkan penghambatan bakteri pada permukaan TC4 karena sifat antimikrobanya yang kuat. Pengamatan SEM menunjukkan bahwa lapisan kelompok eksperimen dengan tata letak spasial yang berbeda diendapkan secara seragam pada permukaan TC4 tanpa retakan atau kerusakan, memverifikasi integritas proses sputtering (Gambar 1A,B ). Melalui percobaan sudut kontak air (Gambar 1C ), dapat dilihat bahwa sudut kontak kelompok TC4 dan setelah sputtering Ta dan Ag kurang dari 90 derajat, menunjukkan bahwa semua kelompok memiliki hidrofilisitas yang sangat baik.
Studi kami menemukan bahwa dengan menyesuaikan urutan sputtering Ta dan Ag, perbedaan potensial permukaan dapat diubah secara efektif, sehingga meningkatkan efek antibakteri. Perbedaan potensial permukaan diukur dengan AFM dalam mode mikroskopi probe Kelvin pemindaian (SKPM) (Gambar 1E,F ). Hasil penelitian menunjukkan bahwa perbedaan potensial permukaan kelompok TT-A secara signifikan lebih tinggi daripada kelompok eksperimen lainnya. Hal ini diverifikasi oleh analisis plasma yang digabungkan secara induktif (ICP) (Gambar 1D ), yang menunjukkan bahwa konsentrasi ion Ta dan Ag yang dilepaskan dari kelompok TT-A secara signifikan lebih tinggi daripada kelompok eksperimen lainnya. Hasil ini menunjukkan bahwa ketika tata letak spasial Ta-Ag diubah, konsentrasi ion Ta-Ag yang dilepaskan juga memiliki efek pada perbedaan potensial di permukaan, yang pada akhirnya dapat meningkatkan kapasitas antimikroba material (Gambar 2 ).
3.2 Sitokompatibilitas In Vitro
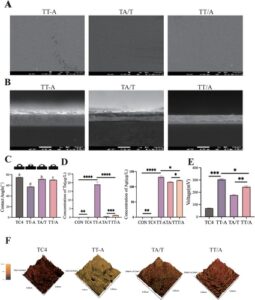
Untuk mengamati efek tata letak spasial yang berbeda pada biokompatibilitas implan tulang, BMSC disemai pada permukaan kelompok eksperimen yang berbeda. Pewarnaan hidup/mati digunakan untuk menilai biokompatibilitas, dan hasilnya menunjukkan bahwa tidak ada kematian sel yang signifikan dalam sampel mana pun dibandingkan dengan kelompok kontrol. Pemeriksaan lebih lanjut terhadap perubahan morfologi BMSC melalui pewarnaan sitoskeleton mengungkapkan bahwa kelompok TA/T dan TT/A menunjukkan diferensiasi sel yang lebih baik dan kontak yang lebih dekat dibandingkan dengan kelompok eksperimen lainnya. Sebaliknya, BMSC dalam kelompok TT-A menunjukkan morfologi yang menyusut. Melalui percobaan ini, kami menemukan bahwa bahkan setelah mengubah tata letak spasial Ta dan Ag, implan tulang mempertahankan biosafety yang baik. Efek sampel dengan tata letak spasial yang berbeda pada diferensiasi sel menunjukkan beberapa variabilitas dengan hasil percobaan karakterisasi, yang kami spekulasikan disebabkan oleh muatan biolistrik (Gambar 3 ).
3.3 Sifat Elektrokimia Bahan
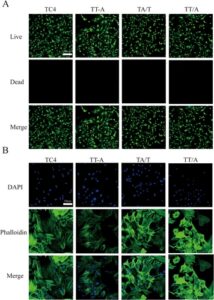
Meskipun teknik penjepit membran tidak dapat secara langsung menangkap bakteri, teknik ini memungkinkan kami untuk mengamati bagaimana bahan tersebut mempengaruhi potensial membran sel, yang membawa kami pada hipotesis bahwa pergerakan ion di dalam dan luar sel menghasilkan medan listrik endogen [ 30 ]. Untuk menguji kecurigaan kami, kami secara langsung menangkap efek tata letak spasial yang berbeda dari permukaan implan tulang pada potensial membran osteoblas menggunakan teknik penjepit membran [ 31 ]. Kami menemukan bahwa potensial membran BMSC pada permukaan kelompok TT/A menunjukkan depolarisasi yang signifikan dibandingkan dengan kelompok kontrol, dan selanjutnya, probe fluoresensi potensial membran mengungkapkan bahwa potensial membran BMSC pada permukaan kelompok TT/A paling signifikan diubah. Dengan hasil ini, kami menyimpulkan bahwa kelompok TT/A lebih mampu meningkatkan aktivitas biologis BMSC yang relevan. Dari sini, kami berpendapat bahwa sampel dengan perbedaan potensial permukaan yang berbeda juga mempengaruhi viabilitas bakteri.
Dengan menggabungkan percobaan-percobaan di atas, dengan memeriksa sifat-sifat elektrokimia dari sampel-sampel yang berbeda, kami menemukan bahwa laju pelepasan ion Ta dan Ag dalam kelompok TT-A secara signifikan lebih tinggi daripada laju pelepasan ion dalam kelompok-kelompok lain, dan perbedaan potensial permukaan juga secara signifikan lebih besar daripada laju pelepasan ion dalam kelompok-kelompok lain. Akan tetapi, meskipun semua sampel bersifat biokompatibel, TT/A lebih mendorong diferensiasi sel daripada kelompok-kelompok lain, dan selanjutnya perubahan-perubahan dalam potensial membran sel adalah yang paling signifikan. Alasan untuk hasil ini adalah bahwa TT-A tidak dapat menyimpan muatan bebas karena pelepasan ion-ion yang cepat dalam periode pra-perlakuan. Pelepasan ion-ion yang lambat dari TT/A mampu menciptakan medan listrik endogen yang stabil pada permukaan sampel, yang memungkinkan muatan bebas untuk terus bekerja pada membran sel di hadapan medan listrik ini, sehingga membuka saluran-saluran yang relevan dan mendorong diferensiasi sel.
3.4 Implan Aktif Secara Elektrik Meningkatkan Aktivitas Antibakteri secara In Vitro
Untuk mengamati kapasitas antimikroba implan tulang dalam tata letak spasial yang berbeda, sifat antimikroba dari bahan dievaluasi dengan mengkulturkannya bersama S. aureus atau E. coli pada permukaan bahan yang berbeda dan menghitung koloni. Menurut Gambar 4A , dapat dilihat bahwa kelompok TT/A dan TT-A menghambat pertumbuhan bakteri lebih baik daripada kelompok lainnya. Dapat dilihat dengan mikroskop elektron pemindaian bahwa morfologi bakteri dari kelompok eksperimen menunjukkan fenomena keriput dan cacat dibandingkan dengan kelompok kosong dan kontrol (Gambar 4B ), di antaranya morfologi bakteri kelompok TT/A dan TT-A paling signifikan berubah, yang juga membuktikan bahwa kelompok TT/A dan TT-A memiliki kinerja antimikroba yang lebih baik.
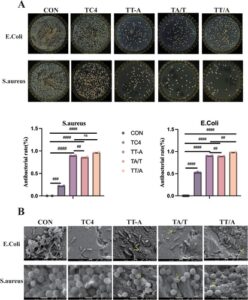
Melalui hasil di atas, kelompok TT/A dan TT-A memiliki kemampuan antibakteri yang lebih menonjol. TT-A dan TT/A memiliki kinerja antibakteri yang lebih baik, yang disebabkan oleh fakta bahwa mereka dapat dengan cepat melepaskan ion Ag bermuatan positif pada tahap awal dan memiliki perbedaan potensial yang tinggi pada permukaannya, yang memiliki kemampuan untuk membuat sejumlah besar ion logam ini bergabung dengan yang bermuatan negatif pada tahap awal. Sejumlah besar ion logam ini pada awalnya dapat berinteraksi dengan dinding sel bakteri bermuatan negatif, yang menyebabkan lisis dan kematian bakteri [ 32 ].
3.5 Implan Aktif Elektrik Meningkatkan Osteogenesis Melalui Aktivitas Antibakteri in Vivo
Osseointegrasi yang buruk dari implan sebagian besar disebabkan oleh infeksi bakteri, yang akhirnya menyebabkan melonggarnya atau bahkan terlepasnya implan [ 33 ]. Bahan tersebut ditanamkan ke dalam model tikus dengan cacat tulang yang terinfeksi (Gambar 5A ). Untuk mengamati apakah bahan tersebut aman secara biologis in vivo, kami mengisolasi jantung, hati, limpa, paru-paru, ginjal, dan testis tikus dan melakukan pewarnaan H&E, dan tidak ada sel inflamasi atau lesi yang jelas terdeteksi di bawah mikroskop, yang menunjukkan bahwa bahan kami tidak memiliki toksisitas yang jelas terhadap organ sistemik (Gambar 5B ). Pemindaian mikro-CT femur tempat prostesis ditanamkan dilakukan untuk menilai kemampuan osseointegrasi bahan tersebut. Gambar 5C menunjukkan penampang melintang longitudinal dan transversal femur yang ditanamkan dengan implan tulang yang berbeda, serta gambar mikro-CT setelah rekonstruksi tiga dimensi. Jelas bahwa kepadatan tulang yang baru terbentuk di sekitar implan TT/A lebih tinggi daripada kelompok lainnya. Berikutnya, infiltrasi bakteri pada jaringan peri-implan dinilai dengan pewarnaan VG (Gambar 5D ). Setelah implantasi TC4, keberadaan serat (panah biru) antara tulang baru (panah kuning) dan implan (panah putih) mencegah kontak langsung antara tulang baru dan implan, sehingga menciptakan apa yang dikenal sebagai bungkusan serat. Kapasitas osseointegrasi dinilai dengan mengukur rasio panjang tulang baru pada permukaan material yang bersentuhan langsung dengan material terhadap panjang penampang material, yaitu, statistik kontak implan tulang (BIC). Dengan menghitung BIC (Gambar 5E ), BIC kelompok TC4 adalah 0,17 ± 0,012, TT-A adalah 0,42 ± 0,023, TA/T adalah 0,36 ± 0,015, dan TT/A adalah 0,78 ± 0,018. TT/A juga ditemukan lebih baik dalam meningkatkan osseointegrasi.
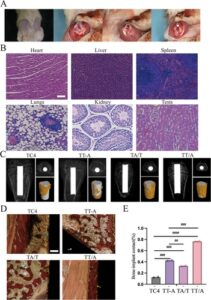
Berdasarkan percobaan in vivo, kami menemukan beberapa perbedaan dibandingkan dengan hasil antimikroba in vitro. Kami percaya ini disebabkan oleh interaksi antara implan dan lingkungan mikro in vivo, bukan hanya pengaruh muatan listrik. Di sini, kami mengusulkan bahwa lingkungan mikro muatan memainkan peran yang signifikan. Kinerja antimikroba in vitro sebagian besar disebabkan oleh perbedaan potensial permukaan material yang lebih tinggi, yang menyebabkan pelepasan sejumlah besar ion Ag, yang memberikan aktivitas antibakteri yang kuat. Namun, lingkungan in vivo jauh lebih kompleks, yang melibatkan tidak hanya interaksi muatan antara implan dan osteoblas tetapi juga interaksi antara sel dan lingkungan sekitarnya [ 34 ]. Meskipun kemampuan osseointegrasi kelompok TT-A ditingkatkan secara signifikan dibandingkan dengan kelompok kontrol, ini mungkin disebabkan oleh pelepasan ion yang cepat ke dalam tubuh, yang meningkatkan kinerja antibakteri. Namun, hal itu juga menyebabkan pembentukan kapsul fibrosa antara implan dan tulang dewasa, yang mengakibatkan ikatan tulang yang lebih lemah pada tahap selanjutnya. Dalam jangka panjang, hal ini mungkin disebabkan oleh kapasitas penyimpanan muatan material yang terbatas, yang tidak dapat mempertahankan medan listrik endogen yang stabil dalam lingkungan mikro muatan, sehingga gagal memberikan efek antimikroba jangka panjang. Sebaliknya, implan TT/A menunjukkan osseointegrasi yang jauh lebih baik antara implan dan tulang baru, yang memungkinkan kontak langsung antara tulang baru dan implan. Hal ini karena, di bawah tata letak spasial ini, kelompok T menunjukkan kemampuan penyimpanan muatan bebas yang sangat baik, membentuk medan listrik endogen yang stabil dan tahan lama. Hasilnya, medan listrik yang stabil ini dapat memberikan aktivitas antimikroba yang berkelanjutan, yang mengarah pada kinerja osseointegrasi yang unggul.
Sebagai kesimpulan, strategi kami memiliki biosafety dan efek antimikroba in vivo yang memadai saat menyemprotkan Ta diikuti oleh Ag pada permukaan TC4. Kapasitas TT/A memungkinkan kapasitas penyimpanan muatan yang tinggi, yang pada gilirannya menghasilkan potensial aksi aktif pada membran sel, yang pada akhirnya memanifestasikan dirinya sebagai kemampuan untuk meningkatkan osseointegrasi dalam lingkungan inflamasi in vivo.
Hasil penelitian ini menunjukkan bahwa konstruksi pelapis Ta-Ag dengan tata letak spasial yang berbeda pada permukaan TC4 dengan mengubah urutan sputtering dapat menghasilkan medan listrik endogen, yang mempromosikan lingkungan mikro muatan di sekitar implan tulang ke arah yang menguntungkan bagi antimikroba, dan akhirnya sifat antimikroba pelapis Ta-Ag dapat ditingkatkan secara efektif untuk mempromosikan kemampuan osseointegrasi implan tulang. Ini memberikan dasar teoritis dan dukungan teknis yang penting untuk pengembangan lebih lanjut dari biomaterial antimikroba baru. Namun, teknologi modifikasi permukaan TC4 masih menghadapi beberapa tantangan dalam aplikasi praktis. Misalnya, bagaimana memastikan stabilitas lingkungan mikro muatan untuk memastikan efek jangka panjangnya dalam lingkungan fisiologis yang kompleks; bagaimana mengoptimalkan ketebalan lapisan dan distribusi muatan permukaan untuk memaksimalkan efek antimikrobanya tanpa mempengaruhi sifat mekanis dan biokompatibilitas material.
Penelitian di masa depan dapat lebih jauh mengeksplorasi aspek-aspek berikut: Dalam karya ini, pembentukan EEF dengan mengubah tata letak spasial Ta dan Ag telah dicapai dalam struktur dua dimensi, tetapi kompleksitas dan struktur tiga dimensi organisme hidup membuat penelitian ini menantang. Langkah berikutnya adalah mengeksplorasi metode untuk membangun medan listrik dalam tiga dimensi, dan untuk merancang dan membuat struktur tiga dimensi dengan distribusi medan listrik tertentu. Ini akan membantu untuk lebih meniru lingkungan dalam organisme hidup, memfasilitasi efek antimikroba, dan meningkatkan aplikasi praktis bahan-bahan tersebut. Penelitian terbaru telah menemukan bahwa reseptor leptin memainkan peran penting dalam pengaturan keseimbangan energi [ 35 ]. Jadi, efek medan listrik pada ekspresi dan fungsi reseptor leptin dapat diselidiki, serta kemungkinan mekanisme aksi reseptor leptin dalam proses antimikroba. Dengan mengungkap interaksi antara reseptor leptin dan muatan listrik, hal itu dapat memberikan ide-ide baru untuk pengembangan strategi antimikroba baru, terutama dalam mengatur respons imun dan meningkatkan perbaikan sel.
4 Kesimpulan
Sebagai kesimpulan, penelitian kami menunjukkan bahwa konstruksi pelapis Ta-Ag dengan tata letak spasial yang bervariasi pada permukaan TC4 dapat secara efektif menghasilkan medan listrik endogen yang meningkatkan lingkungan mikro muatan lokal, meningkatkan sifat antimikroba, dan memperbaiki osseointegrasi. Kelompok TT/A, dengan kapasitas penyimpanan muatan yang unggul dan medan listrik yang stabil, menunjukkan osseointegrasi jangka panjang yang jauh lebih baik dibandingkan dengan strategi konvensional, yang menawarkan pendekatan yang menjanjikan untuk aplikasi implan dalam lingkungan in vivo yang kompleks. Namun, tantangan tetap ada, termasuk memastikan stabilitas jangka panjang lingkungan mikro muatan dan mengoptimalkan keseimbangan antara kemanjuran antimikroba, ketebalan lapisan, dan sifat mekanis. Penelitian di masa mendatang harus bertujuan untuk mengeksplorasi konstruksi medan listrik tiga dimensi untuk mensimulasikan lingkungan biologis dengan lebih baik dan menyelidiki peran reseptor leptin dalam efek antimikroba yang dimediasi muatan. Temuan ini memberikan dasar yang kuat untuk pengembangan biomaterial antimikroba tingkat lanjut dan menyoroti potensi untuk mengintegrasikan modulasi biolistrik dalam teknologi implan.



Tinggalkan Balasan