Perkenalan
Pematangan melibatkan pemrograman ulang biokimia dan molekuler yang kompleks, yang menghasilkan perubahan warna, tekstur, aroma, dan rasa untuk menarik manusia dan hewan lainnya (Giovannoni et al ., 2017 ). Pada buah klimakterik, proses ini dikendalikan oleh banyak sekali fitohormon, terutama etilen (Li et al ., 2021 ; Huang et al ., 2022 ). Untuk memungkinkan perubahan ini, buah terus-menerus membentuk kembali proteom selulernya dengan menyempurnakan degradasi dan sintesis protein (Szymanski et al ., 2017 ). Sementara sistem ubiquitin–proteasome terbukti penting dalam pensinyalan etilen dan pematangan (Fenn & Giovannoni, 2021 ; Jia et al ., 2023 ), pengetahuan tentang dampak autofagi, sistem degradasi sentral lainnya, agak terbatas.
Autofagi mengirimkan komponen sitosol ke vakuola untuk degradasi dan daur ulang. Vesikel membran ganda, disebut autofagosom, dihasilkan di sekitar kargo seluler yang ditujukan untuk degradasi. Autofagosom kemudian menyatu dengan tonoplas untuk melepaskan struktur membran tunggal, disebut badan autofagik. Di dalam vakuola, badan autofagik terdegradasi bersama dengan kargonya, dan konstituennya didaur ulang untuk mengisi kembali energi seluler. Autofagi dieksekusi melalui fungsi > 30 protein terkait autofagi (ATG) (Ding et al ., 2018 ; Marshall & Vierstra, 2018 ). Khususnya, protein ATG yang diberi anotasi dengan nomor berbeda tidak terkait dan memiliki peran berbeda dalam autofagi. Di antara ini, protein ATG8 seperti ubikuitin penting untuk biogenesis autofagosom, fusi dengan vakuola, dan pengenalan selektif kargo yang akan didegradasi. Mereka ditemukan terkonjugasi baik dengan lipid fosfatidiletanolamin (PE) (terlipidasi) atau dalam bentuk bebas nonaktif (nonlipidasi) (Kellner et al ., 2017 ). Famili ATG8 terdiri dari sembilan anggota dalam Arabidopsis thaliana ( Arabidopsis ; AtATG8a hingga AtATG8i). Ketika terkonjugasi dengan protein fluoresen, protein famili ATG8 dianggap sebagai penanda optimal untuk penilaian aktivitas autofagi (atau fluks), karena stabilitas bagian protein fluoresen memungkinkan estimasi jumlah bahan autofagi yang dikirim ke vakuola. Sementara penilaian status lipidasi ATG8 (rasio ATG8-PE : ATG8) memberikan ukuran kadar membran autofagi dalam sitosol, hal itu tidak selalu mencerminkan aktivitas autofagi (Qi et al ., 2023 ). Karena beberapa tingkat redundansi (Del Chiaro et al ., 2024 ), anggota keluarga ATG8 tidak digunakan untuk analisis fungsional. Sebagai alternatif, penurunan regulasi gen ATG esensial lainnya (dan biasanya salinan tunggal) , seperti ATG2 , ATG5 , atau ATG7 , masing-masing secara independen, dapat berfungsi untuk analisis fungsional (Marshall & Vierstra, 2018 ). Masing-masing gen ini memiliki peran penting dalam autofagi, yang menjadikan mutan knockout masing-masing kekurangan autofagi. ATG2, bersama dengan protein keluarga ATG9 dan ATG18, berfungsi dalam sistem pengiriman lipid ke fagofor yang sedang berkembang. Baru-baru ini, perekrutan ATG18a yang bergantung pada ATG2 ke fagofor untuk mendorong perluasan dan penutupannya terungkap (Luo et al ., 2023 ). ATG5 dan ATG7 bertanggung jawab atas langkah-langkah yang berbeda namun penting dari konjugasi protein ATG8 seperti ubiquitin ke membran autofagik. ATG4, suatu protease yang memungkinkan lipidasi atau delipidasi anggota ATG8, diwakili oleh satu gen dalam Solanum lycopersicum (tomat) dan dua gen dalam Arabidopsis ( AtATG4a dan AtATG4b ) dan juga digunakan untuk analisis fungsional (Seo et al ., 2016 ).
Awalnya, diasumsikan bahwa etilen dan autofagi tidak terkait berdasarkan kurangnya fenotipe pemulihan penuaan daun pada tanaman Arabidopsis yang kekurangan gen autofagi dan Ethylene-Insensitive 2 (Yoshimoto et al ., 2009 ). Namun, beberapa penelitian kemudian menunjukkan bahwa interaksi tersebut ada (Liao et al ., 2022 ). Pertama, kelimpahan transkrip beberapa gen biosintesis etilen dan pensinyalan etilen lebih tinggi pada mutan atg5 dan atg9 daripada pada tanaman Arabidopsis tipe liar (WT) ( Col-0 ) (Masclaux-Daubresse et al ., 2014 ). Selain itu, tanaman tomat yang diobati dengan prekursor etilen, 1-aminosiklopropana-1-karboksilat (ACC), menunjukkan peningkatan aktivitas autofagi dan ekspresi gen SlATG8d dan SlATG18h selama kekeringan. Penulis menyarankan pengikatan langsung Ethylene Response Factor 5 ke promotor gen-gen ini (Zhu et al ., 2018 ). 1-Aminocyclopropane-1-carboxylate juga dilaporkan menginduksi autophagy di Arabidopsis (Rodriguez et al ., 2020 ). Akhirnya, penuaan daun kelopak yang diinduksi penyerbukan, disertai dengan peningkatan emisi etilen, selanjutnya disertai dengan peningkatan ekspresi isoform petunia PhATG8 dan pembentukan autophagosom. Khususnya, antagonis etilen, 1-methylcyclopropene (1-MCP), menunda induksi protein PhATG8 setelah penyerbukan dan munculnya struktur subseluler yang dianggap sebagai autophagosom (Shibuya et al ., 2013 ). Oleh karena itu, etilen berulang kali disarankan untuk mengatur autophagy. Meskipun demikian, masih belum jelas apakah autofagi memiliki dampak regulasi pada etilen dan apakah ia terlibat dalam pematangan buah klimakterik.
Bahan dan Metode
Pertumbuhan dan transformasi tanaman
Tomat ( Solanum lycopersicum L.) Micro-Tom, kultivar Moneymaker dan Ailsa Craig, dan Arabidopsis thaliana (L.) Heynh. Ekotipe Col-0 digunakan dalam penelitian ini. Tomat ditanam dalam pot pada suhu 23°C di rumah kaca dengan iklim terkontrol di bawah siklus terang : gelap 12 jam. Arabidopsis ditanam di ruang pertumbuhan pada suhu 16 jam : 8 jam, siklus terang : gelap 22°C. Benih Del/Ros1 Micro-Tom transgenik (Orzaez et al ., 2009 ) diperoleh dari laboratorium Prof. Asaph Aharoni (Institut Weizmann). Garis Moneymaker GFP-SlATG8-2.2 dihasilkan dengan mengubah konstruksi 35S::GFP-StATG8-2.2 (Kentang StATG8-2.2 identik dengan padanan tomat), yang disediakan oleh Dr. Yasin Dagdas (Zess et al ., 2019 ). Garis E8:: SlATG4 -RNAi dihasilkan dalam latar belakang Micro-Tom.
Transformasi tomat dengan konstruksi E8:: ATG4- RNAi dilakukan menggunakan strain Agrobacterium GV3101 yang mengandung plasmid yang sesuai seperti yang dijelaskan dalam Sun et al . ( 2015 ) dengan sedikit modifikasi. Benih tomat disterilkan permukaannya dan dikecambahkan pada medium Murashige & Skoog (MS) kekuatan ½ (+30 g l −1 sukrosa). Setelah 10 hari, kotiledon yang telah mengembang sempurna dibedah, dengan hanya bagian tengahnya yang digunakan. Eksplan direndam dalam suspensi Agrobacterium (OD 600 = 0,6) selama 20 menit. Eksplan kemudian dikeringkan dengan hati-hati pada kertas Whatman dan dipindahkan ke medium kokultivasi (medium MS yang dilengkapi dengan sukrosa 3% (b/v), agar 0,8%, dan 2 mg l −1 6-Benzylaminopurine) selama 2 hari dalam gelap. Kemudian, eksplan dipindahkan ke media induksi tunas (media MS yang dilengkapi dengan 1 mg l −1 zeatin, bersama dengan 0,8% (b/v) agar, 3% (b/v) sukrosa, 50 mg l −1 kanamisin, dan 500 mg l −1 sefotaksim). Inkubasi berlangsung pada suhu 26°C dengan periode foto 16 jam. Setelah 30 hari, planlet dipisahkan dari eksplan asli dan dipindahkan ke media induksi baru. Tunas yang mencapai panjang 2–3 cm dipotong dan dipindahkan ke media induksi akar (media MS yang mengandung 1 mg l −1 asam indol-3-asetat (IAA), 0,3% (b/v) agar, 3% (b/v) sukrosa, dan 50 mg l −1 kanamisin). Semua zat yang digunakan berasal dari Duchefa Biochemie (Haarlem, Belanda). Akhirnya, 20 galur diperoleh, yang lima galurnya (L2, L9, L15, L18, dan L20) diperiksa pascapanen, semuanya menunjukkan fenotipe pematangan tertunda yang jelas pada generasi T2. Keturunan beberapa galur, seperti L9 (generasi T3 dan T4), menunjukkan pengurangan keparahan fenotipe, yang mungkin disebabkan oleh pembungkaman transgen lintas generasi.
Galur GFP-SlATG8-2.2 Moneymaker dihasilkan dengan cara yang sama dengan beberapa perbedaan. Benih disemai pada media perkecambahan (4,3 g l −1 MS termasuk vitamin, 30 g l −1 sukrosa, 100 mg l −1 myo-inositol, 0,8% fitoagar, pH 5,8). Dua mikroliter suspensi Agrobacterium (10 mM MgSO 4 , 200 μM asetosiringon; OD 600 = 1,0) diaplikasikan per kotiledon, dan dikultur bersama pada media perkecambahan yang dilengkapi dengan 1 mg l −1 6-Benzylaminopurine dan 1 mg l −1 NAA selama 2 hari dalam gelap pada suhu 22°C. Dalam 2 hari, kotiledon ditempatkan permukaan abaksial ke bawah pada media perkecambahan yang dilengkapi dengan 35 mg l −1 kanamisin, 1 mg l −1 trans -Zeatin, dan 250 mg l −1 tikarsilin dinatrium/kalium klavulanat. Kotiledon ditempatkan dalam 14 jam : 10 jam, 23°C, terang : gelap, kelembaban 50%, dan dipindahkan ke media seleksi baru setiap 7 hari. Pada minggu kedua dan keempat, konsentrasi kanamisin ditingkatkan menjadi 50 dan 100 mg l −1 , masing-masing. Tunas regenerasi dipotong di pangkal dan dipindahkan ke media perkecambahan yang dilengkapi dengan 20 mg l −1 kanamisin, 0,1 mg l −1 IAA, dan vankomisin (500 mg l −1 ).
Konstruksi plasmid
Kami menggunakan ClonExpress II One Step Cloning (Vazyme Biotech, Jiangsu, Cina) dan sistem Gateway Cloning (Thermo Fisher Scientific, Waltham, MA, AS) untuk kloning terkait virus-induced gene silencing (VIGS). ‘Alat VIGS’ di situs web Sol Genomics Network ( vigs.solgenomics.net ) digunakan untuk memilih 300 urutan pasangan basa yang sesuai. Primer yang digunakan tercantum dalam Tabel Informasi Pendukung S1 . Fragmen sekitar 300-bp dari SlATG2 (Solyc01g108160) dan SlATG7 (Solyc11g068930) diamplifikasi PCR dan dikloning ke dalam pENTER-Gus (Thermo Fisher Scientific; dimodifikasi agar memiliki resistensi terhadap spektinomisin alih-alih kanamisin). Kemudian, reaksi Gateway LR dilakukan untuk memungkinkan transfer fragmen gen ke dalam vektor pTRV2-Del/Ros1. Untuk pembungkaman SlATG4 (Solyc01g006230) khusus pematangan , vektor E8:: SlATG4 -RNAi dihasilkan dengan mengganti promotor dalam kaset ekspresi 35S:: SlATG4 -RNAi (Alseekh et al ., 2022 ). Plasmid asli diperkuat (polimerase Phusion) sebagai fragmen linier tanpa bagian 35S. Kemudian, ClonExpress II digunakan untuk memperkenalkan promotor E8 yang diperkuat PCR dengan daerah pengapit yang kompatibel dari plasmid yang dilinearisasi. Semua plasmid klon ditransformasikan ke dalam sel kompeten Mix & Go DH5α (Zymo Research, Irvine, CA, AS) dan dipilih pada pelat agar Luria Broth (LB) yang berisi antibiotik yang relevan. PCR koloni mengonfirmasi klon positif, dan plasmid kemudian dimurnikan menggunakan kit pemurnian plasmid Promega.
Imunoblotting
Sampel kulit buah tomat beku nitrogen cair digiling secara manual hingga menjadi bubuk halus menggunakan lumpang dan alu. Satu gram sampel dicampur dengan 500 μl buffer Laemmli 1×. Campuran tersebut kemudian dipanaskan hingga 95°C selama 5 menit dan disentrifugasi pada 16.000 g (4°C) selama 10 menit. Supernatan yang dihasilkan dikumpulkan untuk imunoblotting. Untuk memungkinkan pemisahan fragmen ATG8 dan ATG8-PE, jumlah protein yang sama dimasukkan ke dalam gel SDS-PAGE 15% yang dibuat khusus yang dilengkapi dengan 6 M urea dalam gel pelarut. Gel diteteskan ke membran polivinilidena difluorida, yang diinkubasi semalam pada suhu 4°C dengan antibodi anti-ATG8 1 : 1000 (Abcam, Cambridge, Inggris) dan selanjutnya dengan goat-anti-rabbit-HRP (1 : 10 000; Jackson ImmunoResearch, West Grove, PA, AS) sebelum visualisasi dalam Sistem Pencitraan Fusion Plus (Vilber, Marne-la-Vallée, Prancis). Antibodi anti-H3 (EMD Millipore Corp., Burlington, MA, AS) digunakan untuk visualisasi pemuatan (1 : 10 000). Untuk uji pelepasan GFP, ekstrak protein total dimuat ke gel pracetak komersial (SurePage; GenScript, Piscataway, NJ, AS) dan diimunoblotting dengan antibodi anti-GFP (Ab290; 1 : 2000; Abcam). Sampel Arabidopsis diproses seperti yang dijelaskan sebelumnya (Michaeli et al ., 2019 ).
Isolasi RNA dan qRT-PCR
Total RNA diekstraksi dari 100 mg daun muda (tiga replikasi biologis) atau buah tomat stadium merah muda (tiga replikasi biologis, masing-masing terdiri dari tiga buah yang digabungkan) menggunakan kit isolasi RNA Plant Spectrum (Sigma). Konsentrasi dan kemurnian RNA ditentukan, dan cDNA disintesis dari 1 μg total RNA menggunakan kit sintesis cDNA verso (Thermo Fisher Scientific). Untuk reaksi berantai polimerase kuantitatif (qPCR), cDNA setiap sampel diencerkan 1 : 10 dengan air bebas nuklease sebelum dicampur dengan Luna ® Universal qRT-PCR Master Mix (New England Biolabs, Ipswich, MA, AS). Kemudian, sampel diproses menggunakan StepOnePlus Real-Time PCR System (Thermo Fisher Scientific). Metode C t komparatif (ΔΔ C t ) digunakan untuk analisis data, menormalkan ekspresi gen target dengan gen referensi (TIP41, GAPDH, dan Actin) dan membandingkan tingkat ekspresi relatif antara sampel.
Pembungkaman gen yang disebabkan oleh virus
pTRV1 dan pTRV2-Del/Ros1 yang mengandung fragmen turunan SlATG7 atau SlATG2 dimasukkan ke dalam strain Agrobacterium GV3101 menggunakan elektroporasi (Bio-Rad). Kultur sebanyak 5 ml ditumbuhkan semalam pada suhu 28°C dalam medium yang mengandung kanamisin. Keesokan harinya, kultur dipindahkan ke medium LB sebanyak 50 ml yang mengandung antibiotik, 10 mm 2-(N-morpholino)ethanesulfonic acid (MES), dan 20 μM acetosyringone dan ditumbuhkan semalam dalam shaker bersuhu 28°C. Sel Agrobacterium dipanen, disuspensikan kembali dalam medium infiltrasi (10 mm MgCl 2 , 10 mm MES, dan 200 μM acetosyringone), dibiarkan pada suhu ruangan selama 3 jam, dan disesuaikan dengan kerapatan optik (OD 600 ) sebesar 0,1. Sel Agrobacterium kemudian disusupkan, menggunakan jarum suntik 1 ml, melalui tangkai buah tahap hijau matang (MG) saat menempel pada tanaman.
Pencitraan fluoresensi dan kuantifikasi buah transgenik menggunakan sistem pencitraan in vivo
Buah tomat GFP-SlATG8-2.2 dipanen pada berbagai tahap pematangan (MG, pembuahan, dan matang merah (RR)) dan disimpan dalam gelap selama 12 jam sebelum evaluasi. Fluoresensi GFP (eksitasi 465 nm dan deteksi 520 nm) diperoleh dan dianalisis menggunakan sistem pencitraan in vivo (IVIS) Lumina II yang dilengkapi dengan lensa XFOV-24 dan perangkat lunak Living Image 4.3.1 (PerkinElmer, Waltham, MA, AS). Fluoresensi disajikan sebagai intensitas radiansi (foton s −1 cm −2 sr −1 ).
Mikroskopi konfokal, perawatan ConA, dan kuantifikasi
Pencitraan konfokal dilakukan menggunakan sistem mikroskopi pemindaian laser konfokal (CLSM) Leica SP8 (Leica Microsystems, Wetzlar, Jerman) di fasilitas inti mikroskopi Volcani Institute. Irisan tipis kulit buah tomat (menggunakan silet) atau bibit Arabidopsis utuh diposisikan di antara slide mikroskop dan penutup kaca yang berisi media cair ½MS. Parameter eksitasi/rentang deteksi untuk GFP adalah 488 nm/500–550 nm, dan emisi dikumpulkan menggunakan detektor hibrida (Hyd) sistem. Tujuan ×20 kering (NA 0,75) atau ×63 perendaman air (NA 1,3) digunakan. Pemindaian secara rutin dilakukan dalam mode ‘garis’. Gambar diproses dan dianalisis menggunakan Fiji ( Imag J ).
Untuk pengobatan concanamycin A (ConA) pada sel buah, irisan tipis buah diinkubasi dalam cairan ½MS yang ditambah dengan 2 atau 10 μM ConA, atau jumlah dimetil sulfoksida (DMSO) yang sesuai (tiruan), selama 7 jam sebelum pencitraan atau 15 jam untuk imunoblot. Untuk analisis Arabidopsis , benih GFP-ATG8E dikecambahkan dalam media cair ½MS (Duchefa Biochemie) yang mengandung 1% sukrosa. Bibit berumur empat hari dipindahkan ke dalam media yang sama yang mengandung 0,4% DMSO (Sigma-Aldrich; sebagai tiruan) atau 20 μM ACC atau 1 μM ConA (Santa Cruz Biotechnology, Dallas, TX, AS) dan 0,4% DMSO atau 1 μM ConA dan 20 μM ACC. Bibit diinkubasi selama 2 jam dalam gelap dan dipindahkan ke slide dalam media yang sesuai. Autophagosom berlabel dihitung secara manual dari gambar confocal-slice tunggal. Empat puluh lima bibit dan 677 sel dianalisis dalam tiga percobaan independen.
Uji respons rangkap tiga
Uji respons rangkap tiga dilakukan seperti yang dijelaskan sebelumnya (Merchante & Stepanova, 2017 ) dengan sedikit modifikasi. Benih yang telah disterilkan ditempatkan pada pelat yang berisi media ½MS (Duchefa Biochemie) dan 1% sukrosa, dengan atau tanpa 20 μM ACC. Pelat kemudian dipindahkan ke suhu 4°C dalam kegelapan selama 48 jam sebelum terpapar cahaya selama 2 jam. Kemudian, pelat dipindahkan ke ruang pertumbuhan (22°C) dan disimpan dalam kegelapan selama 72 jam.
Konstruksi pohon filogenetik
Urutan asam amino protein tomat dan Arabidopsis ATG8 diambil dari basis data Sol Genomics Network ( solgenomics.net ) dan TAIR ( www.arabidopsis.org ). Urutan diselaraskan menggunakan Cluster W di server web EMBL-EBI ( https://www.ebi.ac.uk/Tools/msa/clustalw2/ ) menggunakan pengaturan default. File yang dihasilkan diunggah ke IQ-Tree v.1.6 ( http://www.iqtree.org/ ) untuk analisis filogenetik, yang mencakup Model Finder , rekonstruksi pohon, dan bootstrap ultracepat dengan 1000 replikasi. Model Finder digunakan untuk menentukan model yang paling sesuai, dengan kriteria informasi Bayesian yang memandu pemilihan model, dan akhirnya memilih LG + G4. Model ini , yang menggabungkan distribusi gamma dengan empat kategori laju, digunakan untuk mengelola heterogenitas laju di antara lokasi. Nilai dukungan cabang dihitung menggunakan uji SH-aLRT dan perkiraan bootstrap ultracepat dengan 1000 replikasi. Akhirnya, pohon divisualisasikan dalam format Newick, menggunakan alat berbasis web Interactive Tree of Life ( i TOL) ( https://itol.embl.de/ ). Gambar pohon diekspor dan disempurnakan menggunakan Inkscape untuk meningkatkan kejelasan dan presentasi.
Pengukuran warna buah (hue) dan kekencangan
Nilai warna a * dan b * dan parameter rona diukur menggunakan Konica Minolta Chroma Meter CR-400 Series v.1.11 (Konica Minolta, Tokyo, Jepang). Buah dianggap berada pada tahap MG ketika −0,59 < a */ b * < −0,47 (Batu, 2004 ). Kemudian, buah dipanen, dibersihkan, dan diukur rona dan kekerasannya pada hari yang berbeda pascapanen, seperti yang ditunjukkan pada gambar terkait. Kekerasan diukur menggunakan TA.XT Plus Texture Analyzer (Stable Microsystems, Surrey, Inggris) menggunakan probe berdiameter 3 mm dengan penetrasi 5% pada kecepatan 1 mm s −1 , mencatat gaya titik akhir maksimal dalam Newton (N).
Pengukuran produksi etilen dan perlakuan 1-MCP
Buah yang dipanen ditempatkan dalam wadah tertutup 200 ml selama 2 jam. Etilen diukur dengan menyuntikkan 10 ml udara ruang kepala ke dalam kromatografi gas (GC; Varian 3300, Walnut Creek, CA, AS) dengan detektor ionisasi nyala dan kolom alumina. Untuk Arabidopsis , bibit dari berbagai genotipe ditanam pada media padat ½MS + 1% sukrosa. Perlakuan 1-Aminocyclopropane-1-karboksilat dan tiruan diterapkan pada bibit berumur 10 hari dengan menambahkan 20 μM ACC (dilarutkan dalam media ½MS cair) atau tiruan (media ½MS bebas ACC) ke dalam pelat. Setelah 96 jam inkubasi, bibit dikeluarkan, ditimbang, dan segera disegel dalam spuit 20 ml yang berisi media cair ½MS 1 ml, dengan atau tanpa ACC, selama 2 jam. Setiap spuit berisi 30 bibit. Ruang kepala kemudian dikumpulkan dengan spuit 10 ml baru (dengan menusukkan jarum ke spuit 20 ml) dan disuntikkan ke dalam peralatan GC. Untuk perlakuan 1-MCP, buah dari WT dan galur E8:: ATG4 -RNAi ditempatkan dalam labu tertutup berisi 600 ppb 1-MCP (RIMI, Petah Tikva, Israel) selama 20 jam. Kemudian, buah dilepaskan dan ditempatkan dalam ruang ‘masa simpan’ (22°C) selama durasi yang ditunjukkan untuk pengukuran rona.
Pengukuran penuaan daun akibat gelap dan kebocoran elektrolit
Daun ketiga dari meristem apikal galur E8:: ATG4 -RNAi berumur 5 minggu (L9, L15, dan L18) dan tanaman WT dilepaskan. Daun kemudian dicuci dan disimpan dalam cawan Petri dengan kertas Whatman yang basah. Cawan Petri kemudian dibungkus dengan aluminium foil, diinkubasi dalam ruang pertumbuhan, dan difoto pada hari ke-5, ke-7, ke-9, ke-12, dan ke-14. Setiap percobaan mencakup empat ulangan. Daun yang sama digunakan untuk pengukuran kebocoran elektrolit. Dari setiap daun, cakram daun berdiameter 1,2 cm diinkubasi dalam 10 ml air deionisasi dalam gelap dengan pengukuran larutan dilakukan pada hari ke-0, ke-3, ke-6, ke-7, ke-10, ke-11, ke-13, ke-17, ke-19, dan ke-21 menggunakan pengukur konduktivitas. Percobaan diulang empat kali.
Statistik
Analisis statistik dan visualisasi data dilakukan menggunakan Python 3.9.6 dengan pustaka berikut:
- NumPy 1.25.2 untuk operasi numerik dan penanganan data;
- Pandas 2.0.3 untuk impor data dan penanganan bingkai data;
- Matplotlib 3.7.2 untuk pembuatan plot dasar; dan
- Seaborn 0.12.2 untuk visualisasi data tingkat lanjut.
Perhitungan dilakukan menggunakan subpaket scipy.stats dari pustaka berbasis Python SciPython sumber terbuka . Uji Shapiro –Wilk ( scipy.stats.shapiro – SciPy v.1.11.2 ) digunakan untuk penentuan kenormalan, di mana nilai -P > 0,05 menunjukkan bahwa data terdistribusi normal. Uji Levene ( scipy.stats.levene ) digunakan untuk penentuan varians yang sama, di mana nilai- P > 0,05 menunjukkan varians yang sama. Jika dua set data menunjukkan varians yang sama dan distribusi normal, maka uji -t dua sampel independen ( scipy.stats.ttest_ind ) digunakan. Jika tidak, uji Mann–Whitney U nonparametrik ( scipy.stats.mannwhitneyu ) digunakan.
Hasil
Aktivitas autofagi mencapai klimaks di pertengahan pematangan
Untuk menguraikan peran autofagi dalam pematangan buah tomat, pertama-tama kami mengikuti aktivitasnya dengan memantau dinamika SlATG8 (Qi et al ., 2023 ). Ada tujuh ortolog protein tomat dari Arabidopsis AtATG8 yang dikelompokkan menjadi empat subkelompok (Gbr. 1a ; Kellner et al ., 2017 ; Zess et al ., 2019 ). Data dari Sol Genomics Network – Tomato Expression Atlas (SGN-TEA; tea.solgenomics.net ; Shinozaki et al ., 2018 ) mengungkapkan bahwa lima dari tujuh anggota menunjukkan peningkatan ekspresi sepanjang perkembangan pematangan. Dua di antaranya, SlATG8-1.1 (Solyc08g078820) dan SlATG8-2.2 (Solyc07g064680), menunjukkan kelimpahan transkrip yang relatif lebih tinggi (Gbr. 1b ). Bahasa Indonesia: Untuk memverifikasi bahwa SlATG8-2.2 , sebagai representatif, mengodekan protein terkait autofagi dalam sel buah, kami membuat tanaman tomat transgenik yang mengekspresikan GFP-SlATG8-2.2. CLSM sel endokarp buah pada tahap pemutus menyoroti benda bulat kecil (diameter 1–2 μm) yang mengingatkan pada autophagosom (Gbr. 1c , gambar C1–C3). Struktur ini motil (Video S1 ) dan kadang-kadang tampak seperti struktur seperti cincin. Yang ditunjukkan di sini adalah fagofor yang mungkin matang pada tahap lanjut sebelum penutupan (Gbr. 1c , gambar C4, tepi ditentukan oleh kepala panah), kemudian muncul sebagai autophagosom yang tertutup sepenuhnya dan lengkap (Gbr. 1c , gambar C5).
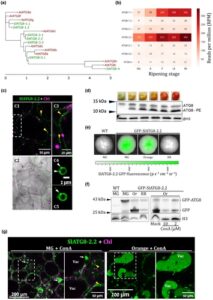
Bahasa Indonesia: Untuk mendapatkan wawasan ke dalam aktivitas autofagi, kami melakukan imunoblotting pada ekstrak protein perikarp total buah tomat pada berbagai tahap pematangan dengan antibodi anti-ATG8. Kami menduga antibodi poliklonal ini mengenali semua isoform ATG8 yang diekspresikan. Analisis kami menunjukkan peningkatan tajam pada tingkat ATG8-PE, dari tingkat yang tidak terdeteksi pada tahap MG ke ekspresi menonjol pada pertengahan pematangan, dan mempertahankan tingkat tinggi ini hingga tahap RR akhir (Gbr. 1d ). Peningkatan ATG8-PE dapat mencerminkan peningkatan aktivitas autofagi atau penyumbatan fluks autofagi ke vakuola. Untuk menentukan mana dari pilihan ini yang faktual, buah yang mengekspresikan GFP-SlATG8-2.2 dievaluasi untuk mengikuti fluks autofagi. Menggunakan IVIS (Perkin Elmer), kami mendeteksi fluoresensi GFP yang cukup pada buah dari tahap MG hingga oranye. Namun, sinyal tersebut tidak terdeteksi pada buah RR mana pun yang diperiksa ( n = 22; Gbr. 1e ). Kami kemudian menggunakan uji pelepasan GFP, yang memungkinkan penilaian fluks autofagi dari sitoplasma ke vakuola menurut rasio produk degradasi GFP bebas relatif terhadap protein fusi GFP-ATG8 dengan panjang penuh. Imunoblotting ekstrak protein buah dari tiga tahap pematangan, MG, oranye, dan RR, dengan antibodi anti-GFP mengungkapkan peningkatan tajam dalam tingkat GFP bebas (yaitu peningkatan fluks) dari tahap MG ke tahap oranye (Gbr. 1f ). Konsisten dengan analisis IVIS kami (Gbr. 1e ), tingkat deteksi GFP pada tahap RR secara signifikan lebih rendah daripada pada tahap sebelumnya. Meskipun demikian, cukup untuk mengamati pergeseran kembali ke tingkat seimbang GFP-ATG8-2.2 dan GFP bebas, yang menunjukkan pengurangan fluks autofagi (Gbr. 1f ; sampel RR). Kami kemudian memeriksa dampak ConA, obat yang menghambat degradasi vakuolar (Qi et al ., 2023 ). Bahasa Indonesia: Ketika diaplikasikan pada tahap oranye, konsentrasi ConA yang ringan (2 μM) dan tinggi (10 μM) mengurangi tingkat produk degradasi GFP bebas (Gbr. 1f , bercak kanan), yang menunjukkan bahwa sebagian besarnya diproduksi melalui degradasi vakuola. ConA selanjutnya memungkinkan visualisasi protein fluoresen dalam lumen vakuola. Pencitraan CLSM dari vakuola tahap oranye setelah perlakuan ConA menunjukkan struktur titik yang sesuai dengan badan autofagik (Gbr. 1g ), yang menunjukkan gerakan acak yang khas dalam lumen vakuola (Video S2 ). Khususnya, tidak ada badan autofagik seperti itu yang terdeteksi dalam salah satu vakuola tahap MG setelah analisis > 50 sel dalam 10 buah yang berbeda (Gbr. 1g ). Ini menunjukkan fluks autofagi terjadi di pertengahan pematangan, sedangkan itu diblokir pada tahap MG. Secara keseluruhan, peningkatan kadar ATG8-PE selama pematangan menghasilkan peningkatan aktivitas autofagi, yang mencapai puncaknya pada tahap pertengahan (oranye).
Defisiensi autophagy mempercepat pematangan buah dan menghasilkan peningkatan produksi etilen pada buah tomat dan bibit Arabidopsis
Autofagi terlibat dalam banyak proses, termasuk homeostasis energi dan remobilisasi nutrisi (Avin-Wittenberg et al ., 2015 ; Li et al ., 2015 ; Masclaux-Daubresse et al ., 2017 ). Oleh karena itu, knockout atau knockdown konstitutif dari setiap gen ATG kunci akan menghasilkan efek pleiotropik, mencegah pemahaman peran spesifik pematangan. Untuk mengatasi hal ini, kami menerapkan dua pendekatan. Pertama, kami menggunakan VIGS langsung pada buah tomat tahap MG Del/Ros1 , yang mengandung transgen Snapdragon Delila ( DEL ) dan Rosea 1 ( ROS1 ) yang digerakkan oleh promotor yang diinduksi pematangan E8. Oleh karena itu, membungkam Del/Ros1 , yang mencegah munculnya buah ungu yang terkait dengan pematangan (Orzaez et al ., 2009 ), merupakan indikator visual untuk pembungkaman (Gbr. 2a ; buah D/R vs NT). Pembungkaman gen autofagi inti, SlATG2 atau SlATG7 , masing-masing dengan DEL/ROS1 ( D/R/ATG2 -VIGS atau D/R/ATG7 -VIGS, berturut-turut), mengakibatkan akumulasi SlATG8, mungkin karena pergantiannya yang menurun (Gbr. S1a ). Ini konsisten dengan akumulasi AtATG8 pada mutan Arabidopsis atg2 dan atg7 (Munch et al ., 2014 ; Kang et al ., 2018 ; Luo et al ., 2023 ). Secara fenotip, pembungkaman SlATG2 mengakibatkan transisi warna yang dipercepat (Gbr. 2a ). Pemeriksaan kuantitatif transisi hijau-ke-merah pada populasi buah, yang diwujudkan dengan nilai sudut rona yang menurun, menunjukkan transisi warna yang dipercepat dari buah yang dibungkam ATG2 (D/R/ATG2-VIGS) relatif terhadap buah referensi (D/R-VIGS; Gbr. 2b ). Hasil serupa terungkap setelah SlATG7 (D/R/ATG7-VIGS) dibungkam, meskipun dengan perbedaan yang diamati pada titik waktu sebelumnya (Gbr. S1b ). Selain itu, buah D/R/ATG2 -VIGS menunjukkan pelunakan buah yang lebih cepat seperti yang ditunjukkan oleh pengukuran kekencangan (Gbr. 2c ).
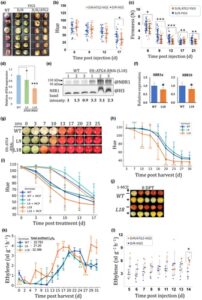
Untuk pendekatan kedua, kami menargetkan SlATG4 . Mirip dengan sebagian besar anggota ATG8 , ekspresinya juga meningkat seiring perkembangan pematangan, yang menunjukkan bahwa keduanya mungkin disinkronkan untuk memungkinkan lipidasi atau delipidasi protein ATG8 yang tepat (Gbr. S2 ). Untuk pembungkaman khusus pematangan, kami menghasilkan galur transgenik yang mengandung konstruksi ATG4 -RNAi yang dikonfirmasi sebelumnya (Alseekh et al ., 2022 ), meskipun di bawah regulasi promotor yang diinduksi pematangan (E8:: SlATG4-RNAi ). Kami fokus pada galur no. 18 (L18), yang menunjukkan pembungkaman signifikan, dan L9, yang terungkap sebagai galur yang relatif lemah (Gbr. 2d ). Karena ATG4 dapat bekerja dalam lipidasi dan delipidasi ATG8 (Zou et al ., 2025 ), kami beralasan bahwa penilaian aktivitas autofagi melalui kadar ATG8-PE tidak akan cocok di sini. Oleh karena itu, kami beralih untuk memeriksa kadar tetangga BRCA 1 (NBR1), reseptor kargo autofagi selektif yang diketahui terakumulasi dalam defisiensi autofagi (Gbr. S3a ) dan untuk mencerminkan status fluks autofagi (Bassham, 2015 ; Yoshii & Mizushima, 2017 ; Zhao et al ., 2022 ). Ada dua gen NBR1 yang diprediksi dalam tomat: SlNBR1a dan SlNBR1b (Zhou et al ., 2014 ). Pembungkaman ATG4 konstitutif (dalam tanaman 35S:: ATG4 -RNAi (Alseekh et al ., 2022 )) menghasilkan akumulasi SlNBR1a yang nyata (Gbr. S3b ).
Secara konsisten, SlNBR1a terakumulasi dalam buah tahap merah muda E8:: ATG4 -RNAi L18 relatif terhadap buah tahap merah muda WT (Gbr. 2e ), tanpa peningkatan bersamaan dalam kadar transkrip SlNBR1a maupun SlNBR1b (Gbr. 2f ), yang menunjukkan berkurangnya kerusakan autofagi pada buah L18. Buah dari galur WT dan galur transgenik dipanen pada tahap MG dan dipantau pascapanen untuk mengetahui transisi warna (Gbr. 2g ). Rata-rata, buah L18 memulai pematangan lebih awal dan mencapai kematangan penuh 7 hari sebelum buah WT dan L9 (Gbr. 2h ). Khususnya, pematangan yang dipercepat juga diamati pada buah yang tidak terlepas dari galur E8:: SlATG4-RNAi L15 dan L18 (Gbr. S4 ). Secara keseluruhan, hasil ini menunjukkan bahwa autofagi terlibat dalam pembatasan pematangan.
Sebelumnya, pembungkaman konstitutif SlATG4 (35S:: ATG4 -RNAi) dilaporkan mengakibatkan penuaan dini daun tomat (Alseekh et al ., 2022 ), fenotipe kanonik defisiensi autofagi, yang berpotensi memengaruhi perkembangan dan pematangan buah. Untuk memverifikasi bahwa fenotipe garis konteks pematangan (E8:: ATG4 -RNAi) kami terbatas pada buah, kami memantau secara visual daun dari L9, L15, dan L18, serta pengukuran kebocoran elektrolitnya. Pengujian ini tidak menunjukkan perbedaan signifikan dalam penuaan daun dari garis pembungkaman relatif terhadap daun WT (Gbr. S5a–c ). Untuk menilai aktivitas promotor E8 yang bergantung pada jaringan, kami mengukur ekspresi fragmen ATG4 yang diklon (Gbr. S5d ) pada buah dan daun tahap merah muda dari tanaman WT dan L18. Hal ini menunjukkan bahwa ekspresinya pada buah L18, rata-rata, hampir 10 kali lipat dari ekspresi pada buah WT (yang terakhir mewakili ekspresi gen ATG4 WT asli ). Sebaliknya, tidak ada perbedaan signifikan dalam ekspresi ATG4 pada daun genotipe ini (Gbr. S5e ). Data ini menunjukkan bahwa aktivitas promotor E8, yang mendorong pembungkaman ATG4 , memang terbatas pada buah.
Untuk memeriksa apakah dampak autofagi pada pematangan terkait dengan etilen, kami memperlakukan buah WT, L18, dan L9 dengan antagonis etilen, 1-MCP, sebelum pengukuran rona dilakukan untuk menilai transisi warna. Buah dipanen pada tahap warna yang relatif maju (nilai rona c . 105) untuk meminimalkan celah inisiasi pematangan. 1-Metilsiklopropena menghapuskan keuntungan pematangan L18, yang menunjukkan dinamika pematangan tertunda yang serupa dengan buah WT (Gbr. 2i,j ), yang menunjukkan bahwa autofagi dapat mengatur pematangan melalui interaksi dengan etilen. Pemeriksaan emisi etilen menunjukkan permulaan fase klimakterik lebih awal dan produksi etilen lebih tinggi pada L18 daripada pada buah WT dan L9. Rata-rata, L18 memulai produksi etilen 7 hari sebelum WT dan 3 hari sebelum buah L9. Namun, perbedaan pada 7–13 hari pasca panen ditemukan tidak signifikan secara statistik (menggunakan uji Mann–Whitney U ) karena varians tinggi yang biasanya ditemukan dalam populasi buah di sekitar waktu inisiasi pematangan. Khususnya, buah L18 mencapai klimaks produksi etilen 5 hari sebelum WT dan 3 hari sebelum L9 (Gbr. 2k ). Selain itu, buah L18 tahap merah muda tidak menunjukkan perubahan signifikan dalam ekspresi ACC-Oxidase 1 tomat , ACC-Oxidase 4 , ACC-Synthase 2 , ACC-Synthase 4 , Polygalacturonase , atau Expansin 1 relatif terhadap kadarnya dalam buah tahap merah muda WT (Gbr. S6 ). Gen-gen ini terlibat dalam produksi etilen klimakterik dan pelunakan buah (Li et al ., 2021 ), yang menunjukkan bahwa regulasi pematangan oleh autofagi tidak berada pada tingkat transkripsi. Kami lebih lanjut memeriksa emisi etilen dari buah Del/Ros1/ATG2- VIGS dibandingkan dengan referensi Del/Ros1- VIGS. Eksperimen menunjukkan peningkatan produksi etilen pada buah yang dibungkam ATG2 sepanjang eksperimen, meskipun secara signifikan lebih tinggi pada 14 hari pasca injeksi (Gbr. 2l ). Eksperimen serupa yang menguji ATG7 -VIGS mengungkapkan hasil yang serupa, dengan emisi etilen yang meningkat secara signifikan pada 7 dan 8 hari pasca injeksi (Gbr. S1c ). Hasil ini, bersama dengan data perlakuan 1-MCP, menunjukkan autofagi memengaruhi pematangan melalui dampaknya pada produksi etilen. Meskipun demikian, saat ini kami tidak dapat mengesampingkan kemungkinan keterlibatan hormon tambahan yang diketahui berinteraksi dengan etilen dan memengaruhi pematangan, seperti asam absisat dan auksin (Fenn & Giovannoni, 2021 ).
Bahasa Indonesia: Untuk mendapatkan wawasan lebih jauh ke dalam hubungan autofagi-pematangan dan autofagi-etilena, kami memeriksa aktivitasnya dalam buah mutan pematangan, never-ripe ( nr ) dan colorless nonripening ( cnr ). NR mengkode reseptor etilena (Tieman et al ., 2000 ), sementara CNR mengkode faktor transkripsi seperti protein pengikat promotor SQUAMOSA (Wang et al ., 2020 ). Pada WT, SlNBR1a dideteksi pada tahap MG dan turn (masing-masing 40 dan 47 hari pasca antesis (DPA)) dan berkurang secara signifikan pada RR (54 DPA), yang berpotensi mencerminkan peningkatan fluks NBR1 menjelang akhir proses pematangan. Khususnya, kadar SlNBR1a secara signifikan lebih tinggi pada nr daripada pada buah WT pada ketiga tahap yang diperiksa. Sebaliknya, SlNBR1a tidak terdeteksi pada semua buah cnr yang diperiksa (Gbr. S7a ). PCR kuantitatif tidak menunjukkan perbedaan signifikan dalam transkrip SlNBR1a di nr relatif terhadap buah WT, yang menunjukkan aktivitas autofagi yang menurun pada buah nr (Gbr. S7b ). Namun, kami memperkirakan bahwa pengurangan c . 20% dalam ekspresi NBR1a pada buah cnr (Gbr. S7b ) tidak sepenuhnya menjelaskan kurangnya deteksi protein SlNBR1, yang menunjukkan fluks autofagi yang kuat pada buah cnr . Meskipun saat ini kami tidak dapat memberikan penjelasan yang jelas, kami mencatat bahwa cnr , yang terganggu dalam produksi etilen, tampaknya menunjukkan aktivitas hiperautofagik, sedangkan nr , yang terganggu di hilir produksi etilen, menunjukkan kebalikannya. Dengan kata lain, korelasi negatif antara produksi etilen dan aktivitas autofagi sekali lagi tampak pada mutan pematangan buah ini.
Bahasa Indonesia: Untuk melihat apakah autofagi memengaruhi etilen di luar pematangan, kami memeriksa bibit knockout Arabidopsis atg2-1 di bawah uji respons rangkap tiga, uji yang dikenal untuk mendeteksi mutan yang sensitif terhadap etilen atau tidak sensitif terhadap etilen (Merchante & Stepanova, 2017 ). Secara keseluruhan, mutan atg2 tidak menunjukkan perubahan pertumbuhan akar relatif terhadap bibit Col-0 dalam gelap. Namun, perbedaannya signifikan setelah aplikasi ACC (Gbr. 3a,b ). Pemeriksaan serupa terhadap mutan autofagi-defisien atg5-1 dan atg7-2 dan ebf2-3 sebagai mutan hipersensitif etilen yang diketahui (Potuschak et al ., 2003 ) mengungkapkan hasil yang serupa, kecuali untuk bibit atg5 yang menunjukkan akar yang lebih pendek bahkan di bawah perlakuan gelap (Gbr. S8a,b ). Khususnya, bibit atg2 , atg5 , dan atg7 menunjukkan peningkatan emisi etilen antara 1,75 dan tiga kali lipat relatif terhadap Col-0 setelah perlakuan ACC, sementara atg2 dan atg7 menghasilkan etilen yang jauh lebih banyak bahkan di bawah perlakuan tiruan (Gbr. 3c , S8c ). Hasil-hasil ini menunjukkan bahwa fenotipe akar mutan atg setelah aplikasi ACC mungkin disebabkan oleh peningkatan produksi etilen, yang menyoroti peran umum autofagi dalam represi etilen.
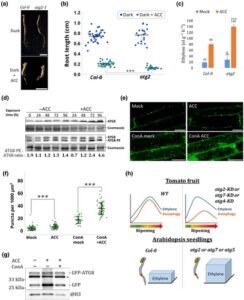
ACC menginduksi aktivitas autophagy
Telah dilaporkan sebelumnya bahwa ACC menginduksi autofagi berdasarkan jumlah fokus GFP-ATG8a (tanpa ConA), uji pelepasan GFP, dan ekspresi reseptor kargo autofagi selektif, NBR1 (Rodriguez et al ., 2020 ). Mempertimbangkan pengamatan kami, kami ingin menegaskan hal ini dengan pendekatan yang saling melengkapi. Pertama, kami menguji kadar ATG8 pada bibit Arabidopsis Col-0 yang mengalami ACC atau tiruan. Hasil penelitian menunjukkan bahwa kadar total ATG8 (Gbr. 3d , blot atas) dan ATG8-PE (Gbr. 3d , blot bawah) lebih tinggi pada bibit yang diobati dengan ACC pada 72 dan 96 jam pasca pengobatan. Kemudian, kami memantau GFP-ATG8e pada akar Arabidopsis yang mengalami kombinasi ACC, ConA, atau tiruan (Gbr. 3e ). Kuantifikasi mengungkapkan peningkatan jumlah puncta apakah ACC diaplikasikan sendiri atau dikombinasikan dengan ConA, menunjukkan bahwa ACC meningkatkan produksi autofagosom dan fluksnya ke vakuola (Gbr. 3f ). Pemeriksaan GFP-ATG8e menggunakan uji pelepasan GFP mendukung hasil mikroskopi, menunjukkan peningkatan fluks setelah 72 jam pengobatan ACC, yang berkurang dengan penambahan ConA (Gbr. 3g ). Untuk memeriksa apakah ACC mencerminkan fungsi etilen daripada fungsi spesifik ACC, kami selanjutnya menilai fluks GFP-ATG8e setelah aplikasi etilen. Etilen (2 ppm) menginduksi fluks autofagi, namun pada titik waktu yang lebih awal (48 jam) daripada 20 μM ACC dan cukup sementara (Gbr. S9a ). Kami berspekulasi bahwa perbedaan waktu dalam mencapai fluks autofagi antara ACC dan etilen mungkin terkait dengan konsentrasi yang diterapkan. Memang, ketika 2 μM ACC diaplikasikan (bukan 20 μM pada Gambar 3g ), fluks yang lebih awal pada 48 jam terlihat jelas (Gambar S9b ). Bersama dengan laporan oleh Rodriguez et al . ( 2020 ), hasil ini mengonfirmasi kemampuan ACC dan etilen untuk menginduksi autophagy.
Diskusi
Telah diterima secara umum bahwa terdapat kemiripan fisiologis dan molekuler antara pematangan dan penuaan, seperti yang terlihat pada buah-buahan kering seperti Arabidopsis siliques (Seymour et al ., 2013 ; Gómez et al ., 2014 ). Memang, analisis data skala besar menunjukkan bahwa tiga jenis sirkuit transkripsi yang mengendalikan pematangan yang bergantung pada etilen telah berevolusi dari jalur penuaan atau identitas organ bunga (Lü et al ., 2018 ). Autofagi adalah mekanisme antipenuaan dan antipenuaan pada tumbuhan dan hewan (Liu & Bassham, 2012 ; Minina et al ., 2018 ; Aman et al ., 2021 ), yang berdamai dengan efek represif pada pematangan. Kami mengusulkan bahwa penumpukan kapasitas autofagi yang lebih ringan pada buah-buahan yang dibungkam SlATG memungkinkan produksi etilen yang lebih awal dan lebih tinggi, yang mengarah pada pematangan yang dipercepat (Gbr. 3h , panel atas). Menariknya, partisipasi autofagi dalam pematangan buah nonklimakterik pada cabai dan stroberi baru-baru ini dilaporkan (López-Vidal et al ., 2020 ; Sánchez-Sevilla et al ., 2021 ). Bertentangan dengan hasil kami, disimpulkan bahwa autofagi berperan dalam mendorong pematangan stroberi. Jika demikian, kami tidak dapat mengesampingkan kemungkinan autofagi memiliki peran yang bertentangan pada buah klimakterik dan nonklimakterik. Kemungkinan yang menarik adalah bahwa hal ini mencerminkan dampak etilen yang berbeda pada kedua jenis buah (Perotti et al ., 2023 ). Meningkatnya sensitivitas Arabidopsis atg5 , atg2 , dan atg7 terhadap ACC, ditambah dengan peningkatan produksi etilennya (Gbr. 3a–c , S8 ), menunjukkan bahwa efek represif autofagi berpotensi meluas dan dapat meluas ke peran etilen lainnya di luar pematangan, misalnya selama pemanjangan akar (Gbr. 3h , panel bawah). Namun, kami mencatat bahwa pematangan buah dan pemanjangan akar adalah proses independen di mana mekanisme molekuler yang identik tidak selalu diharapkan untuk menunjukkan fungsi yang serupa. Oleh karena itu, fakta bahwa autofagi membatasi keduanya tidak menunjukkan bahwa keduanya terkait tetapi lebih pada hasil dampak represif autofagi pada etilen di kedua sistem. Meskipun tingkat transkrip gen yang terlibat dalam produksi etilen dilaporkan meningkat pada mutan Arabidopsis atg5 dan atg9 (Masclaux-Daubresse et al ., 2014), kami belum mendeteksi tren serupa pada buah ATG4 -RNAi L18 kami (Gbr. S6 ), yang berpotensi menyoroti perbedaan cara regulasi antara kedua sistem.
Karena mungkin sulit untuk menafsirkan penumpukan autofagi sebagai mekanisme represif saat pematangan sedang berlangsung, kami ingin mengklarifikasi poin ini. Mari kita asumsikan bahwa perkembangan pematangan ditentukan oleh jumlah mekanisme yang mempromosikan dan menekannya, dengan kecepatan ditentukan oleh efek kumulatifnya. Dengan kata lain, proses yang sangat diatur seperti itu akan memerlukan jeda fungsional dari inisiasinya untuk mengendalikan permulaan proses dan kinerja penuhnya dengan kecepatan penuh (dalam kasus kami, pada tahap pergantian) untuk mencegah hilangnya kendali (yaitu untuk memediasi transisi dari produksi etilen klimakterik ke pascaklimakterik). Dengan cara yang sama, aktivitas autofagi meningkat seiring dengan perkembangan penuaan daun, meskipun menunda penuaan, seperti yang terlihat jelas pada berbagai mutan atg (Yoshimoto et al ., 2009 ). Meskipun demikian, belum sepenuhnya dipahami bagaimana pematangan dimulai. Perubahan pada penanda histon dan metilasi DNA tampaknya diperlukan dan dikaitkan dengan aktivasi gen pematangan (Lü et al ., 2018 ; Li et al ., 2021 ). Di sini, kami mengusulkan autofagi sebagai lapisan regulasi tambahan.
Beberapa pertanyaan muncul dari studi ini. Pertama, bagaimana autofagi membatasi etilen? Ini dapat terjadi melalui degradasi selektif komponen produksi etilen atau ACC, seperti enzim ACC-Synthase atau ACC-Oxidase (Houben & Van de Poel, 2019 ; Park et al ., 2021 ). Eliminasi prekursor yang lebih jauh ke hulu atau elemen pengatur produksi etilen lainnya adalah kemungkinan lain. Akhirnya, tidak dapat dikesampingkan bahwa autofagi juga dapat mengatur komponen pensinyalan etilen (Binder, 2020 ). Khususnya, kemampuan ACC untuk menginduksi autofagi menyoroti potensi umpan balik untuk regulasi etilen. Tidak seperti etilen, kadar ACC dilaporkan terus meningkat seiring dengan pematangan (Van de Poel et al ., 2012 ). Pertanyaan tambahannya adalah sebagai berikut, berapakah berat etilen dalam fenotipe penuaan dini mutan autofagi yang terkenal? Terutama karena, sejauh ini, sebagian besar dikaitkan dengan asam salisilat (Yoshimoto et al ., 2009 ). Terakhir, apakah autofagi mengatur pematangan hanya melalui dampaknya pada etilena? Meskipun hubungan silang autofagi-etilena tampak signifikan untuk perkembangan pematangan, masuk akal untuk berasumsi bahwa beberapa komponen, seperti kompleks protein dan organel, yang tidak selalu terkait dengan etilena, akan didaur ulang melalui autofagi selektif selama pematangan (Clavel & Dagdas, 2021 ; Eckardt et al ., 2024 ). Penelitian lebih lanjut diperlukan untuk menjawab pertanyaan-pertanyaan ini.




Tinggalkan Balasan