Abstrak
Latar belakang
Kandungan fruktan dan fluks pada hijauan beriklim sedang dapat bermanfaat bagi rumput melalui peningkatan ketahanan terhadap dingin, peningkatan toleransi terhadap kekeringan, dan peningkatan kualitas hijauan. Orchardgrass ( Dactylis glomerata L., atau cocksfoot) menghasilkan fruktan tipe levan yang relatif panjang dan tidak bercabang, tetapi gen yang terlibat dalam biosintesisnya belum diketahui.
Metode
Melalui evaluasi lima kultivar rumput kebun dan galur pemuliaan yang berbeda dalam ketahanan dingin dan toleransi beku, kami menguji akumulasi fruktan dan monosakarida setelah aklimatisasi dingin. Anggota famili gen glikosida hidrolase-32 ( GH32 ) yang terlibat dalam biosintesis fruktan diidentifikasi dan dikelompokkan dengan gen homolog dari Triticum aestivum dan Lolium perenne .
Hasil
Pada masing-masing dari empat keluarga gen GH32 , terdapat gen-gen tertentu dengan kadar transkrip tinggi dan tidak ada delesi pada motif GH32 . Kandidat untuk sukrosa:fruktan 6-fructosyltransferase ( 6-SFT ) menunjukkan kadar transkrip tertinggi dari semua gen GH32 dalam penelitian ini dan diinduksi setelah aklimatisasi dingin. Sebaliknya, tiga gen invertase dan dua gen fruktan eksohidrolase, yang berperan dalam hidrolisis sukrosa dan fruktan, memiliki kadar transkrip yang berkurang setelah aklimatisasi dingin.
Kesimpulan
Data ini memberikan peran dugaan gen GH32 pada rumput kebun, dan menunjukkan bahwa gen 6-SFT , invertase vakuolar ( VI ), dan eksohidrolase fruktan ( FEH ) berperan dalam biosintesis dan metabolisme fruktan untuk aklimatisasi dingin pada rumput kebun.
PERKENALAN
Hingga 15% tanaman berbunga menggunakan fruktan sebagai karbohidrat untuk menyimpan energi dan membentuk kerangka karbon (Hendry, 1993 ). Pada tanaman ini, fruktan terutama disimpan dalam vakuola (Lasseur et al., 2011 ), dan terakumulasi terutama dalam pelepah daun yang memanjang, pangkal daun, dan mahkota (Pavis et al., 2001 ). Fruktan adalah pelindung terhadap berbagai stres abiotik (Valluru & Van den Ende, 2008 ) dan terlibat dalam metabolisme dinding sel (Lammens et al., 2009 ). Pengerasan dingin pada rumput beriklim sedang disertai dengan peningkatan ekspresi transkrip gen biosintesis dan katabolisme fruktan (Kawakami & Yoshida, 2002 ), peningkatan aktivitas enzim (Hisano et al., 2008 ), dan peningkatan kandungan fruktan (Livingston et al., 2009 ). Memang, Lolium perenne L. yang ditransformasi dengan gen biosintesis fruktan Triticum aestivum L. memiliki kandungan fruktan dan toleransi beku yang meningkat (Hisano et al., 2004 ). Fruktan dalam rumput hijauan diinduksi oleh sukrosa, cahaya, kekeringan, dan suhu dingin (Gallagher et al., 2007 ; Maleux & Van den Ende, 2007 ), dan regulasi transkripsi gen biosintesis fruktan terkait dengan kadar fruktan (Hisano et al., 2008 ).
Enzim yang bertanggung jawab untuk mengkatalisis biosintesis dan degradasi fruktan berada dalam keluarga glikosida hidrolase 32 ( GH32 ) (Lammens et al., 2009 ). Pada tumbuhan, enzim GH32 meliputi invertase, fruktosiltransferase, dan eksohidrolase fruktan ( FEH ). Invertase adalah sekelompok β -fruktofuranosidase yang dapat dikategorikan sebagai tipe dinding sel ( CWI ) dan vakuolar ( VI ) (De Coninck et al., 2005 ); dan terutama menghidrolisis sukrosa dan sakarida dengan tingkat polimerisasi (DP) rendah (Le Roy et al., 2007 ). Ada beberapa motif asam amino yang dilestarikan untuk pengikatan dan katalisis gen-gen yang mengkode GH32 : WMNDPNG, WSGSAT, RDP, dan motif-motif ED (Lammens et al., 2009 ; Lasseur et al., 2011 ). WMNDPNG, atau kotak pengikat sukrosa, dilestarikan dalam gen-gen invertase dan FEH tetapi dapat bervariasi dalam gen-gen fruktosiltransferase (Ritsema et al., 2005 ). Residu-residu asam pada keempat motif tersebut sangat penting untuk pengikatan dan katalisis karbohidrat (Lammens et al., 2009 ), dan mutasi-mutasi asam amino tunggal dapat mengubah aktivitas dan kinetika enzim-enzim GH32 (Le Roy et al., 2007 ; Ritsema et al., 2006 ; Schroeven et al., 2008 ).
Langkah pertama dalam proses biosintesis fruktan DP panjang adalah konversi sukrosa menjadi 1-kestotriosa atau 1-kestosa (Chalmers et al., 2003 ), yang dikatalisis oleh sukrosa:sukrosa 1-fruktosiltransferase ( 1-SST ; EC2.4.1.99). Selanjutnya, pemanjangan polimer melalui penambahan molekul fruktosa dikatalisis oleh fruktan:fruktan 1-fruktosiltransferase tipe-F ( 1-FFT ; EC 2.4.1.100) yang menghasilkan ikatan β -2,1, sukrosa:fruktan 6-fruktosiltransferase tipe-S ( 6-SFT ; EC 3.2.1.26) yang menghasilkan ikatan β -2,6 (Lasseur et al., 2011 ), atau fruktosiltransferase tipe-F lainnya (misalnya, 6G-FFT ) yang berkontribusi pada fruktan neoseri (Hisano et al., 2008 ; Lasseur et al., 2009 ; Ritsema et al., 2005 ). Gen yang mengkode fruktosiltransferase paling homolog dengan, dan berevolusi dari, gen VI hanya dengan beberapa mutasi (Ritsema et al., 2006 ; Vijn & Smeekens, 1999 ). Fruktan DP panjang pada gilirannya dapat didegradasi dari ujung terminal dengan eksohidrolase fruktan ( FEH ; EC 3.2.1.153); dengan 1-FEH lebih suka menghidrolisis ikatan β -2,1 (Van Den Ende et al., 2003 ), 6-FEH lebih suka menghidrolisis ikatan β -2,6 (Van Riet et al., 2006 ), dan gen FEH lainnya yang menghidrolisis fruktan neoseri (Kawakami & Yoshida, 2005 ). Enzim-enzim FEH ini dapat berperan dalam pemangkasan dan pergantian serta degradasi fruktan (Lothier et al., 2007 ; Pollock, 1986 ; Van Den Ende et al., 2003 ); dan gen FEH berevolusi dari gen CWI dengan sedikit mutasi (De Coninck et al., 2005 ; Le Roy et al., 2007 ).
Fruktan dengan tipe inulin yang terikat β- (2,1) dominan pada dikotil sementara tipe levan yang terikat β- (2,1) dan β- (2,6) dominan pada rumput beriklim sedang, bakteri, dan jamur (Vijn & Smeekens, 1999 ). Brachypodium distachyon (L.) P. Beauv., model genetik yang sangat baik untuk rumput, tidak mensintesis fruktan DP panjang dan hanya memiliki fungsi gen β -fructofuranosidase dan fungsi gen invertase lainnya yang bekerja pada sakarida DP pendek (Lammens et al., 2009 ; Li et al., 2012 ). Serealia Triticeae tampaknya memiliki susunan gen biosintesis fruktan dan aktivitas enzim terluas, dengan T. aestivum mengandung inulin bercabang dan fruktan tipe levan dengan ikatan β- (2,1) dan β- (2,6) (Kawakami & Yoshida, 2005 ). Hasilnya, susunan gen GH32 T. aestivum yang luas telah diklon dan dikarakterisasi (Kawakami & Yoshida, 2005 ; Van den Ende et al., 2005 ; Van Riet et al., 2008 ). Di dalam rumput hijauan, L. perenne menghasilkan seri levan DP rendah dan neoseri levan β- (2,6) DP lebih tinggi dengan molekul glukosa internal (Pavis et al., 2001 ). Neoseri levan DP tinggi di L. perenne dihasilkan dari aktivitas enzim 6G-FFT daripada 1-FFT (Lasseur et al., 2009 ). Orchardgrass ( Dactylis glomerata L.), dihipotesiskan sebagai model ideal untuk biosintesis fruktan karena seri levan DP β -(2,6) yang tidak bercabang dan panjang (Chatterton et al., 1993 ; Livingston et al., 2009 ; Maleux & Van den Ende, 2007 ), tetapi karena genom auto-tetraploidnya, ia tidak cocok sebagai model genetik. Meskipun demikian, dengan adanya perakitan genom yang tersedia (Huang et al., 2019 ), karakterisasi gen orchardgrass yang terlibat dalam biosintesis fruktan kini dapat dilakukan.
Karena hubungan antara ketahanan musim dingin dan akumulasi fruktan, kami mengukur kandungan fruktan dari lima sumber plasma nutfah rumput kebun yang dianggap berbeda dalam ketahanan musim dingin. Kami berhipotesis bahwa akumulasi fruktan saat aklimatisasi dingin meningkat dan menyebabkan tanaman rumput kebun menjadi lebih toleran terhadap pembekuan, dan bahwa transkrip gen biosintesis fruktan diinduksi saat aklimatisasi dingin sementara transkrip gen degradasi fruktan berkurang. Dalam konteks sumber daya genomik terkini, kami telah mengidentifikasi gen kandidat GH32 dengan kemungkinan fungsi gen invertase, fruktosiltransferase, dan eksohidrolase berdasarkan kesamaan sekuens dengan gen yang dicirikan secara fungsional dalam Triticeae dan L. perenne . Kami menunjukkan bahwa rumput kebun memang mengandung lebih sedikit fruktosiltransferase tetapi lebih banyak famili gen FEH dan CWI daripada Triticeae atau L. perenne , dan menentukan gen yang diekspresikan secara tinggi untuk setiap famili gen.
BAHAN DAN METODE
Bahan tanaman
Lima sumber plasma nutfah rumput liar digunakan: “AC Killarney,” “Grasslands Tekapo” (Tekapo), “Potomac,” PI 372621, dan galur pemuliaan UTWH-102. AC Killarney adalah kultivar toleran dingin yang dikembangkan di Alberta, Kanada sementara Tekapo adalah kultivar yang lebih aktif di musim dingin dan tidak toleran dingin dari Selandia Baru (Rumball et al., 1997 ). Dalam studi percontohan internal, PI 372621 menghasilkan kadar karbohidrat larut air yang lebih tinggi dalam kondisi kontrol daripada kultivar dan aksesi lain dan dengan demikian dihipotesiskan memiliki toleransi dingin. Galur pemuliaan UTWH-102 dikumpulkan di lokasi dengan elevasi tinggi dan tekanan beku di Utah (Robins et al., 2018 ), dan bertahan dalam kondisi beku dengan sedikit tutupan salju. Akhirnya, Potomac dimasukkan sebagai kultivar yang umum ditanam (Bushman et al., 2011 ) tanpa harapan toleransi dingin. Sumber plasma nutfah ini dimaksudkan untuk memberikan contoh berbagai perbedaan dalam ketahanan musim dingin dan toleransi terhadap pembekuan.
Uji kelangsungan hidup musim dingin di lapangan dan penilaian toleransi pembekuan ruang pertumbuhan
Untuk menilai ketahanan musim dingin, kelangsungan hidup musim dingin di lokasi lapangan Utah dan toleransi beku di ruang pertumbuhan diuji. Untuk kelangsungan hidup musim dingin, sembilan bibit dari setiap sumber plasma nutfah dipindahkan dalam rancangan acak lengkap di pertanian penelitian Panguitch Universitas Negeri Utah (37.869° LU, 112.436° BB, 1994 m dpl) pada musim gugur 2017. Temperatur musim dingin dan hujan salju dicatat di stasiun cuaca pertanian Panguitch, dan skor vigor tanaman dicatat pada 1 Juni 2018. Skor vigor berkisar dari 0 hingga 5, dengan 0 setara dengan mortalitas tanaman dan 5 untuk tanaman dewasa yang sehat. Data kelangsungan hidup musim dingin dianalisis menggunakan model linear umum sederhana dalam paket lme4-R (Bates et al., 2015 ), dengan genotipe sebagai efek tetap dan replikasi sebagai efek acak. Rata-rata dan kesalahan standar ditunjukkan dalam hasil. Untuk menilai toleransi beku, 50 tanaman dari setiap entri dikecambahkan dalam flat 50 sel dalam rancangan acak, dan tumbuh hingga tahap lima anakan. Bibit kemudian ditempatkan dalam ruang pertumbuhan pada suhu 4 °C dengan 8 jam cahaya redup pada 150 µmol s −1 m −2 (PAR) selama 14 hari. Setelah aklimatisasi dingin, delapan bibit dari setiap sumber plasma nutfah diacak ke flat baru dan mengalami salah satu dari empat suhu beku: −6 °C, −9 °C, −12 °C, dan −15 °C. Peningkatan dari 4 °C ke suhu beku target terjadi pada laju 1,2 °C setiap jam (Skinner & Garland-Campbell, 2014 ), dan bibit tetap pada setiap suhu beku akhir selama 12 jam dalam gelap. Setelah perlakuan pembekuan, tanaman dikembalikan ke suhu 4°C pada tingkat peningkatan yang sama, dan dipertahankan pada suhu 4°C dalam ruang pertumbuhan selama 8 jam dengan cahaya rendah pada 150 µmol s −1 m −2 . Bibit kemudian ditempatkan di rumah kaca pada suhu 25°C/15°C (siang/malam) dengan cahaya alami selama 30 hari dan kelangsungan hidup setiap entri dicatat. Analisis suhu median yang mematikan untuk 50% tanaman yang mati (LT 50 ) dilakukan menggunakan analisis probit dengan fungsi keluarga binomial dalam R (Bates et al., 2015 ), dengan model berikut:
![]()
dimana P ( y ijk = 1) adalah peluang kematian tanaman, Φ adalah fungsi distribusi kumulatif dari distribusi normal baku, Β (0) adalah intersep, Β ( g i ) adalah pengaruh tetap genotipe ( i ), Β ( t j ) adalah pengaruh tetap suhu ( j ), dan Β ( gt ij ) adalah pengaruh interaksi antara genotipe ( i ) dan suhu ( j ).
Hasilnya diimpor ke pustaka MASS menggunakan perintah p.dose untuk memperkirakan nilai LT 50 dan nilai kesalahan standar untuk setiap entri (Venables & Ripley, 2002 ). Bersamaan dengan itu, bibit tambahan dikecambahkan dalam flat 50 sel dan dipelihara di rumah kaca pada suhu 25°C/15°C (siang/malam) dengan cahaya alami selama 30 hari sebelum pengambilan sampel sebagai kontrol.
Kuantifikasi karbohidrat dan profil ekspresi gen
Delapan belas dari 50 mahkota yang diaklimatisasi dingin dari setiap sumber plasma nutfah, dalam tiga mahkota, dicuci dengan cepat, dipisahkan dari jaringan tanaman lain, dan dibekukan dengan cepat dalam nitrogen cair. Sampel mahkota ini digunakan untuk kuantifikasi karbohidrat dan profil ekspresi gen, dengan tiga replikasi digunakan untuk yang pertama dan tiga untuk yang kedua. Demikian pula, mahkota yang dibulatkan dari sampel kontrol dicuci dengan cepat, dipisahkan dari jaringan tanaman lain, dan dibekukan dengan cepat dalam nitrogen cair. Untuk estimasi karbohidrat yang larut dalam air, HPLC digunakan untuk mengukur glukosa, fruktosa, sukrosa, dan fruktan pada mahkota kontrol dan yang diaklimatisasi dingin. Untuk setiap sampel yang dibulatkan, mahkota dikeringkan dalam suhu beku dan 10 mg jaringan kering dan digiling ditempatkan dalam 50 mL air deionisasi dan diinkubasi selama 60 menit pada suhu 65°C dengan pengadukan lembut. Dari suspensi ini, 1 mL ekstrak air disaring melalui filter jarum suntik 45 µm dan ditempatkan dalam botol sampel. Dengan air ultra-murni MilliQ sebagai aliran, sampel dipisahkan pada kolom CarboSep CHO 682 (Chrom Tech Inc., Apple Valley, MN, AS) dengan kolom pelindung Adsorbosphere XL SCX (Dr. Maisch GmbH, Ammerbuch, Jerman), dan detektor indeks bias 1260 (Agilent, Santa Clara, CA, AS). Suhu kolom adalah 85°C, 20 µL disuntikkan dari setiap sampel, dan kurva standar fruktosa digunakan untuk memperkirakan kuantitas keempat puncak karbohidrat. Perbedaan, rata-rata, dan kesalahan standar dihitung menggunakan model linear umum dalam R (Bates et al., 2015 ), dengan genotipe, perlakuan, dan genotipe × perlakuan sebagai efek tetap. Nilai-nilai tersebut dilaporkan sebagai mg g −1 jaringan kering. Urutan famili glikosida hidrolase 32 diperoleh dari anotasi gen dari rakitan genom referensi orchardgrass (Huang et al., 2019 ) menggunakan penelusuran BlastX dari gen organisme model dan nilai batas E 1e −5 . Ini termasuk: T. aestivum 6-SFT (ABO29887); T. aestivum 1-SST (ABO29888); T. aestivum 1-FFT (ABO88409); T. aestivum 6&1-KEH (ABO89269); T. aestivum 6-KEH (AB089270); T. aestivum CWI (AF030420); L. perenne FT1 (AF481763); L. perenne 6G-FFT (AF492836); L. perenne 6-SFT (AF494041); Festuca arundinaceae 1-SST (AJ297369); T.estivum 1-FEH w1 (AJ516025); Hordeum vulgare L.1 -SST (AJ567377); H. vulgare 1-FEH (AJ605333); H.vulgare VI (AJ623275); T.estivum VI (AJ635255); T.estivum 6-FEH (AM075205); L.perenne VI (AY082350); L.perenne 1-SST(AY245431); B. distachyon INV (Bradi1g52210); B. distachyon VI (Bradi3g00910); B. distachyon FFase (Bradi5g16900); L. perenne 1-FEH (DQ018712); L. perenne FEH (DQ073968); L. perenne CWI (DQ073969); H. vulgare 1-FFT (JQ411253); L. perenne 6-FEH (KY554803); H. vulgare 6-SFT (X83233). Setelah diidentifikasi, gen biosintesis fruktan orchardgrass diterjemahkan dan diselaraskan dengan urutan asam amino model rumput menggunakan MAFFT dalam perangkat lunak Geneious Prime v2025 (Auckland, Selandia Baru). Pohon hubungan gen tanpa akar dibuat menggunakan metode jarak penggabungan tetangga dalam Geneious Prime. Nilai ekspresi gen basal dari setiap gen GH32 diekstraksi dari data RNAseq bersama dengan perubahan lipatan log2 dan nilai probabilitas yang disesuaikan ( p adj ). Posisi peta referensi diekstraksi dari berkas assembly annotation.gff yang dipublikasikan (Huang et al., 2019 ).
Untuk profil ekspresi gen, jaringan dari mahkota kontrol dan mahkota yang diaklimatisasi dingin dipanen dan dikumpulkan seperti yang tercantum di atas. Total RNA diekstraksi dari 30 mahkota kontrol dan mahkota yang diaklimatisasi dingin ini menggunakan kit ekstraksi RNA DirectZol (Zymo, Tustin, CA, AS), dan 20 juta pembacaan PE.150 (Illumina, San Diego, CA, AS) diurutkan dari setiap sampel di Novogene (Sacramento, CA, AS). Transkrip ini disimpan di Arsip Bacaan Singkat Pusat Informasi Bioteknologi Nasional, di bawah BioProject PRJNA1157851. Pembacaan transkrip dilakukan secara kualitatif (SLIDINGWINDOW:4:20) dan dipangkas ujungnya menggunakan perangkat lunak Trimmomatic v0.39 (Bolger et al., 2014 ), dipetakan ke rakitan genom referensi orchardgrass (Huang et al., 2019 ) menggunakan perangkat lunak HiSat2 v2.2.1 (Kim et al., 2019 ), dan hitungan pembacaan dibuat menggunakan perangkat lunak HTseq v2.0.8 dalam mode gabungan untuk menghasilkan hitungan transkrip (Putri et al., 2022 ). Hitungan difilter untuk memerlukan setidaknya 10 hitungan dalam setidaknya lima sampel. Perangkat lunak DeSeq2 v1.38.3 (Love et al., 2014 ) digunakan untuk analisis normalisasi dan ekspresi diferensial dengan genotipe, perlakuan, dan genotipe × perlakuan sebagai efek tetap dalam model. Gen yang diekspresikan secara diferensial (DEG) disebut jika nilai probabilitas tingkat penemuan palsu ( p adj ) kurang dari 0,05 dan setidaknya terjadi perbedaan dua kali lipat antara jumlah transkrip. Anotasi Fungsional dan Gene Ontology dibuat untuk setiap gen menggunakan perangkat lunak OMICs Box (BioBam Bioinformatics SL, Valencia, Spanyol), dengan menggunakan jalur tBlastX, Blast2GO, dan InterPro. Pengelompokan profil ekspresi gen dengan empat pola kandungan karbohidrat dibuat dengan WGCNA (Langfelder & Horvath, 2008 ), dengan batas klade pada 0,2 untuk menentukan jumlah modul dan keanggotaan.
HASIL
Uji kelangsungan hidup musim dingin di lapangan dan penilaian toleransi pembekuan ruang pertumbuhan
Lokasi penelitian Panguitch mencatat suhu terendah musim dingin sebesar -22°C, suhu musim dingin rata-rata dari Oktober hingga Maret sebesar -10°C, dan tutupan salju rata-rata dari Desember hingga Maret sebesar 7 mm. Meskipun mortalitas signifikan terjadi di lokasi Panguitch untuk semua lima entri, AC Killarney memiliki mortalitas terendah sebagaimana ditunjukkan oleh skor vigor keseluruhan tertinggi, sementara Tekapo memiliki mortalitas tertinggi dan skor vigor terendah (Gambar 1a ). Demikian pula, dalam studi pembekuan, AC Killarney memiliki LT 50 lebih rendah dari -11°C sementara Tekapo memiliki LT 50 pada -8°C (Gambar 1b ). Untuk kedua pengukuran, UTWH-102 berada di urutan kedua dalam toleransi pembekuan dan kelangsungan hidup musim dingin sementara Potomac dan PI 372621 tidak berbeda secara signifikan satu sama lain dan lebih rendah dari AC Killarney dan UTWH-102 (Gambar 1a,b ).

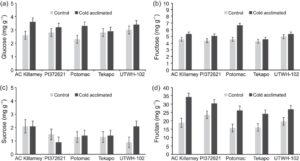
Kuantifikasi karbohidrat
Tingkat sukrosa dan glukosa secara keseluruhan terdeteksi pada kurang dari 5 mg g −1 jaringan kering, fruktosa antara 5 dan 10 mg g −1 , dan fruktan pada 15–36 mg g −1 . Baik kadar glukosa maupun fruktosa meningkat pada mahkota yang diaklimatisasi dingin, secara signifikan pada sebagian besar entri (Gambar 2 ). Kadar sukrosa tidak konsisten di seluruh entri; dan tidak berbeda secara signifikan antara kontrol dan mahkota yang diaklimatisasi dingin untuk tiga dari lima entri. Namun, kadar fruktan diinduksi oleh dingin pada semua lima entri, dengan AC Killarney yang tahan dingin menunjukkan induksi tertinggi dan tingkat aklimatisasi dingin keseluruhan tertinggi dan Tekapo memiliki tingkat aklimatisasi dingin terendah (Gambar 2 ). Mahkota PI 372621, yang memiliki kandungan fruktan tertinggi pada suhu terkontrol, menunjukkan induksi fruktan yang lebih kecil saat aklimatisasi dingin dibandingkan dengan AC Killarney. Demikian pula, UTWH-102, yang kedua setelah AC Killarney dalam ketahanan musim dingin dan toleransi beku, menunjukkan induksi fruktan yang relatif kecil pada jaringan yang diaklimatisasi dingin.
Analisis klaster keluarga gen GH32
Dua puluh satu gen GH32 diidentifikasi dan disejajarkan dengan gen-gen terkait dari B. distachyon , T. aestivum , H. vulgare , dan L. perenne (Gambar 3 ); dan dipisahkan ke dalam empat klade gen katabolisme fruktan utama. Satu dari 21 gen orchardgrass dikelompokkan bersama dengan gen β-fructofuranosidase (FFase) B. distachyon , dan keduanya proksimal terhadap klade gen VI . Empat gen orchardgrass lainnya dianotasi sebagai gen β -fructofuranosidase dan FEH , dan disejajarkan paling dekat dengan gen 6-FEH T. aestivum dalam subklade yang terpisah dari gen FEH lainnya (Gambar 3 ).

Tujuh gen orchardgrass dikelompokkan dengan sekuens L. perenne atau T. aestivum CWI , dan gen-gen ini proksimal terhadap klade FEH . Selain dari empat gen orchardgrass yang dikelompokkan dengan T. aestivum 6-FEH , empat gen orchardgrass lainnya berada dalam klade FEH , beberapa mengelompok lebih dekat ke 1 – FEH dan yang lainnya ke gen 6-FEH dari sekuens L. perenne atau Triticeae. Mirip dengan hubungan antara CWI dan FEH , dua gen orchardgrass yang dikelompokkan dengan gen VI proksimal terhadap klade fruktosiltransferase. Karena orchardgrass terutama mensintesis ikatan β -(2,6) (Chatterton et al., 1993 ), identifikasi 6-SFT menjadi perhatian utama. Gen DG2G04963 dikelompokkan bersama dengan 6 gen SFT lainnya ke dalam subklade yang berbeda, yang kemudian dikaitkan dengan gen fruktosiltransferase terkait lainnya ( 1-SST dan FFT ). Dua gen fruktosiltransferase lainnya dalam klade tersebut kemungkinan memiliki aktivitas 1-SST dan FFT .
Profil ekspresi gen
Untuk menentukan gen fruktosiltransferase mana yang diekspresikan dan diinduksi oleh aklimatisasi dingin, kami menggunakan pendekatan transkriptom untuk mengurutkan gen yang diekspresikan dalam mahkota kontrol dan yang diaklimatisasi dingin. Dari 42.333 gen dalam set data anotasi D. glomerata (Huang et al., 2019 ), 25.026 memiliki bukti ekspresi dalam setidaknya satu entri dan perlakuan dan 5.123 adalah DEG setelah aklimatisasi dingin (Tabel S1 ). Tingkat transkrip diinduksi pada tahun 1903 dan dikurangi pada 3.220, dan DEG dikelompokkan menjadi delapan modul ekspresi menurut asosiasinya dengan empat tingkat karbohidrat (Gambar 4 ). Dari delapan modul ekspresi tersebut, modul 2 dan 7 menunjukkan korelasi tertinggi dengan kandungan fruktan. Modul-7 mencakup sebagian besar DEG, ditandai dengan tingkat induksi/reduksi yang sama pada tingkat transkrip di seluruh lima sumber plasma nutfah dan setelah aklimatisasi dingin, dan mencakup tujuh dari delapan DEG GH32 (Tabel S1 ). DEG GH32 yang tersisa dalam modul-2 (DG2G04963) juga menunjukkan perubahan yang kira-kira sama pada tingkat transkrip di seluruh lima sumber plasma nutfah setelah aklimatisasi dingin, mirip dengan modul-7, tetapi dengan tingkat transkrip kontrol UTWH-102 yang jauh lebih tinggi daripada yang lain.

Delapan belas dari 21 gen orchardgrass GH32 memiliki dukungan ekspresi dalam jaringan kontrol atau jaringan yang diaklimatisasi dingin, dan delapan adalah DEG (Tabel 1 dan Gambar 3 ). Dari tujuh CWI , dua tidak memiliki bukti ekspresi dan tidak ada yang diekspresikan secara diferensial dengan perubahan dua kali lipat. Sebuah klaster dari dua gen CWI pada kromosom-3 mencakup satu gen dengan tingkat ekspresi basal yang tinggi dan motif GH32 yang utuh sementara yang lain tidak menunjukkan bukti ekspresi dan memiliki delesi pada motif WMNDPNG (Tabel 1 ). Kedelapan gen FEH putatif memiliki bukti ekspresi, dengan tiga menunjukkan peningkatan atau penurunan lebih dari dua kali lipat dalam tingkat transkrip setelah aklimatisasi dingin. Tiga gen FEH dikelompokkan pada kromosom-3 dan tiga dikelompokkan pada kromosom-4; bertepatan dengan sub-klade dari Gambar 3. Di kedua klaster, gen dominan memiliki tingkat ekspresi basal yang tinggi dan tidak ada delesi pada motif WMNDPNG (Tabel 1 ); DG2G00215, DG2G00400, dan DG4G00207. Salah satu subklade dicirikan oleh Glutamin dalam motif WMNDPNG sementara subklade lainnya memiliki Metionina atau Isoleusin pada posisi tersebut. Gen FEH orchardgrass DG3G00215 yang dikelompokkan dengan T. aestivum 6-FEH (Gambar 3 ) diinduksi setelah aklimatisasi dingin sementara DG3G00400 dan DG3G00402 dalam subklade yang sama menunjukkan transkrip yang berkurang setelah aklimatisasi dingin.
| gen GH32 | keluarga GH32 | Kromosom: posisi | Jumlah dasar | Log perubahan 2 kali lipat | p kata sifat | Motif WMNDPNG | Motif WSGSAT |
|---|---|---|---|---|---|---|---|
| DG2G01456 | Bahasa Indonesia: CWI | Bab 2:57297102-57300843 | 771.5 | -1,49 | 0,025 | ANGINPNG | WGSTTT (Waktu Standar Pasifik) |
| DG3G02665 | Bahasa Indonesia: CWI | Bab 3:95208157-95210751 | – | – | – | SAYAP | WSGSAT |
| DG3G02666 | Bahasa Indonesia: CWI | Jam 3:95245903-95249567 | 1441.3 | -1,02 | 0.921 | ANGIN PNA | WSGSAT |
| DG5G02922 | Bahasa Indonesia: CWI | Bab 5:159620551-159623856 | – | – | – | ANGINPNG | WSGSAT |
| DG5G03161 | Bahasa Indonesia: CWI | Bab 5:167773401-167775320 | 36.7 | 1.29 | 0,825 | ANGINPNG | WSGSAT |
| DG5G05140 | Bahasa Indonesia: CWI | Bab 5:234944233-234955227 | 28.6 | 1.31 | 0.203 | WMNDPNA | WSGSAT |
| DG6G02005 | Bahasa Indonesia: CWI | Bab 6:115278723-115284518 | 139.8 | 1.04 | 0,778 tahun | ——G | WSGSAT |
| DG1G05145 | FEH | Bab 1:238158453-238161861 | 849.4 | 1.82 | <0,001 | ANGIN PSG | WHATGSTTT (Kamis, 11/12/2019) |
| DG3G00215 | FEH | Jam 3:9828843-9841514 | 1827.7 | 7.59 | <0,001 | WQNDPNG | WSGSAT |
| DG3G00395 | FEH | Bab 3:15227181-15229413 | 33.9 | 1.02 | 0,948 tahun | WQ—NG | WSGSAT |
| DG3G00400 | FEH | Bab 3:15314359-15318637 | 1573.6 | -37,51 | <0,001 | WQNDPNG | WSGSAT |
| DG3G00402 | FEH | Bab 3:15390179-15401974 | 10.0 | -112,62 | <0,001 | WQ—NG | YSGSAT |
| DG4G00207 | FEH | Jam 4:6289104-6296490 | 1460.2 | 1.82 | <0,001 | WMNDPSG | WHATGSTTT (Kamis, 11/12/2019) |
| DG4G00208 | FEH | Bab 4:6310066-6316451 | 189.6 | -1,05 | 0.849 | — | WTGSAT |
| DG4G00212 | FEH | Jam 4:6478098-6481546 | 118.0 | -1,48 | 0,001 | SAYAP | WTGSAT |
| DG3G02142 | Masalah FF | Jam 3:76569274-76574899 | 201.7 | -6,71 | <0,001 | WMNDPNG | WTGSAT |
| DG2G00095 | Bahasa Indonesia: Ke-VI | Bab 2:3453877-3460955 | 74.9 | -3,86 | <0,001 | WMNDPNG | WSGSAT |
| DG2G04966 | Bahasa Indonesia: Ke-VI | Bab 2:222270036-222273950 | 381.4 | -15.10 | <0,001 | WMNDPNG | WTGSAT |
| DG2G04962 | FT | Bab 2:221997545-222000705 | 1602.1 | 3.20 | <0,001 | YMNDPNG | LTGSIT |
| DG2G04963 | FT | Bab 2:222055303-222058920 | 22204.4 | 8.27 | <0,001 | FMSDPNG | LSGSIT |
| DG2G04965 | FT | Bab 2:222260375-222262852 | – | – | – | YM—NG | MTGSTT |
β – fructofuranosidase-1 dan kedua gen VI telah mengurangi kadar transkrip setelah aklimatisasi dingin sementara dua dari fruktosiltransferase, termasuk putative 6-SFT (DG2G04963), diinduksi (Tabel 1 ). Gen DG2G04963 memiliki fenilalanin dalam motif WMNDPNG, dan menunjukkan kadar basal tertinggi dari kelimpahan transkrip dari semua gen GH32 dalam perlakuan dan penelitian ini (Tabel 1 ). Gen fruktosiltransferase ketiga tidak memiliki bukti ekspresi dan urutan unik di dua situs motif GH32 . Data ini konsisten dengan peningkatan kandungan fruktan setelah aklimatisasi dingin yang disebabkan oleh induksi sintesis fruktan oleh gen fruktosiltransferase dan pengurangan hidrolisis fruktan oleh gen FEH dan VI .
DISKUSI
Meskipun rumput orchardgrass tumbuh di daerah beriklim sedang yang sejuk, musim dingin sering kali ditandai dengan lapisan salju yang bersifat isolasi. Dengan demikian, ketahanan musim dingin dapat dikaitkan dengan faktor-faktor seperti ketahanan terhadap jamur salju ( Typhula incarnata Lasch, Epicr. (1838)) daripada ketahanan terhadap pembekuan (Sanada et al., 2010 ). Akan tetapi, di daerah beriklim beku dengan lapisan salju yang tidak dapat diprediksi, ketahanan musim dingin menggambarkan ketahanan terhadap pembekuan daripada ketahanan terhadap jamur salju. Di lokasi Panguitch yang berada di dataran tinggi dalam penelitian ini, lapisan salju rata-rata selama musim dingin adalah 7 mm, yang tidak cukup untuk menutupi tajuk tanaman rumput orchardgrass, sehingga hasil ketahanan musim dingin lebih merupakan karakteristik ketahanan terhadap pembekuan. Dengan menggabungkan respons fenotipik ketahanan musim dingin Panguitch dan toleransi beku, kultivar Kanada AC Killarney menunjukkan nilai sifat tertinggi dari keduanya, dan secara signifikan lebih baik daripada Grasslands Tekapo, Potomac, dan PI 372621. UTWH-102, yang awalnya dipilih di dekat lokasi Panguitch, juga memiliki ketahanan musim dingin dan toleransi beku yang tinggi dan serupa dengan AC Killarney.
Sebagian besar karbohidrat yang larut dalam air meningkat setelah aklimatisasi dingin di kelima sumber plasma nutfah. Glukosa dan fruktosa berperan dalam sintesis sukrosa, dan ketiganya terlibat dalam banyak proses biologis selain akumulasi fruktan dan ketahanan musim dingin. Meskipun demikian, fruktosa dan glukosa meningkat setelah aklimatisasi dingin, sebagai tren di beberapa sumber plasma nutfah dan secara signifikan di sumber plasma nutfah lainnya. Kadar sukrosa bervariasi setelah aklimatisasi dingin untuk kelima sumber plasma nutfah, yang menunjukkan peran dinamisnya dalam pertumbuhan dan perkembangan tanaman daripada sumber yang ketat untuk biosintesis fruktan (Winter & Huber, 2000 ). Dalam konteks toleransi pembekuan, kadar sukrosa terbukti berfluktuasi dari waktu ke waktu selama aklimatisasi dingin (Gallagher et al., 2007 ) dan berperan penting dalam induksi atau pergantian fruktan melalui regulasi aktivitas enzim VI dan 1-SST (Winter & Huber, 2000 ). Dalam penelitian ini, kadar fruktan diinduksi di kelima sumber plasma nutfah setelah aklimatisasi dingin selama 4 minggu seperti yang diperkirakan. Meskipun terlalu sedikit sumber plasma nutfah yang diperiksa dalam penelitian ini untuk korelasi statistik, tingkat induksi atau kandungan fruktan tertinggi untuk AC Killarney dan terendah untuk Tekapo (Gambar 2 ).
Banyak identifikasi gen yang terlibat dalam biosintesis fruktan mendahului perakitan genom dan didasarkan pada kloning gen BAC atau PCR. Dengan demikian jumlah gen, hubungan mereka satu sama lain, dan transkripsi relatif mereka tidak dipahami dengan baik pada rumput hijauan beriklim sedang. Lebih jauh lagi, nomor kromosom orchardgrass ditugaskan oleh Huang et al. ( 2019 ) dengan mengurangi panjang sementara kromosom referensi L. perenne ditugaskan berdasarkan sinteni ke Triticeae. Karena orchardgrass menghasilkan profil fruktan β -(2,6) tipe levan yang relatif sederhana dan tidak bercabang, seperti Phleum pratense L. (Tamura et al., 2009 ), kami berhipotesis bahwa ia membawa lebih sedikit fruktosiltransferase daripada T. aestivum atau L. perenne . Memang, dalam genotipe referensi yang diurutkan oleh Huang et al. ( 2019 ), hanya tiga fruktosiltransferase yang terdeteksi dan satu di antaranya tidak memiliki bukti ekspresi (Tabel 1 ). Ketiganya masing-masing membawa empat ekson, serta motif WMNDPNG dan WSGSAT unik yang menunjukkan fruktosiltransferase (Francki et al., 2006 ; Ritsema et al., 2006 ). Gen DG2G04963 dikelompokkan dengan gen 6-SFT di rumput-rumputan lain, yang menjadi perhatian khusus karena akan mengkode aktivitas gen yang memanjangkan kestotriosa menjadi fruktan DP β -(2,6) yang lebih panjang di rumput kebun. Dengan tingkat transkrip basal terbesar, dan induksi setelah aklimatisasi dingin di lima sumber plasma nutfah rumput kebun, gen ini kemungkinan merupakan kandidat untuk biosintesis fruktan 6-SFT di rumput kebun. Meskipun dikelompokkan dalam modul-2 dalam hasil transkriptom, yang menunjukkan induksi transkrip yang sama pada semua lima sumber plasma nutfah, perannya dalam toleransi stres abiotik, pertumbuhan kembali hijauan, dan kualitas hijauan menjadikannya kandidat untuk studi lebih lanjut.
Bila rumput liar tidak mensintesis fruktan tipe-F dalam jumlah yang cukup (Chatterton et al., 1993 ), gen DG2G04965, tanpa bukti ekspresi dalam percobaan ini, mungkin mengodekan produk pseudogen dengan aktivitas FFT minimal . Gen fruktosiltransferase yang tersisa, DG2G044962, menunjukkan homologi dengan 1-SST dan 6G-FFT dalam L. perenne ; yang mana keduanya sendiri 83% identik pada tingkat asam amino (Lasseur et al., 2011 ). DG2G044962 menunjukkan ekspresi basal yang relatif tinggi dalam penelitian kami dan diinduksi setelah aklimatisasi dingin. Ini dipetakan bersama dengan dua gen fruktosiltransferase lainnya dan gen VI dalam gugus pada kromosom-2 orchardgrass, mirip dengan lokasi peta sintenik pada kromosom-7 L. perenne (Chen et al., 2024 ) dan gugus gen homolog dalam H. vulgare (Huynh et al., 2012 ). Gen ini dapat berfungsi sebagai 1-SST , tetapi karena fruktan DP3 primer dalam orchardgrass adalah 6-kestotriosa dan bukan 1-kestotriosa (Chatterton et al., 1993 ), bukti eksperimental lebih lanjut diperlukan untuk mengonfirmasi perannya.
Tiga gen orchardgrass ditemukan berhubungan dengan gen VI , dengan DG3G02142 paling mirip dengan β -fructofuranosidase. Ketiganya dikelompokkan dengan gen β-fructofuranosidase atau invertase B. distachyon masing-masing (Gambar 3 ) dan menunjukkan reduksi transkrip setelah aklimatisasi dingin dalam penelitian ini (Tabel 1 ). Baik gen β -fructofuranosidase maupun VI memiliki fungsi untuk menghidrolisis sukrosa menjadi glukosa dan fruktosa, dan reduksinya akan meningkatkan kumpulan sukrosa yang dapat dimasukkan ke dalam biosintesis fruktan (Winter & Huber, 2000 ). Gen DG2G00095 dikelompokkan paling dekat dengan gen VI dari rumput beriklim sedang lainnya dan gen DG2G04966 ditempatkan bersama dengan tiga fruktosiltransferase dalam gugus gen pada kromosom-2 (Tabel 1 ). Berbeda dengan gen VI , tujuh gen CWI diidentifikasi, konsisten dengan perluasan keluarga gen CWI pada rumput kebun (Huang et al., 2019 ). Gen CWI DG3G02666 , dengan tingkat transkrip tertinggi, dikelompokkan pada kromosom-3 di dekat CWI lain tanpa bukti transkrip. Tidak ada gen CWI yang diekspresikan secara berbeda, konsisten dengan peran beragamnya dalam proses biologis tanaman lainnya (Winter & Huber, 2000 ).
Sejumlah besar gen FEH dikelompokkan menjadi dua subklade dengan empat gen masing-masing (Gambar 3 ). Dalam satu subklade, DG4G00207 dan DG1G05145 dikelompokkan dengan L. perenne 6-FEH , DG4G00208 dikelompokkan dengan L. perenne 1-FEH , dan DG4G00212 dikelompokkan dengan L. perenne FEH yang tidak ditentukan (Gambar 3 ). Keempat homolog FEH ini dikarakterisasi oleh Threonine daripada Serine dalam motif WSGSAT, dan tiga dikelompokkan bersama pada kromosom-4 (Tabel 1 ). Tidak seperti L. perenne , yang menghasilkan neoseries fruktan bercabang dan menunjukkan aktivitas 1-FEH dan 6-FEH (Lothier et al., 2007 ; Marx et al., 1997 ), fruktan orchardgrass dicirikan oleh hubungan β -(2,6) sehingga orchardgrass tidak diprediksi memiliki aktivitas 1-FEH yang berarti. Dalam penelitian ini, gen 1-FEH putatif (DG4G00208) memiliki jumlah transkrip basal yang relatif rendah sebesar 190 sementara gen DG4G00207 dan DG1G05145, yang dikelompokkan dengan L. perenne 6-FEH , memiliki jumlah ekspresi basal masing-masing sebesar 1460 dan 849 (Tabel 1 ). Karena dua gen 6-FEH putatif juga menunjukkan sedikit peningkatan dalam kelimpahan transkrip (Tabel 1 ), mereka mungkin memiliki peran dalam langkah pergantian selama biosintesis fruktan. Subklade kedua gen FEH mencakup DG3G00215, DG3G00395, DG3G00400, dan DG3G00402. Ini dikarakterisasi oleh Glutamin daripada Metionin dalam motif GH32 WMNDPNG mereka, dianotasi sebagai β -fructofuranosidase daripada fruktan eksohidrolase oleh algoritma Blast2Go (Tabel S1 ), tetapi juga dikelompokkan dengan gen 6-FEH T. aestivum (Gambar 3 ). Tiga dari empat adalah DEG, dengan DG3G00215 sangat diinduksi dan DG3G00400 dan DG3G00402 sangat berkurang setelah aklimatisasi dingin (Tabel 1 ). Tiga dari empat gen tersebut juga terletak di gugus gen pada kromosom-3, dengan DG3G00400 sebagai gen dengan kadar transkrip basal tertinggi di gugus tersebut. Gen FEH yang ekspresinya berkurang setelah aklimatisasi dingin dapat berkontribusi pada ketahanan musim dingin dengan mencegah hilangnya fruktan sepanjang musim dingin, yang pada gilirannya dapat memberikan toleransi beku dan ketahanan terhadap jamur salju ( Typhula ishikariensis S. Imai (1930)) (Yoshida et al., 1998 ; Yoshida, 2021). Eksperimen lebih lanjut, untuk membedakan ekspresi gen-gen ini pada serangkaian respons stres abiotik dan pengguguran daun yang lebih luas, akan diperlukan untuk membedakan fungsinya dari gen-gen FEH lainnya .
KESIMPULAN
Dalam penelitian ini, 21 gen GH32 diidentifikasi dan dikarakterisasi dalam hubungannya dengan aklimatisasi dingin dan toleransi pembekuan. Konsisten dengan pola fruktan rumput kebun yang relatif tidak rumit, beberapa gen fruktosiltransferase dan VI diidentifikasi. Sebaliknya, tujuh dan delapan gen CWI dan FEH , masing-masing, diidentifikasi. Pola ekspresi ditunjukkan di mana gen biosintesis fruktan diinduksi sementara gen VI dan FEH utama direduksi setelah aklimatisasi dingin, menyoroti gen-gen spesifik yang terlibat dalam sintesis fruktan dan perannya dalam respons pembekuan rumput kebun.




Tinggalkan Balasan