ABSTRAK
Ada peningkatan minat dalam pengembangan proses intensif yang dapat memberikan pengurangan signifikan dalam biaya produksi untuk produk antibodi monoklonal (mAb). Studi ini meneliti kinerja proses membran terintegrasi yang menggabungkan filtrasi aliran tangensial lintasan tunggal (SPTFF) dengan pemurnian membran arus balik kinerja tinggi (HPCMP) untuk prapengkondisian cairan kultur yang dijernihkan (CCF). Langkah SPTFF dioperasikan dengan faktor konsentrasi lintasan tunggal 20x untuk filtrasi 24 jam, tanpa bukti pengotoran membran; tekanan transmembran tetap < 30 kPa selama proses berlangsung. HPCMP kemudian dilakukan pada umpan prakonsentrasi, menghasilkan pengurangan 60 ± 8% pada protein sel inang (HCP) dan lebih dari 30 kali lipat penghilangan DNA sambil mempertahankan hasil langkah mAb 94 ± 3%. Proses HPCMP dioperasikan terus menerus selama 36 jam dengan sedikit penurunan penghilangan HCP pada tahap akhir operasi karena pengotoran membran. Persyaratan buffer untuk proses terpadu hanya 76 L/kg mAb. Hasil ini menunjukkan potensi penggunaan proses SPTFF-HPCMP terpadu untuk prapengondisian CCF sebagai bagian dari proses produksi mAb yang sangat intensif dengan biaya barang yang jauh lebih rendah.
1 Pendahuluan
Sebagian besar antibodi monoklonal (mAb) saat ini diproduksi melalui proses pemurnian hilir platform yang terdiri dari kromatografi afinitas Protein A yang diikuti oleh penahanan pH rendah untuk inaktivasi virus, dua langkah kromatografi pemolesan, penyaringan penghilangan virus, dan kemudian formulasi melalui ultrafiltrasi dan diafiltrasi (Grilo et al. 2017 ; Cataldo et al. 2020 ). Penggunaan jenis platform ini dapat mempercepat jangka waktu pengembangan proses, sehingga produk dapat dipasarkan lebih cepat, sekaligus mengurangi biaya produksi keseluruhan dengan meningkatkan kesesuaian fasilitas dan meminimalkan pelatihan dan kesalahan operator.
Meskipun proses platform berhasil, terdapat fokus baru pada intensifikasi proses di seluruh industri, termasuk pengembangan proses manufaktur berkelanjutan/terhubung, untuk mengurangi keseluruhan biaya barang untuk produk mAb, baik untuk pasar dengan volume sangat tinggi (misalnya, perawatan untuk Alzheimer atau kolesterol tinggi) maupun untuk distribusi produk yang ada secara lebih luas di negara berkembang. Manfaat potensial dari pemrosesan berkelanjutan telah dibahas dalam sejumlah makalah tinjauan (Zydney 2016 ; Gerstweiler et al. 2021 ; Jungbauer et al. 2024 ; Khanal and Lenhoff 2021 ).
Salah satu pendekatan paling sederhana untuk intensifikasi proses adalah dengan melakukan prakonsentrasi cairan kultur sel yang telah dijernihkan (CCF) sebelum operasi pemrosesan hilir lainnya. Brinkmann dan Elouafiq ( 2021 ) menggunakan filtrasi aliran tangensial lintasan tunggal (SPTFF) untuk konsentrasi CCF sebaris untuk beberapa mAb, dengan prakonsentrasi mengurangi konsumsi resin Protein A sebanyak 80% dalam kampanye fed-batch pendek dan memungkinkan masa pakai kolom yang lebih lama dalam proses berkelanjutan (perfusi). Namun, konsentrasi akhir maksimum yang dicapai oleh SPTFF hanya 8 g/L (faktor konsentrasi 7x), dengan beberapa mAb menunjukkan konsentrasi maksimum yang dapat dicapai < 2,5 g/L selama operasi lintasan tunggal kaset Pellicon 3. Brinkmann dkk. ( 2018 ) mampu mencapai faktor konsentrasi yang jauh lebih tinggi menggunakan sistem SPTFF yang sama tetapi dengan CCF yang pertama kali diolah terlebih dahulu dengan mengurangi suhu hingga 2°C–12°C dan pH hingga 4,8 untuk menghilangkan DNA dan HCP melalui flokulasi; penyesuaian suhu dan pH ini akan sulit diimplementasikan dalam proses yang sepenuhnya berkesinambungan. Rahane dkk. ( 2024 ) mampu memperoleh konsentrasi CCF hampir 10 kali lipat menggunakan SPTFF, meskipun konsentrasi mAb maksimum dalam produk prakonsentrasi masih < 9 g/L. Kinerja langkah SPTFF sangat bergantung pada properti filter kedalaman yang digunakan untuk klarifikasi awal, dengan SPTFF meningkatkan produktivitas langkah penangkapan Protein A sebesar 1,8 hingga 2,6 kali lipat. Meskipun SPTFF dapat menyediakan prakonsentrasi signifikan dari produk mAb, ia biasanya menyediakan penghilangan minimal protein sel inang (HCP). Ini dapat menciptakan tantangan signifikan untuk operasi pemrosesan hilir alternatif seperti presipitasi (Minervini et al. 2024 ; Recanati et al. 2023 ), kristalisasi (Behboudi et al. 2024 ; Chen et al. 2021 ), dan ekstraksi dua fase berair (Anupa et al. 2024 ; Muendges et al. 2015 ), antara lain. Mohammadzadehmarandi et al. ( 2023 ) menunjukkan bahwa pemurnian membran arus berlawanan kinerja tinggi (HPCMP) dapat menyediakan penghilangan HCP berkelanjutan dari CCF dengan hasil mAb > 90% selama 48 jam operasi berkelanjutan. Namun, operasi jangka panjang hanya dapat dicapai dengan menggabungkan langkah penipisan DNA sebelum HPCMP, dan proses tersebut membutuhkan buffer dalam jumlah yang signifikan karena konsentrasi mAb yang relatif rendah dalam umpan.
Tujuan dari penelitian ini adalah untuk menyelidiki potensi penggunaan proses yang menggabungkan proses SPTFF dan HPCMP, ditunjukkan secara skematis pada Gambar 1 , untuk prapengondisian mAb dari CCF. Modul membran serat berongga berbiaya rendah digunakan untuk SPTFF dan HPCMP. SPTFF memberikan faktor konsentrasi volume 20x selama 24 jam operasi kontinyu tanpa bukti pengotoran. Eksperimen HPCMP yang dilakukan pada CCF prakonsentrasi memberikan lebih dari dua kali lipat penurunan HCP dan hampir 30 kali lipat pengurangan DNA, dengan hasil langkah mAb sebesar 94 ± 3%. Selain itu, HPCMP juga dapat memberikan pertukaran buffer kontinyu, yang akan memungkinkan pembuangan pengotor MW rendah dan memfasilitasi optimalisasi pH dan/atau konduktivitas sebelum operasi hilir berikutnya. Hasil-hasil ini dengan jelas menunjukkan potensi penggunaan proses SPTFF-HPCMP terintegrasi sebagai strategi berbiaya rendah untuk prapengondisian CCF sebagai bagian dari proses manufaktur mAb intensif/kontinyu.
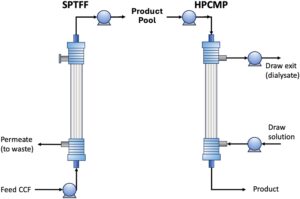
2 Bahan dan Metode
2.1 Supernatan Kultur Sel CHO
Percobaan dilakukan menggunakan mAb yang diekspresikan dalam sel ovarium hamster Cina (CHO) dan disediakan dalam CCF oleh Takeda Pharmaceuticals pada titer sekitar 4 g/L. mAb adalah antibodi imunoglobulin G2 (IgG2) yang diperoleh dari kultur sel fed-batch, dengan pI terhitung sebesar 7,2. Kaldu kultur sel dipanen pada kepadatan sel sekitar 2 × 107 sel /mL dengan viabilitas sel ≥ 90%. CCF dijernihkan dengan filtrasi kedalaman multi-tahap, dengan CCF yang dihasilkan disimpan pada suhu –80°C. CCF dicairkan perlahan pada suhu ruangan dan kemudian disaring secara steril melalui membran polietersulfon (PES) 0,22 μm (Corning Inc., Corning, NY) sebelum digunakan.
2.2 Percobaan SPTFF
Percobaan prakonsentrasi dilakukan menggunakan membran polietersulfon serat berongga Revaclear 400 (Baxter, Deerfield, Il) berdasarkan hasil dari Yehl dan Zydney ( 2020 ). Modul ini memiliki luas permukaan total 1,8 m 2 , diameter dalam serat 190 μm, dan volume priming 93 mL seperti yang dilaporkan oleh produsen. Revaclear 400 memiliki berat molekul nominal yang dibatasi sekitar 30 kDa, dengan penolakan mioglobin sebesar 32% dan penolakan albumin sebesar >99% (lembar data Revaclear, Baxter Kidney Care, https://renalcareus.baxter.com/sites/g/files/ebysai3581/files/2023-05/US-RC38-230001%20V2%20-%20Revaclear%20300%20400%20and%20500%20Datasheet.pdf ). Laju aliran umpan dikontrol menggunakan pompa peristaltik Masterflex L/S (Cole-Parmer, Vernon Hill, IL), dengan laju aliran permeat diatur dengan menyesuaikan pompa kedua pada saluran keluar retentat. Kedua pompa dipasangi pipa Tygon long flexible life (E-LFL) (Cole-Parmer) untuk meminimalkan penyimpangan laju aliran dan mengurangi pembentukan partikel. Tekanan dipantau selama setiap percobaan menggunakan pengukur tekanan digital (Ashcroft, Stratford, CT) yang terletak langsung pada pipa saluran masuk/keluar. Tekanan transmembran (TMP) dievaluasi sebagai:
![]()
di mana P F , P R , P P1 , dan P P2 adalah tekanan umpan, retentat, dan permeat (pada saluran masuk dan keluar modul), masing-masing. Eksperimen dilakukan dengan modul serat berongga yang dipasang dalam orientasi vertikal, dengan umpan dimasukkan melalui port sisi lumen bawah sementara port permeat atas (sisi cangkang) ditutup seperti yang ditunjukkan pada Gambar 1 . Sebelum setiap eksperimen, modul membran dibilas dengan larutan 150 mM Phosphate-Buffered Saline (PBS) pada pH 7,5, berhati-hati untuk menghilangkan gelembung udara dari serat berongga dan tabung.
Percobaan fluks-stepping (Minervini dan Zydney 2022 ; Minervini et al. 2024 ) digunakan untuk menentukan faktor konsentrasi volume single-pass maksimum yang dapat dicapai (rasio antara laju aliran masuk umpan dan laju aliran keluar retentat). Percobaan dilakukan dalam mode total recycle menggunakan 2 L CCF dengan baik jalur keluar permeat dan retentat dikembalikan ke reservoir umpan yang diaduk untuk meminimalkan jumlah material yang diperlukan selama penelitian ini. CCF dimasukkan ke dalam sisi lumen modul membran serat berongga pada laju aliran umpan 60 mL/menit berdasarkan karya Yehl dan Zydney ( 2020 ). Fluks filtrat ditingkatkan secara bertahap setiap 60 menit, dan TMP direkam sebagai fungsi waktu pada setiap fluks (konstan). Selain itu, sampel umpan, retentat, dan permeat dikumpulkan pada akhir setiap langkah untuk analisis offline berikutnya seperti yang dibahas di Bagian 2.4 . Fluks filtrat pada awal pengotoran, umumnya disebut fluks kritis atau berkelanjutan (Chaubal dan Zydney 2023 ; Field et al. 1995 ), ditentukan pada titik di mana TMP menunjukkan peningkatan signifikan seiring waktu selama penyaringan fluks konstan.
Percobaan penyaringan jangka panjang juga dilakukan menggunakan modul serat berongga yang sama (dalam mode daur ulang total) pada faktor konsentrasi tetap 20x selama 24 jam. Modul baru yang segar digunakan untuk setiap percobaan.
2.3 Percobaan HPCMP
Percobaan HPCMP dilakukan menggunakan modul serat berongga kecil yang diproduksi oleh 3 M (Saint Paul, MN) dan dijelaskan lebih rinci oleh Mohammadzadehmarandi et al. ( 2023 ). Modul tersebut terdiri dari 26 serat berongga dengan panjang filtrasi efektif 23 cm, sehingga menghasilkan luas permukaan total 40 cm 2 . Modul baru digunakan untuk setiap percobaan.
CCF pekat 20x yang diperoleh dari SPTFF disaring secara steril melalui filter spuit PES 0,22 μm (Cytiva, Marlborough, MA) dan dimasukkan ke sisi lumen modul membran menggunakan pompa peristaltik Masterflex (Cole-Parmer) pada laju alir 0,005 mL/menit. Larutan penarikan, yang terdiri dari buffer PBS 150 mM pada pH 7,5, dimasukkan melalui port sisi cangkang di ujung terjauh dari saluran masuk umpan (yaitu, berlawanan arah dengan larutan CCF pekat seperti yang ditunjukkan pada Gambar 1 ) pada laju alir 0,02 mL/menit; penggunaan rasio aliran larutan penarikan terhadap larutan umpan sebesar α = 4 konsisten dengan penelitian eksperimental sebelumnya (Mohammadzadehmarandi et al. 2023 ) dan teoritis (Yehl dan Zydney 2022 ). Laju aliran larutan penarikan, baik yang masuk maupun yang keluar dari modul, dikontrol menggunakan satu pompa (Masterflex, Cole-Parmer) yang dilengkapi dengan dua kepala pompa untuk mempertahankan ultrafiltrasi bersih nol.
Modul serat berongga awalnya dibilas dengan air DI, dengan hati-hati untuk menghilangkan gelembung udara. Modul kemudian dibilas dengan PBS sebelum mengganti umpan ke larutan CCF yang telah dipekatkan sebelumnya. Tingkat ultrafiltrasi dipantau dengan mengukur perubahan berat umpan dan reservoir larutan penarik (ditempatkan pada neraca digital terpisah) selama percobaan. Laju aliran keluar retentat dan larutan penarik ditentukan dengan pengumpulan terjadwal. Sampel dikumpulkan secara berkala dari reservoir umpan, outlet larutan penarik, dan outlet larutan retentat untuk analisis offline.
Penggunaan modul serat berongga ini untuk pertukaran buffer diperiksa dengan melakukan percobaan terpisah menggunakan larutan penarik yang dicampur dengan 1 g/L vitamin B12 ( Caymen Chemicals, Ann Arbor, MI) sebagai zat terlarut model (1355 Da). Konsentrasi vitamin B12 dalam outlet retentat CCF dievaluasi dengan absorbansi UV pada 550 nm menggunakan pembaca mikroplat Infinite m200 Pro (Tecan Trading AG, Swiss). Kurva kalibrasi yang tepat dibuat menggunakan CCF prakonsentrasi yang dicampur dengan konsentrasi vitamin B12 yang diketahui untuk memastikan kuantifikasi vitamin B12 yang akurat dengan adanya mAb dan HCP.
2.4 Analisis
Konsentrasi mAb dievaluasi dengan kromatografi afinitas Protein A analitis menggunakan kolom POROS A 0,1 mL dengan partikel 20 µm (Thermo Fisher Scientific, Waltham, MA). Data diperoleh menggunakan Vanquish UHPLC, dengan konsentrasi protein ditentukan oleh absorbansi UV pada 280 nm yang dievaluasi oleh detektor susunan fotodioda (Thermo Fisher Scientific). Konsentrasi HCP dievaluasi menggunakan kit ELISA CHO generasi ke-3 (Cygnus Technologies, Southport, NC). Konsentrasi DNA dievaluasi menggunakan uji fluoresensi Qubit 1X dsDNA BR (Thermo Fisher Scientific).
Karakterisasi tambahan CCF dilakukan dengan kromatografi pengecualian ukuran (SEC) menggunakan sistem HPLC Agilent 1260 Infinity II (Agilent Scientific Instruments, Santa Clara, CA) yang dilengkapi dengan kolom Agilent Bio SEC-3 dengan partikel 3 µm yang memiliki ukuran pori 100 Å (Agilent Scientific Instruments). SEC dilakukan pada laju alir konstan 0,35 mL/menit dengan detektor UV-Vis pada 215 nm. Sampel terbatas juga diperiksa dengan SDS-PAGE menggunakan gel mini NuPAGE Novex Bis-Tris dengan NuPAGE MES SDS Running Buffer dan Imperial Protein Stain (semuanya dari Thermo Fisher Scientific).
3 Hasil dan Pembahasan
3.1 Konsentrasi CCF Menggunakan SPTFF
Kondisi operasi yang sesuai untuk TFF single pass berkelanjutan ditentukan oleh eksperimen flux-stepping; laju aliran umpan CCF ditetapkan pada 60 mL/menit berdasarkan hasil yang dilaporkan oleh Yehl dan Zydney ( 2020 ) untuk konsentrasi imunoglobulin G serum manusia. Data umum ditunjukkan pada Gambar 2. TMP (dari Persamaan 1 ) dan penurunan tekanan sisi umpan (∆ P = P F – P R ) keduanya ditunjukkan sebagai fungsi waktu, dengan setiap interval 60 menit pada sumbu x yang sesuai dengan operasi pada faktor konsentrasi volume single-pass yang konstan (diberi label langsung di atas data TMP). Dengan demikian, siklus awal pada 3x dilakukan dengan laju aliran umpan masuk 60 mL/menit dan laju aliran retentat (keluar) 20 mL/menit, yang sesuai dengan fluks permeat konstan 1,3 L/m 2 /jam. Meskipun percobaan flux-stepping dilakukan dalam mode daur ulang total, konsentrasi mAb dalam reservoir umpan menurun selama percobaan karena akumulasi mAb yang sangat terkonsentrasi dalam modul dan jalur daur ulang retentat. Misalnya, konsentrasi mAb awal adalah 4,0 g/L tetapi ini menurun menjadi sekitar 3 g/L untuk SPTFF pada faktor konsentrasi 10x dan kemudian menjadi 2,2 g/L setelah 360 menit. Konsentrasi mAb stabil dalam beberapa menit pertama operasi pada setiap faktor konsentrasi volume.
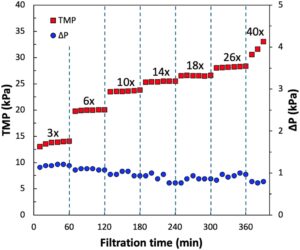
TMP sering menunjukkan sedikit peningkatan pada awal setiap filtrasi fluks konstan; ini paling menonjol untuk siklus awal pada 3x dan kemungkinan besar karena transien yang terkait dengan volume hold-up yang cukup besar dalam modul serat berongga. Penyeimbangan cepat konsisten dengan waktu tinggal yang sangat singkat (< 2 menit) dalam modul SPTFF. Dalam setiap kasus, TMP stabil selama siklus hingga faktor konsentrasi volume 26x (dengan gradien TMP < 1 kPa/jam). Namun, peningkatan lebih lanjut dalam faktor konsentrasi menjadi 40x mengakibatkan peningkatan kecil tetapi signifikan dalam TMP (dari 30 hingga 33 kPa selama 30 menit), yang sesuai dengan gradien TMP sekitar 6 kPa/jam. Peningkatan TMP ini kemungkinan besar karena akumulasi foulant pada atau di dalam membran dan menunjukkan bahwa tidak mungkin untuk melakukan SPTFF dalam kondisi ini untuk proses berkelanjutan yang diperpanjang tanpa penggantian membran yang sering. Penurunan tekanan aksial melalui modul tetap hampir konstan pada nilai sekitar 1 kPa selama percobaan fluks-stepping; sedikit penurunan dalam ∆P pada faktor konsentrasi yang sangat tinggi disebabkan oleh pengurangan besar dalam laju aliran umpan di paruh kedua modul. Tidak adanya peningkatan dalam ∆P menunjukkan bahwa penyumbatan serat dapat diabaikan dalam kondisi percobaan ini (Minervini et al. 2022 , 2024 ). Hasil langkah mAb, seperti yang ditentukan dari kromatografi Protein A analitis, adalah > 99% untuk semua kondisi operasi di bawah fluks kritis (atau faktor konsentrasi kritis), yang mencerminkan tidak adanya pengotoran yang signifikan dalam kondisi ini (Bacchin et al. 2006 ). Sampel permeat tidak menunjukkan bukti transmisi mAb melalui membran Revaclear (konsentrasi mAb kurang dari 0,01 g/L bahkan pada faktor konsentrasi tertinggi). Pengukuran ulang yang dilakukan pada CCF terpisah (dengan mAb berbeda) memberikan operasi yang stabil dengan faktor konsentrasi 30x seperti yang ditunjukkan dalam Informasi Pendukung.
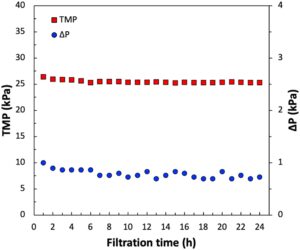
Bahasa Indonesia: Untuk memverifikasi bahwa kondisi yang diidentifikasi dalam percobaan flux-stepping akan memungkinkan operasi stabil jangka panjang dari modul SPTFF, percobaan filtrasi 24 jam dilakukan menggunakan 2 L CCF pada konsentrasi umpan 2,8 g/L dan laju aliran umpan 60 mL/menit. Faktor konsentrasi volumetrik dipertahankan pada 20x (berdasarkan hasil pada Gambar 2 ) dengan menyesuaikan laju aliran keluar retentat menjadi 3 mL/menit. Profil TMP dan ΔP ditunjukkan sebagai fungsi waktu pada Gambar 3. Tidak ada bukti adanya pengotoran, dengan TMP = 26 kPa dan Δ p = 0,8 kPa tetap konstan pada seluruh percobaan. Namun, penting untuk dicatat bahwa resirkulasi CCF memaparkan membran pada jumlah pengotor yang jauh lebih rendah; data yang diperoleh dalam operasi single-pass yang sebenarnya (memerlukan jumlah umpan yang jauh lebih besar) akan diperlukan untuk menunjukkan efektivitas proses ini untuk konsentrasi CCF jangka panjang. Konsentrasi mAb outlet tetap stabil pada 56 ± 0,5 g/L selama filtrasi 24 jam, menghasilkan hasil bertahap 100 ± 1% seperti yang ditentukan oleh kromatografi Protein A. Analisis SEC dari larutan produk akhir tidak menunjukkan bukti pembentukan agregat, dengan konsentrasi spesies MW tinggi (yang keluar sebelum mAb) < 5%, yang pada dasarnya identik dengan yang ada di CCF asli. Perhatikan bahwa ini kemungkinan mencakup agregat mAb serta komponen besar lainnya yang ada di CCF, misalnya, DNA dan kromatin. Filtrasi 24 jam yang diperiksa pada Gambar 3 akan mampu memproses hampir 90 L CCF, yang sesuai dengan 0,25 kg mAb, menggunakan modul membran serat berongga tunggal yang dioperasikan dalam mode single-pass tanpa resirkulasi umpan atau kebutuhan untuk pembersihan antara dan/atau regenerasi.
3.2 HPCMP untuk Pemurnian mAb
Proses SPTFF yang diperiksa pada Gambar 3 memberikan tingkat konsentrasi mAb yang signifikan, tetapi konsentrasi HCP berkurang < 15% karena retensi HCP yang tinggi oleh modul serat berongga. Untuk memperoleh pengurangan HCP yang signifikan, kami menggunakan Pemurnian Membran Lawan Arus Kinerja Tinggi (HPCMP) menggunakan membran dengan ukuran pori yang agak lebih besar (batas berat molekul nominal sekitar 50 kDa). Membran ini dioperasikan dengan transportasi difusif untuk meningkatkan selektivitas penghilangan HCP dibandingkan dengan apa yang dapat dicapai selama filtrasi yang digerakkan oleh tekanan (Mohammadzadehmarandi et al. 2023 ). Umpan ke modul HPCMP adalah larutan CCF terkonsentrasi 20 kali lipat dengan konsentrasi mAb ≈56 g/L dan kandungan HCP sedikit lebih dari 100.000 ppm (sebagaimana ditentukan oleh CHO ELISA). Sistem dioperasikan dalam mode lintasan tunggal sejati (tanpa daur ulang) pada laju aliran umpan 0,005 mL/menit, dengan nilai ini berdasarkan hasil yang dilaporkan oleh Mohammadzadehmarandi dkk. ( 2023 ). Volume penahanan dalam sistem sekitar 2 mL; dengan demikian, diperlukan waktu lebih dari 8 jam untuk membilas buffer keluar dari sistem. Konsentrasi mAb dalam aliran keluar produk tidak terdeteksi selama 6 jam pertama dan kemudian perlahan meningkat seiring waktu karena efek pengenceran dikombinasikan dengan dispersi dalam sistem.
Gambar 4 menunjukkan hasil yang diperoleh setelah pencucian lengkap buffer awal, dengan data ditampilkan untuk hasil langkah mAb (panel atas) dan konsentrasi HCP dalam ppm relatif terhadap mAb (panel bawah), dengan hasil langkah didefinisikan sebagai:
![]()
di mana q F dan q R masing-masing adalah laju aliran volumetrik umpan dan retentat sisi lumen, sementara C F dan C R adalah konsentrasi mAb dalam umpan dan retentat. Laju ultrafiltrasi bersih, ditentukan oleh pengukuran q R dan q F , kurang dari 5%. Konsentrasi mAb dalam keluar retentat tetap hampir konstan pada 52,5 ± 1,4 g/L, yang sesuai dengan hasil langkah mAb sebesar 94 ± 3%. Sebagian besar kehilangan mAb disebabkan oleh difusi ke dalam larutan penarikan, meskipun pada waktu operasi yang lama membran menjadi lebih retentif (karena pengotoran protein) dengan konsentrasi mAb dalam keluar larutan penarikan menurun menjadi < 0,1 g/L. Ini juga konsisten dengan pengurangan hampir 10 kali lipat dalam permeabilitas hidrolik untuk membran yang ditentukan pada akhir percobaan 36 jam (dievaluasi dari data untuk fluks buffer sebagai fungsi tekanan transmembran) dibandingkan dengan membran bersih. Tingkat pengotoran yang tinggi yang diamati dalam proses HPCMP kemungkinan disebabkan oleh tingginya tingkat DNA dalam CCF prakonsentrasi, sekitar 2.000.000 ppb, yang sebelumnya telah ditunjukkan sebagai pengotoran dominan selama operasi HPCMP (Mohammadzadehmarandi et al. 2023 ).
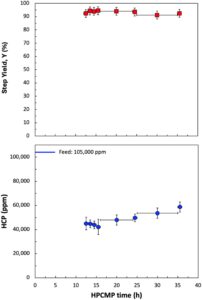
Konsentrasi HCP dalam produk retentat menurun dari 105.000 ± 2000 ppm dalam umpan menjadi 44.000 ± 5000 ppm untuk sampel yang diperoleh selama fase awal pengoperasian HPCMP; konsentrasi HCP meningkat menjadi 58.000 ± 4000 ppm untuk sampel retentat akhir yang diperoleh setelah 36 jam operasi berkelanjutan. Pengurangan pembersihan HCP lagi-lagi disebabkan oleh pengotoran, dengan membran menjadi agak lebih retentif terhadap HCP selama percobaan 36 jam. Karena HPCMP dijalankan pada ultrafiltrasi sekitar nol, TMP pada dasarnya nol selama proses. Penurunan tekanan sisi umpan untuk percobaan ini tetap hampir konstan selama 36 jam dengan ∆ p < 0,1 kPa karena laju aliran umpan yang sangat rendah. HPCMP juga menghasilkan penghilangan DNA yang signifikan, dengan konsentrasi DNA menurun dari sekitar 10.000.000 ppb dalam umpan menjadi hanya 300.000 ± 20.000 ppb dalam produk retentat (konsentrasi relatif terhadap mAb). Pengurangan DNA sebanyak 30 kali lipat ini disebabkan oleh penghilangan DNA, dengan DNA yang terdeteksi dalam larutan penarik dari HPCMP, selain penyerapan/deposisi DNA pada permukaan membran.
3.3 Pertukaran Buffer
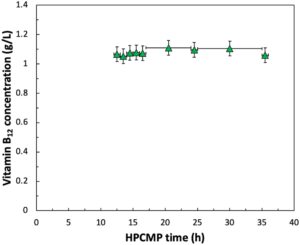
Bahasa Indonesia: Selain menyediakan HCP yang signifikan dan penghilangan zat terlarut yang kecil, proses HPCMP juga dapat menyediakan pertukaran buffer yang sebenarnya, dengan karakteristik larutan CCF prakonsentrasi yang disesuaikan berdasarkan komposisi larutan penarikan. Ini diperiksa secara eksperimental dengan melakukan percobaan terpisah di mana larutan penarikan dalam proses HPCMP dicampur dengan vitamin B12 pada konsentrasi 1 g/L, dengan hasil yang disajikan dalam Gambar 5. Konsentrasi vitamin B12 dalam outlet retentat (produk) selama proses HPCMP 36 jam tetap hampir konstan pada nilai 1,1 ± 0,1 g/L, yang sesuai dengan > 99% pertukaran buffer. Pendekatan ini dapat dengan mudah digunakan untuk menyesuaikan pH, konduktivitas, dan/atau konsentrasi eksipien sebelum langkah pemrosesan hilir berikutnya. Studi sebelumnya dari membran serat berongga serupa menunjukkan operasi yang stabil selama dialisis darah selama lebih dari 96 jam (Pannu dan Gibney 2020 ), yang menunjukkan bahwa mungkin saja untuk mengoperasikan modul-modul ini untuk jangka waktu yang lebih lama.
3.4 Kinerja Proses Terintegrasi
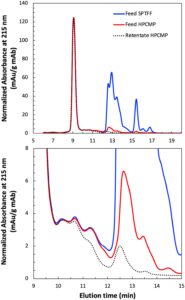
Kinerja kombinasi SPTFF-HPCMP diperiksa lebih rinci oleh SEC dan SDS-PAGE, dengan hasil dirangkum dalam Gambar 6 dan 7 , masing-masing. Bahan umpan asli (kurva biru pada Gambar 6 ) menunjukkan puncak yang kuat untuk mAb pada 9,2 menit, dengan konsentrasi spesies MW rendah yang signifikan dengan waktu elusi antara 12 dan 17 menit. Perhatikan bahwa ribonuclease A (MW = 13,7 kDa) memiliki waktu elusi 11,9 menit, sehingga puncak pada waktu elusi di luar 12 menit adalah spesies MW yang relatif rendah, termasuk banyak komponen media (misalnya, asam amino). Panel bawah Gambar 6 menunjukkan gambar yang diperbesar dari kromatogram SEC di wilayah yang ditempati oleh HCP. SPTFF sangat efektif dalam menghilangkan spesies dengan waktu elusi > 14 menit tetapi memberikan penghilangan HCP minimal dengan waktu elusi < 13 menit. Namun, proses gabungan SPTFF-HPCMP menghasilkan penghilangan lengkap semua puncak dengan waktu retensi > 13,5 menit dan sekitar 60% pengurangan total HCP berdasarkan luas puncak terintegrasi antara 9,8 dan 13 menit.
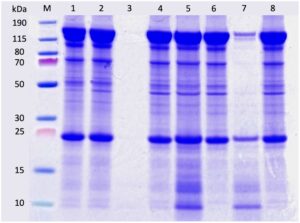
Hasil SDS-PAGE (kondisi non-denaturasi) disajikan dalam Gambar 7. Umpan CCF asli (Jalur 1 dan 2) menunjukkan pita yang jelas pada 150 kDa, yang sesuai dengan mAb, bersama dengan berbagai macam HCP dengan MW yang membentang dari 10 hingga 100 kDa. Pita terkait pengotor yang paling menonjol diamati pada MW sekitar 25, 70, dan 100 kDa. Sampel permeat dari SPTFF (Jalur 3) menunjukkan pita samar di bawah 25 kDa, sesuai dengan pemurnian terbatas yang dicapai melalui penyaringan yang digerakkan oleh tekanan. Retentat yang diperoleh dari tahap awal proses HPCMP (jalur 6) menunjukkan pengurangan yang signifikan dalam HCP dengan MW < 25 kDa, konsisten dengan intensitas pita yang lebih besar dalam rentang ini untuk sampel yang sesuai dari larutan penarikan di Jalur 5). Perhatikan bahwa sampel dari larutan penarikan yang diperoleh selama fase awal proses menunjukkan jumlah mAb yang signifikan tetapi jumlah ini menurun pada tahap akhir proses (Jalur 7 dan 8).
Kinerja proses SPTFF-HPCMP dirangkum dalam Tabel 1. Konsentrasi mAb ditingkatkan dari 2,8 menjadi 52,5 g/L dengan hasil keseluruhan 94 ± 3%, sebagian besar karena kehilangan hasil kecil selama HPCMP. Konsentrasi HCP dikurangi dari 120.000 ± 2.000 menjadi 49.000 ± 10.000 ppm (berdasarkan ELISA), yang sesuai dengan nilai reduksi log LRV = 0,4 ± 0,1, dengan sebagian besar terjadi dalam proses HPCMP. Pembersihan molekul kecil secara keseluruhan (ditentukan oleh luas puncak SEC untuk waktu elusi dari 14 hingga 17 menit) lebih dari 99%. Kandungan DNA juga menurun secara signifikan, dari tingkat awal sekitar 10.000.000 menjadi 300.000 ± 20.000 ppb, yang sesuai dengan LRV = 1,5 ± 0,1. Penurunan DNA yang tidak terduga ini kemungkinan disebabkan oleh penghilangan DNA dan penyerapan/pengendapan pada permukaan membran selama proses SPTFF dan HPCMP.
| Konsentrasi mAb (g/L) | Jumlah HCP (ppm) | DNA (ppb) | |
|---|---|---|---|
| CCF | 2.8 | 120.000 ± 2000 | 10.000.000 ± 800.000 |
| Produk SPTFF | 56 ± 0,5 | 105.000 ± 2000 | 2.000.000 ± 200.000 |
| Produk HPCMP | 52,5 ± 1,4 | 49.000 ± 10.000 | 300.000 ± 20.000 |
Parameter operasional untuk proses SPTFF-HPCMP kontinu terintegrasi yang diperiksa dalam studi ini dirangkum dalam Tabel 2. Perhitungan dilakukan berdasarkan aliran keluar bioreaktor perfusi 500 L yang beroperasi dengan satu pertukaran volume per hari dan titer mAb 2,8 g/L (mengabaikan efek dari setiap pendarahan sel). Proses SPTFF untuk konsentrasi CCF 20 kali lipat menggunakan fluks umpan 12 L/m2 / jam memerlukan sekitar 10 m2 luas permukaan membran. Ini sesuai dengan enam kartrid serat berongga secara paralel, masing-masing dengan biaya individu sekitar $30/modul. Ini menghasilkan biaya sekitar $0,13/g mAb untuk modul membran dengan asumsi 24 jam operasi kontinu; ini akan dikurangi menjadi < $0,02/g mAb jika proses SPTFF dapat dijalankan selama ≥ 7 hari. Pengurangan biaya lebih lanjut dapat dicapai dengan membersihkan dan menggunakan kembali modul membran.
| SPTF (20x) | HPCMP | Dialisis | |
|---|---|---|---|
| Laju aliran umpan (L/jam) | 21 | 1 | 1 |
| Fluks umpan (L/m2 / jam) | 12 | 0,075 | 0.4 |
| Konsentrasi pakan (g mAb/L) | 2.8 | 56 | 56 |
| Luas membran (m 2 ) | 10 | 14 | 3 |
| Kapasitas membran (kg/m 2 ) | 1 | 0.7 | 3 |
| Buffer yang dibutuhkan (L/kg mAb) | — | 76 | 38 |
Proses HPCMP dilakukan pada fluks umpan 0,075 L/m 2 /jam. Umpan terkonsentrasi 20x dari proses SPTFF akan memiliki laju alir 1,0 L/jam; dengan demikian, proses HPCMP akan memerlukan sekitar 14 m 2 total luas membran dan akan menggunakan 76 L buffer/kg mAb, yang hanya sebagian kecil dari proses mAb yang umum, yang dapat mencapai 25.000 L/kg buffer (Budzinski et al. 2019 ).
Meskipun fluks umpan rendah dalam proses HPCMP diperlukan untuk mencapai tingkat penghilangan HCP yang tinggi, pertukaran buffer tingkat tinggi dapat dicapai dengan menggunakan laju aliran umpan yang jauh lebih tinggi (waktu tinggal yang lebih singkat). Efisiensi pertukaran buffer untuk kontaktor arus balik dapat dievaluasi sebagai (Yehl dan Zydney 2022 ):
![]()
di mana C R dan C D0 adalah konsentrasi larutan di saluran keluar retentat dan saluran masuk larutan penarikan, masing-masing, α adalah rasio laju aliran penarikan terhadap umpan, k 0 adalah koefisien perpindahan massa zat terlarut keseluruhan, dan A adalah luas permukaan membran. Hasil sebelumnya menunjukkan koefisien perpindahan massa vitamin B 12 sebesar k 0 = 3,5 ∗ 10 −7 m/s (Yehl et al. 2019 ); nilai ini juga konsisten dengan data pada Gambar 5 . Koefisien perpindahan massa keseluruhan untuk HCP jauh lebih kecil, yang mencerminkan difusivitas yang lebih kecil dan hambatan yang lebih besar terhadap difusi melalui pori-pori membran. Berdasarkan Persamaan ( 3 ), proses HPCMP dengan efisiensi pertukaran buffer sebesar 95% dapat dicapai dengan menggunakan fluks umpan sebesar q F /A = 0,4 L/m 2 /jam. Perhatikan bahwa koefisien perpindahan massa untuk komponen penyangga umum (misalnya, NaCl atau histidin) akan beberapa kali lipat lebih besar daripada vitamin B12 , yang memungkinkan pengoperasian proses HPCMP pada fluks umpan jauh di atas 1 L/m2 / jam dan/atau pada laju aliran larutan penarikan yang lebih kecil.
4 Kesimpulan
Hasil yang disajikan dalam studi ini dengan jelas menunjukkan kelayakan penggunaan proses SPTFF-HPCMP terintegrasi untuk praperlakuan CCF sebelum operasi hilir berikutnya. Modul SPTFF dioperasikan terus-menerus (tanpa pembersihan/regenerasi antara) selama 24 jam pada faktor konsentrasi volume 20x, menghasilkan konsentrasi mAb sebesar 56 g/L. Ini jauh melampaui < 10 g/L yang diperoleh dalam penelitian sebelumnya oleh Brinkmann dan Elouafiq ( 2021 ), Brinkmann dkk. ( 2018 ), dan Rahane dkk. ( 2024 ). Percobaan HPCMP yang dilakukan menggunakan CCF prakonsentrasi dengan rasio laju alir penarikan ke umpan α = 4 menghasilkan hasil langkah mAb sebesar 94 ± 3%, pengurangan HCP sekitar 60 ± 8% (ditentukan oleh CHO ELISA), dan pengurangan DNA lebih dari 30 kali lipat (ditentukan oleh uji Qubit) sementara secara bersamaan melakukan pertukaran buffer yang hampir lengkap; ini adalah demonstrasi pertama HPCMP yang berhasil dengan CCF prakonsentrasi. Meskipun HPCMP menunjukkan pembersihan terbatas HCP MW tinggi, ia secara efektif menghilangkan hampir semua pengotor dengan MW di bawah 25 kDa, sebagaimana dikonfirmasi oleh analisis SEC dan SDS-PAGE. Penelitian masa depan menggunakan analisis proteomik, misalnya, dengan LC-MS, dapat digunakan untuk mengidentifikasi protein-protein yang dihilangkan, dan tidak dihilangkan oleh HPCMP. Perhatikan bahwa penghilangan HCP sedikit menurun sepanjang proses berkelanjutan 36 jam akibat pengotoran membran, yang kemungkinan terkait dengan kandungan DNA tinggi dalam CCF pekat.
Proses SPTFF-HPCMP terpadu akan sangat menarik sebelum operasi hilir berikutnya yang memiliki efisiensi lebih besar saat dioperasikan pada konsentrasi mAb tinggi. Misalnya, peningkatan 20 kali lipat dalam konsentrasi mAb akan secara dramatis mengurangi buffer yang diperlukan untuk mencuci fase padat dalam presipitasi/kristalisasi berkelanjutan, sementara pada saat yang sama mengurangi massa eksipien (per satuan massa mAb) yang diperlukan untuk proses tersebut karena pergeseran dalam keseimbangan protein. Misalnya, Mergy et al. ( 2024 ) telah memperoleh data awal yang menunjukkan bahwa proses hilir yang menggabungkan presipitasi mAb ditambah dua langkah kromatografi aliran-melalui (tanpa langkah afinitas apa pun) dapat memberikan HCP dan penghilangan DNA yang serupa sebagai proses platform yang menggunakan kromatografi pengikatan dan elusi Protein A. Selain itu, pertukaran buffer yang disediakan oleh HPCMP memastikan eliminasi komponen pengganggu kecil, sambil menyediakan penyesuaian pH dan konduktivitas yang diperlukan dan memungkinkan standarisasi kondisi presipitasi/kristalisasi dengan konsentrasi presipitan yang berkurang (Zhu et al. 2025 ). Praperlakuan terpadu ini juga akan secara signifikan meningkatkan kinerja langkah-langkah kromatografi aliran-melalui, baik dengan mengurangi volume proses dan menurunkan jumlah pengotor HCP/DNA. Studi masa depan akan diperlukan untuk mengevaluasi ekonomi/kinerja keseluruhan proses hilir yang menggabungkan praperlakuan CCF dengan kombinasi SPTFF + HPCMP, dan juga penting untuk mengeksplorasi integrasi teknologi ini dengan bioreaktor perfusi (dengan daur ulang dan klarifikasi sel yang sesuai) sebagai bagian dari proses produksi mAb yang benar-benar berkelanjutan/saling berhubungan.




Tinggalkan Balasan