ABSTRAK
Rekayasa protein Bifidobacterium adolescentis sucrose phosphorylase ( Ba SucP) sebelumnya telah mengidentifikasi varian enzim P134Q untuk glikosilasi selektif lokasi pada 2-OH gliserol. Selain peningkatan selektivitas, P134Q- Ba SucP juga melibatkan peningkatan afinitas untuk gliserol sebagai sifat biokimia yang berpotensi penting untuk produksi 2- O -α-glukosil gliserol (2GG), bahan perawatan kulit yang dikomersialkan untuk aplikasi kosmetik. Di sini, kami melakukan evaluasi berbasis model kinetik terperinci dari P134Q- Ba SucP dalam analisis laju awal dan waktu reaksi penuh untuk mendapatkan interpretasi mekanistik dan penilaian komprehensif dari peningkatan proses yang dapat dicapai oleh varian P134Q dibandingkan dengan enzim asli. Kami menunjukkan bahwa P134Q- Ba SucP melibatkan reaktivitas ∼50 kali lipat lebih rendah dengan fosfat dibandingkan dengan enzim asli. Efeknya kemungkinan muncul dari fleksibilitas konformasi yang menurun dari kantong pengikat substrat dalam varian P134Q yang juga dapat berfungsi untuk membatasi posisi gliserol untuk glikosilasi. Reaktivitas gliserol menurun ∼1,3 kali lipat dalam P134Q- Ba SucP; namun karena reaktivitas hidrolitik diturunkan lebih jauh (tiga kali lipat), efisiensi transfer ke gliserol dari varian tersebut ditingkatkan ∼dua kali lipat dibandingkan dengan enzim asli. Penghambatan produk oleh 2GG menurun ∼tiga kali lipat dalam P134Q- Ba SucP. Sifat-sifat P134Q- Ba SucP ini bergabung menjadi manfaat utama untuk sintesis 2GG dalam hal produktivitas dan hasil produk. Analisis jendela operasi berbasis model untuk produksi 2GG dari sukrosa dan gliserol selanjutnya mengungkapkan potensi signifikan untuk menghemat kelebihan gliserol yang digunakan dalam proses yang dihasilkan dari penggantian Ba SucP tipe liar dengan varian P134Q. Secara kolektif, penelitian ini menunjukkan interaksi penting antara rekayasa enzim dan reaksi dalam optimalisasi produksi glikosida melalui transglikosilasi biokatalitik.
Singkatan
Tanggal 2GG
2- O -α- d -glukosil gliserol
Ba SucP
SucP dari Bifidobacterium remaja
G1P
α- d -glukosa 1-fosfat
GG
α- d -glukosil gliserol
GLC
glukosa
GOH
gliserin
Pi
fosfat
Suk
sukrosa
SucP
sukrosa fosforilase
Berat Badan
enzim tipe liar
1 Pendahuluan
Glikosilasi adalah transformasi sintetis penting dalam produksi industri glikosida dan oligosakarida (de Roode et al. 2003 ; Seibel dan Buchholz 2010 ). Enzim adalah katalis kuat yang mendorong glikosilasi dengan efisiensi dan selektivitas tinggi (Desmet et al. 2012 ; Li et al. 2022 ; Nidetzky et al. 2018 ). Di antara kelas enzim yang dikenal untuk glikosilasi (glikosiltransferase EC 2.4; hidrolase glikosida EC 3.2), yang disebut transglikosidase telah menerima minat khusus untuk aplikasi industri berdasarkan teknologi proses kuat yang dimungkinkan oleh enzim ini (Franceus dan Desmet 2020 ; Mészáros et al. 2021 ; Moulis et al. 2021 ). Transglikosidase adalah hidrolase glikosida yang mengkatalisis transformasi satu glikosida menjadi glikosida lainnya. Reaksi mereka menggunakan substrat glikosida (disebut “donor”) untuk mengglikosilasi substrat kedua (disebut “akseptor”). Menjadi hidrolase glikosida berdasarkan asal evolusi dan mekanisme yang digunakan, transglikosidase juga mengkatalisis hidrolisis glikosida (Mészáros et al. 2021 ; Moulis et al. 2021 ). Oleh karena itu, menekan hidrolisis substrat donor dan/atau produk glikosida merupakan tujuan yang sangat penting dalam bidang ini (Adlercreutz 2017 ; Bissaro et al. 2015 ; Danby dan Withers 2016 ; de Roode et al. 2003 ). Sejumlah besar studi rekayasa protein sebelumnya bertujuan untuk menciptakan transglikosidase yang kekurangan hidrolisis untuk meningkatkan sintesis glikosida (Bissaro et al. 2015 ; David et al. 2019 ; Lundemo et al. 2017 ; Teze et al. 2014 ; Teze et al. 2021 ). Demikian pula dalam rekayasa reaksi, banyak studi menggambarkan intensifikasi proses dengan menargetkan kondisi (“jendela proses”) hidrolisis rendah dalam ruang parameter keseluruhan transformasi yang digunakan (Chen et al. 2020 ; Fagundes et al. 2022 ; Guerrero et al. 2015 ; Hoffmann et al. 2020 ; Klimacek et al. 2020 ; Sigg et al. 2021 ; Vera et al. 2016 ). Pendekatan terpadu yang menggabungkan rekayasa protein dan reaksi untuk optimasi proses masih kurang dieksplorasi (Ruzic et al. 2020 ; Schmölzer et al. 2019 ; Zeuner et al. 2014 ; Zeuner et al. 2019). Interaksi produktif faktor molekuler dan faktor terkait proses dari efisiensi konversi, bagaimanapun, penting untuk kinerja glikosilasi enzimatik yang unggul. Memahami interkoneksi penting karakteristik enzim dan parameter reaksi dalam berkontribusi pada efisiensi proses keseluruhan adalah pusat pada semua tahap pengembangan (Klimacek et al. 2020 ). Ini memberikan dasar penting untuk pengambilan keputusan proses, termasuk pemilihan biokatalis yang paling cocok dari serangkaian enzim transglikosidase yang tersedia. Di sini, kami menunjukkan semacam pendekatan rekayasa terintegrasi untuk peningkatan produksi 2- O -α- d -glukosil gliserol (2GG) melalui glikosilasi langsung gliserol dari sukrosa (Goedl et al. 2008 ; Klimacek et al. 2020 ; Sigg et al. 2021 ). 2GG adalah osmolit alami yang diproduksi secara industri melalui proses transglikosidase yang analog dengan yang diteliti di sini (Kruschitz dan Nidetzky 2022 ; Luley-Goedl et al. 2010 ). 2GG telah dikomersialkan sebagai bahan perawatan kulit untuk aplikasi kosmetik. Enzim yang digunakan untuk mensintesis 2GG adalah sukrosa fosforilase (SucP; EC 2.4.1.7), suatu transglikosidase dari famili CAZy GH13 (Franceus dan Desmet 2020 ). Baru-baru ini, rute biokatalitik alternatif untuk 2GG diusulkan yang berlangsung melalui perantara α- d -glukosa 1-fosfat (G1P), yang dihasilkan oleh SucP dan digunakan oleh fosforilase glukosilgliserol spesifik (Franceus et al. 2018 ; Zhang et al. 2022 ; Zhang et al. 2020 ). Rute satu pot dua enzim tidak dibahas di sini.
Gambar 1A menunjukkan reaksi utama yang dikatalisis oleh SucP dengan sukrosa (Suc) sebagai donor (Vyas dan Nidetzky 2023 ). Ini semua dimulai dengan pembentukan perantara enzim β-glukosil kovalen sebagai langkah pertama yang umum, tetapi menyimpang pada langkah kedua. Dalam reaksi asli, yang sering disebut fosforolisis, perantara bereaksi dengan fosfat untuk menghasilkan G1P. Fosforolisis keseluruhan adalah proses yang dapat dibalik secara bebas. Dalam transglikosilasi untuk menghasilkan 2GG, reaksi dilakukan dengan gliserol (GOH) sebagai akseptor dan tidak ada fosfat yang ada. Pembentukan 2GG hanya dapat dibalik secara lemah dibandingkan dengan pembentukan G1P (Sigg et al. 2021 ). Selama hidrolisis, perantara bereaksi dengan air, yang merupakan satu-satunya reaksi tanpa adanya akseptor. Ini dapat direduksi menjadi reaksi sampingan belaka ketika akseptor hadir pada konsentrasi yang sesuai. Gliserol jauh (≥ 10 3 kali lipat) kurang efisien daripada fosfat dalam menekan hidrolisis dan harus hadir dalam konsentrasi yang sangat tinggi (≥ 1 mol/L), biasanya lebih banyak daripada sukrosa yang digunakan selama produksi 2GG (Goedl et al. 2008 ; Klimacek et al. 2020 ; Sigg et al. 2021 ). Kami kembali ke poin ini nanti dalam makalah ini saat membahas jendela proses untuk produksi 2GG.
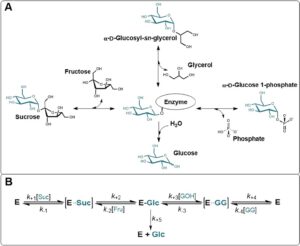
Enzim SucP yang dikarakterisasi dengan baik untuk sintesis 2GG terbagi menurut karakteristik regioselektivitas gliserol dan stabilitas suhu. Enzim dari Leuconostoc mesenteroides ( Lm SucP) menghasilkan hampir secara eksklusif 2GG yang diinginkan (≥ 90%), sedangkan enzim dari Bifidobacterium adolescentis ( Ba SucP) menghasilkan campuran ~2:1 dari 2- dan 1-isomer (1GG) dari O -α- d -glucosyl gliserol (Franceus et al. 2021 ; Schwaiger et al. 2021 ). Campuran regio-isomerik dari total produk selanjutnya disebut GG. Mengenai stabilitas suhu, Ba SucP jauh lebih kuat daripada Lm SucP. Dalam upaya untuk menggabungkan kedua sifat yang diinginkan menjadi satu enzim, Ba SucP mengalami rekayasa ekstensif (Franceus et al. 2021 ). Varian P134Q diidentifikasi karena regioselektivitas gliserolnya yang unggul (∼88% 2GG) yang mendekati Lm SucP. Yang penting, termostabilitas tipe liar dipertahankan dalam P134Q- Ba SucP. Varian P134Q juga menunjukkan peningkatan sifat kinetik untuk gliserol ( Km diturunkan 5,5 kali lipat; Vmax / Km meningkat 21 kali lipat) . Oleh karena itu , secara keseluruhan, P134Q- Ba SucP muncul sebagai kandidat yang menjanjikan untuk produksi 2GG (Franceus et al. 2021 ). Kami mencatat bahwa kemajuan juga telah dibuat dalam merekayasa Lm SucP untuk termostabilitas (Ma et al. 2024 ; Yang et al. 2022 ). Namun, masih ada kesenjangan besar dalam termotoleran antara kedua enzim tersebut. Misalnya, varian Lm SucP V23L dan V23L/S424R yang baru-baru ini dilaporkan menunjukkan waktu paruh sekitar 1 jam pada 50°C (Yang et al. 2022 ), sedangkan P134Q-BaSucP mempertahankan semua aktivitas selama setidaknya 3 hari pada suhu tersebut. Baru-baru ini, rekayasa regioselektivitas 2-OH dalam gliserol dari SucP dari Limosilactobacillus reuteri dilaporkan. Zhu et al. ( 2025 ) menunjukkan varian ganda (R137M/L337T) dari enzim dengan selektivitas yang jauh lebih baik (98,0%) dibandingkan dengan SucP asli (84,7%). Stabilitas Li . reuteri belum dipelajari secara rinci sejauh pengetahuan kami.
Studi terkini P134Q- Ba SucP dibangun di atas Sigg et al. ( 2021 ), yang menyajikan model kinetika hibrida terperinci untuk glikosilasi gliserol dari sukrosa pada konsentrasi substrat yang relevan secara industri. Istilah hibrida digunakan untuk menunjukkan perluasan tingkat mikroskopis dari model kinetika berbasis mekanisme untuk reaksi enzimatik (Gambar 1B ; Klimacek et al. 2020 ) dengan deskripsi empiris dari efek zat terlarut umum dari substrat dan produk yang digunakan pada konsentrasi molar. Model hibrida terbukti menyajikan alat rekayasa yang kuat untuk penilaian ketat Lm SucP dan Ba SucP mengenai produksi GG. Dalam studi mereka, Sigg et al. memberikan peringatan tentang penggunaan parameter kinetika sederhana dari karakterisasi laju awal (misalnya, K m ) untuk memprediksi efisiensi konversi enzim. Oleh karena itu, di sini kami memutuskan untuk mengevaluasi P134Q- Ba SucP dengan cara yang ekstensif seperti yang ditunjukkan sebelumnya untuk enzim tipe liar. Hasil karakterisasi terperinci berdasarkan model kinetik P134Q- Ba SucP dalam analisis laju awal dan waktu reaksi penuh disajikan. Temuan ini memberikan interpretasi mekanistik yang ditingkatkan dari konsekuensi substitusi yang diarahkan pada lokasi dalam Ba SucP dan memungkinkan penilaian komprehensif dari peningkatan proses yang dapat dicapai oleh varian P134Q. Secara keseluruhan, kami menunjukkan bagaimana regioselektivitas gliserol yang ditingkatkan dan perubahan halus lainnya dalam sifat kinetik P134Q- Ba SucP berpadu menjadi manfaat signifikan untuk produksi 2GG yang dianalisis dalam reaksi skala kecil. Kelayakan peningkatan skala reaksi enzimatik dengan transfer ke proses industri ditunjukkan untuk produksi 2GG menggunakan Lm SucP sebagai biokatalis (Kruschitz dan Nidetzky 2022 ; Luley-Goedl et al. 2010 ).
2 Bahan dan Metode
2.1 Bahan yang Digunakan
Bahan kimia dengan kemurnian tertinggi tersedia dari Sigma-Aldrich (Wina, Austria) atau Carl Roth (Karlsruhe, Jerman). WT- Ba SucP yang dimurnikan (pengidentifikasi GenBank AF543301.1) dan P134Q- Ba SucP (Franceus et al. 2021 ) disiapkan dengan metode yang dilaporkan dalam Klimacek et al. ( 2020 ) dan referensi yang dikutip di dalamnya. Secara singkat, enzim diperoleh dari kultur overekspresi Escherichia coli dan dimurnikan melalui tag His C-terminalnya. Aktivitas enzim standar (U, unit) merujuk pada uji aktivitas yang dilakukan pada suhu 30°C dalam buffer MES 50 mM (pH 7,0). Suc (20 mM) dan GOH (2,0 M) digunakan sebagai substrat, dan pelepasan fruktosa (Fru) diukur secara enzimatik dalam sampel yang diambil dari reaksi pada beberapa waktu (5, 10, 15, 25, dan 40 menit; lihat Bagian 2.2 di bawah). Laju ditentukan dari perubahan linier [Fru] terhadap waktu. Satu U (unit) adalah jumlah enzim yang melepaskan 1 µmol Fru/menit dalam kondisi standar. Preparasi murni WT- Ba SucP dan P134Q- Ba SucP menunjukkan aktivitas spesifik masing-masing sebesar 15,3 (±1,1; N = 2) dan 11,4 (±0,2; N = 2) U/mg.
2.2 Reaksi Enzimatik
Reaksi dilakukan pada suhu 30°C dalam buffer MES 50 mM (pH 7,0) menggunakan tabung Eppendorf (volume cairan 1,5 mL) yang diinkubasi pada Eppendorf ThermoMixer C dengan pengadukan pada 750 rpm. Sampel (200 μL) diambil pada waktu yang tepat dan didinginkan dalam volume yang sama dari buffer MES yang dipanaskan terlebih dahulu (99°C). Sampel segera dipindahkan ke dalam penangas air mendidih selama 10 menit tambahan untuk inaktivasi panas. Setelah sentrifugasi, sampel disimpan pada suhu -20°C hingga dilakukan analisis lebih lanjut.
2.3 Tarif Awal
Reaksi yang dianalisis adalah sebagai berikut: fosforolisis Suc; transfer ke GOH; dan hidrolisis (lihat Gambar 1 ). Untuk transfer ke GOH dan hidrolisis, Suc dan G1P digunakan sebagai donor. Konsentrasi substrat yang digunakan ditunjukkan segera dengan hasilnya. Inkubasi dilakukan seperti yang dijelaskan dalam Bagian 2.2 . Reaksi enzimatik. Hingga lima sampel ditarik dalam 40 menit reaksi. WT- Ba SucP dan P134Q- Ba SucP diaplikasikan pada 2–8 µg/mL dan 5–47 µg/mL, masing-masing. Konsentrasi enzim divariasikan untuk memperhitungkan perubahan aktivitas tergantung pada reaksi yang dianalisis. Konversi substrat dibatasi hingga di bawah 15%.
Produk atau produk-produk yang dilepaskan dalam reaksi masing-masing ditentukan dengan uji fotometrik menggunakan spektrofotometer Beckman Coulter DU 800. Uji yang digunakan dijelaskan secara ringkas dalam Klimacek et al. ( 2020 ) dan Informasi Pendukung yang terkait dengan makalah tersebut. Fosforolisis Suc dipantau dengan pelepasan G1P (uji enzimatik; Vyas dan Nidetzky 2023 ). Pelepasan glukosa (uji enzimatik) diukur sebagai tambahan untuk mencatat hidrolisis yang menyertainya. Transfer ke GOH dari Suc dipantau dengan pelepasan Fru dan glukosa (Glc), diukur dengan uji enzimatik. Transfer ke GOH dari G1P dipantau dengan pelepasan fosfat (Pi; uji kimia kolorimetrik; Vyas dan Nidetzky 2023 ) dan Glc.
Laju awal volumetrik [mM/menit] ditentukan dari rangkaian waktu linier pelepasan produk. Laju ini dibagi dengan konsentrasi molar enzim yang digunakan untuk memperoleh frekuensi pergantian nyata [1/dtk]. Konsentrasi molar enzim dihitung dari konsentrasi protein dengan massa molar enzim 56 kDa (Schwaiger et al. 2021 ). Protein diukur dengan uji Bradford yang direferensikan terhadap BSA.
2.4 Parameter Kinetik

2.5 Kursus Waktu Reaksi
Percobaan dilakukan pada konsentrasi Suc (≥ 300 mM) dan [GOH] (≥ 1,0 M) yang relevan untuk produksi industri 2GG. Enzim diaplikasikan pada aktivitas volumetrik konstan 3,7 U/mL (uji standar). Enzim terbukti stabil selama percobaan konversi. Percobaan dilakukan seperti yang dijelaskan dalam Bagian 2.2 . Reaksi enzimatik. Sampel dianalisis dengan HPLC menggunakan sistem Merck Hitachi L-7100 (Merck) yang dilengkapi dengan deteksi indeks bias dan dioperasikan dengan kolom YMC-Pack Polyamine II/S-5 µm/12 nm (YMC). Semua reaktan (yaitu, Suc, GOH, Fru, Glc, 1GG, 2GG) dikuantifikasi. Sistem ini digunakan dalam mode isokratik (asetonitril:air, rasio volume 3:1) pada suhu sekitar dan dengan laju aliran 1 mL/menit (Kruschitz dan Nidetzky 2020 ).
2.6 Pemodelan Struktur Enzim
Struktur kristal WT- Ba SucP (pdb: 2GDV) mengandung β- d -glukosa terikat (Mirza et al. 2006 ). Yasara v. 18.2.7 (Land dan Humble 2018 ) digunakan untuk mengubah β- d -glukosa menjadi G1P. Pose G1P dioptimalkan dengan minimisasi energi global dengan medan gaya AmberFB-15 (Stoppelman et al. 2021 ). Hasilnya sesuai dengan model sebelumnya dari Mirza et al. ( 2006 ).
2.7 Pemasangan Model Kinetik
Model kinetik hibrida yang digunakan (Sigg et al. 2021 ) ditunjukkan pada Informasi Pendukung S1: Tabel S1 . Model tersebut dipasang pada data gabungan dari pengukuran laju awal dan waktu tempuh P134Q- Ba SucP menggunakan prosedur bertahap dari Sigg et al. ( 2021 ). Secara singkat, langkah pertama melibatkan pemasangan data laju awal reaksi maju, yaitu ketergantunganpersamaan matematikapada [Suc] dan [GOH],persamaan matematikapada [Suc], danpersamaan matematikapada [GOH], menggunakan add-in Microsoft Excel Solver. Pengaturan Solver terperinci dirangkum dalam Sigg et al. ( 2021 ). Hasil dari eksperimen laju awal bersama dengan parameter kinetik dari kecocokan Persamaan ( 1 )–( 4 ) berfungsi sebagai kendala model. Simulasi ketergantunganpersamaan matematikapada [GOH] digunakan sebagai kontrol internal.
Hasil yang paling sesuai dari langkah pertama berfungsi sebagai nilai awal dan batasan model dalam penyesuaian rangkaian waktu reaksi, seperti yang dirangkum dalam Informasi Pendukung S1: Tabel S2 . Penyesuaian model kinetik penuh reversibel dalam Informasi Pendukung S1: Tabel S1 dilakukan dengan alat estimasi parameter yang tertanam dalam COPASI 4.29 (Hoops et al. 2006 ). Program ini menggunakan strategi evolusi dengan pemeringkatan stokastik (SERS) sebagai metode optimasi. Algoritme ditetapkan ke total 6000 generasi dan ukuran populasi 60. Parameter lain dari Solver disimpan pada pengaturan standar.
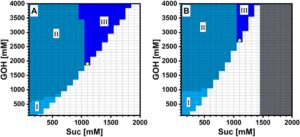
2.8 Simulasi dan Analisis Jendela Operasional Berbasis Model

3 Hasil dan Pembahasan
3.1 Karakterisasi Kinetik P134Q- Ba SucP

| Tipe reaksi | Donor | Akseptor | Berat Badan | P134Q | ||||
|---|---|---|---|---|---|---|---|---|
| Mentransfer (vX) | Hidrolisis (vH) | vX/vH | Mentransfer (vX) | Hidrolisis (vH) | vX/vH | |||
| [Jumlah anggota] | [Jumlah anggota] | [1/detik] | [1/detik] | [-] | [1/detik] | [1/detik] | [-] | |
| Fosforolisis | 250 buah | 50 bulan | 75,5 ± 2,2 | 0,9 ± 0,1 | 82,8 ± 0,1 | 1,43 ± 0,05 | 0,56 ± 0,02 | 2,55 ± 0,05 |
| Sintesis | 100 sen | 100 hari | 42,3 ± 1,9 | dan | dan | 0,64 ± 0,02 | dan | dan |
| Transglukosilasi Sukrosa | 20 tahun | tahun 2000 | 14,3 ± 1,0 | 0,8 ± 0,03 | 17,9 ± 0,1 | 10,6 ± 0,2 | 0,45 ± 0,03 | 23,6 ± 0,1 |
| Transglukosilasi G1P | 50 sen | tahun 2000 | 8,6 ± 0,2 | 0,48 ± 0,08 | 17,9 ± 0,2 | 0,58 ± 0,01 | 0,028 ± 0,011 | 20,7 ± 0,4 |
Catatan: nd, belum ditentukan. sebuah Suc. b.Pi. c G1P. d Buah. e Gliserol menganalisis produk: G1P, Glc (fosforolisis); Pi, Glc (sintesis); Fru, Glc (transglukosilasi sukrosa), Pi, Glc (transglukosilasi G1P).

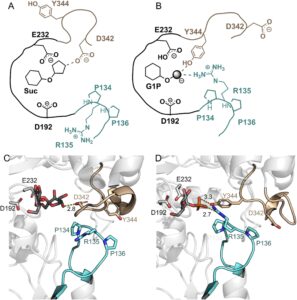
Bukti agregat dari Tabel 1 menunjukkan bahwa P134Q- Ba SucP melibatkan gangguan selektif aktivitas enzim untuk transfer glukosil ke dan dari fosfat. Aktivitas enzim untuk transfer glukosil dari Suc ke GOH atau air sebagian besar tidak terpengaruh oleh substitusi yang diarahkan ke situs tersebut. Studi struktural Ba SucP (Mirza et al. 2006 ) mengungkapkan perubahan konformasi penataan ulang loop yang digunakan oleh enzim untuk mengakomodasi fruktosa dan fosfat sebagai gugus keluar/nukleofil dari reaksi tersebut. Gambar 2 menunjukkan secara skematis perubahan pada situs aktif langsung yang dihasilkan dari perubahan konformasi tersebut. Untuk meningkatkan pengikatan fosfat, Arg135 dan Tyr344 berayun masuk, dan Asp342 berayun keluar, dari kantong pengikatan. Dalam urutan WT -Ba SucP, Arg135 diapit oleh dua prolin (Pro134, Pro136) yang berkontribusi pada posisi kaku arginin dalam struktur protein. Substitusi Pro134 oleh Gln diantisipasi akan mengganggu preorganisasi struktural situs fosfat secara khusus. Situs fruktosa mungkin tidak terpengaruh, memberikan interpretasi struktural yang konsisten dengan data kinetik.

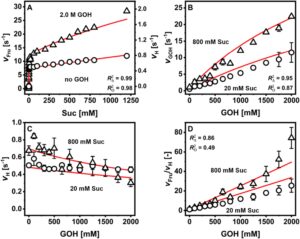
| Parameter kinetik a | Suk [mM] | GOH [P] | Berat Badan | P134Q |
|---|---|---|---|---|
| vFru[dtk -1 ] | 20 | 0–2 | 14,3 ± 1,0 | 10,6 ± 0,2 |
| vFru[dtk -1 ] | 800 | 0–2 | 20,9 ± 0,5 | 22,4 ± 0,4 |
| KGOHapp[M] | 20 | 0–2 | ≥ 2 | ≥ 2 |
| 800 | 0–2 | 2,50 ± 0,63 | ≥ 2 | |
| KSucapp[Jumlah anggota] | 0–20 | 2 | 0,45 ± 0,01 | 1,00 ± 0,07 |
| VSucapp[dtk -1 ] | 0–20 | 2 | 15,9 ± 0,1 | 12,0 ± 0,2 |
| KSucHapp[Jumlah anggota] | 0–20 | angka 0 | 0,03 ± 0,006 | < 0,1 |
| VSucHapp[dtk -1 ] | 0–20 | angka 0 | 0,87 ± 0,02 | 0,48 ± 0,01 |
| KGGapp[mM] menjadi | 0–500 | 50/500 | 49,1 ± 6,4 | 67,1 ± 3,0 |
| VGGappBahasa Indonesia: [s -1 ] | 0–500 | 50/500 | 3,68· 10−3 ± 1,25· 10−4 | 5,53· 10−3 ± 1,56· 10−4 |
| kappcat/KGOHapp[m -1 M -1 ] | 20 | 0–2 | 7,05 ± 0,13 | 5,34 ± 0,13 |
| kappcat/KGOHapp[m -1 M -1 ] | 800 | 0–2 | 10,0 ± 0,60 | 10,6 ± 0,32 |
| vH[dtk -1 ] | 20 | angka 0 | 0,89 ± 0,01 | 0,50 ± 0,02 |
| 800 | angka 0 | 1,45 ± 0,03 | 0,68 ± 0,02 | |
| 20 | 2 | 0,80 ± 0,03 | 0,45 ± 0,03 | |
| 800 | 2 | 0,95 ± 0,31 | 0,30 ± 0,04 | |
| TC[M -1 ] adalah | 20 | 0–2 | 8,0 ± 0,2 | 11,3 ± 0,2 |
| 800 | 0–2 | 12,0 ± 0,6 | 28,0 ± 1,9 |
a Ditentukan dengan kecocokan Persamaan ( 1 )–( 4 ) dengan data eksperimen. b Donor: GG; akseptor: Pi (WT), Fru (P134Q). c Model dihitung 0–2 M.


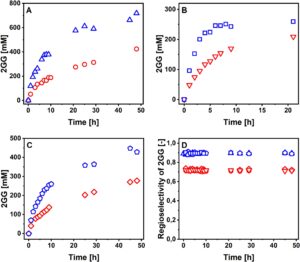
3.3 Analisis Perjalanan Waktu
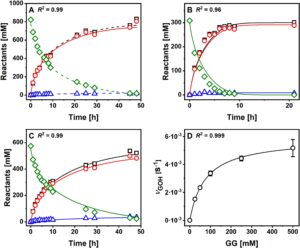
P134Q- Ba SucP dinilai dalam eksperimen konversi yang dilakukan secara identik seperti dengan WT- Ba SucP di Sigg et al. Konsentrasi substrat dipilih berdasarkan relevansi yang dirasakan untuk produksi industri, dengan [GOH] selalu hadir dalam jumlah berlebih dibandingkan [Suc]. Semua substrat dan produk dianalisis dengan HPLC, dan hasilnya divalidasi berdasarkan keseimbangan massa yang dekat. Rangkaian waktu reaksi ditunjukkan pada Gambar 4 ( panel A–C). Rangkaian waktu reaksi WT- Ba SucP yang sesuai ditemukan pada Gambar 6 dari Sigg et al. Semua reaksi P134Q- Ba SucP mencapai konversi sukrosa ≥ 95%, dan pelepasan produk hidrolisis Glc ≤ 10%. Sedangkan Gambar 4 menunjukkan pembentukan total GG yang dilepaskan, Gambar 5 (panel A–C) menunjukkan pembentukan isomer 2GG yang diinginkan dan melakukannya dengan membandingkan reaksi P134Q- Ba SucP dan WT- Ba SucP. Manfaat besar mengenai hasil 2GG (hingga 1,5 kali lipat) dan produktivitas (hingga 1,7 kali lipat) yang dihasilkan dari penggunaan P134Q- Ba SucP sebagai ganti WT- Ba SucP terlihat jelas dalam semua kondisi reaksi. Untuk membedakan antara efek regioselektivitas enzim yang berubah dalam glikosilasi gliserol dan efek kinetik umum dalam enzim, kami menganalisis porsi 2GG dalam total GG yang diproduksi, yang ditemukan sebesar 0,89 ± 0,01 dan 0,72 ± 0,01 untuk P134Q- Ba SucP dan WT- Ba SucP, masing-masing (Gambar 5D ). Hasilnya mengungkap rasio 2GG/GG rata-rata ( S r ) sebesar 0,89 (±0,01; N = 38) dan 0,72 (±0,01; N = 39) untuk P134Q- Ba SucP dan WT- Ba SucP, masing-masing. Rasio 2GG/GG spesifik enzim ini invarian terhadap waktu reaksi, karenanya konversi, serta terhadap perubahan kondisi reaksi yang ditunjukkan pada panel A–C Gambar 5. Peningkatan regioselektivitas P134Q- Ba SucP (Franceus et al. 2021 ) dikonfirmasi oleh temuan ini; namun, ditunjukkan juga bahwa kemurnian isomerik produk tidak terganggu oleh kemajuan reaksi. Stabilitas termodinamika relatif 1GG dan 2GG belum ditentukan sejauh pengetahuan kami. Kemungkinan penyusunan ulang isomer 2GG yang disukai secara kinetik menjadi 1GG yang dikatalisis oleh enzim tidak dapat dikesampingkan, sehingga menggarisbawahi pentingnya percobaan pada Gambar 5D . Bukti pada Gambar 5Drelevan lebih jauh untuk menunjukkan bahwa regioselektivitas yang berubah antara P134Q- Ba SucP dan WT- Ba SucP tidak cukup untuk menjelaskan sepenuhnya peningkatan laju pelepasan 2GG oleh enzim varian. Pada konversi sukrosa rendah (Gambar 5A–C ), P134Q- Ba SucP melepaskan lebih dari dua kali lipat jumlah 2GG yang dilepaskan oleh WT- Ba SucP. Perbandingan rangkaian waktu reaksi (Gambar 4A–C ; Gambar 6 dalam Sigg et al. 2021 ) menunjukkan bahwa pada pemuatan volumetrik aktivitas enzim yang setara, reaksi P134Q- Ba SucP berlangsung lebih cepat (≥ 1,8 kali lipat) daripada reaksi WT- Ba SucP.


| Parameter kinetik | Berat Badan | P134Q |
|---|---|---|
| Vf[dtk -1 ] | 86.4 | 59.8 |
| Vr[s -1 ] sebuah | 4,78·10 −3 | 5,78·10 −3 |
| VSucH[dtk -1 ] | 0,97 | 0.48 |
| VGGH[s -1 ] sebuah | 4,76·10 −3 | 5,71·10 −3 |
| KSuc[Jumlah anggota] | 2.58 | 5.02 |
| KGOH[Jumlah anggota] | 8.91·10 3 | 7.58·10 3 |
| KFru[mM] sebuah | 2.47 | 0.27 |
| KGG[mM] sebuah | 50.8 | 78.2 |
| KSucH[Jumlah anggota] | 2,90·10 −2 | 4,04·10 −2 |
| KGGH[mM] sebuah | 50.5 | 78.2 |
| KiSuc[mM] sebuah | 0.17 | 11.3 |
| KiGOH[mM] sebuah | 100 | 4.21·10 4 |
| KiFru[mM] sebuah | 14.1 | 73.3 |
| KiGG[mM] sebuah | 50.8 | 203 |
| Keq[-] A | 8.73·10 3 | 700 |
| TC[M -1 ] badalah | 10.0/16.0 | 16,3/24,2 |
a Parameter kinetik ini hanya ada dalam model reversibel.
b TCditunjukkan untuk [Suc] sebesar 20 mM/800 mM .

4 Kesimpulan
Studi P134Q- Ba SucP yang diaplikasikan pada produksi 2GG ini menunjukkan secara umum bahwa efisiensi sintesis enzim dalam transglikosilasi merupakan hasil dari beberapa faktor utama dalam kombinasi yang sesuai (lihat juga Adlercreutz 2017 ). Penilaian terperinci P134Q- Ba SucP dalam analisis kinetik dan studi konversi melalui eksperimen dan pemodelan mengungkapkan interaksi penting dari faktor-faktor ini dalam menentukan kinerja enzim secara keseluruhan (dievaluasi berdasarkan serangkaian metrik efisiensi reaksi yang komprehensif; Meissner dan Woodley 2022 ). Studi ini menunjukkan bahwa selain menyebabkan perubahan yang menguntungkan dalam selektivitas situs GOH yang diketahui dari penelitian sebelumnya (Franceus et al. 2021 ), substitusi Pro134 yang diarahkan ke situs oleh Gln juga menyebabkan perubahan halus dalam parameter kinetik dibandingkan dengan enzim tipe liar, yang secara keseluruhan memberikan manfaat signifikan untuk produksi 2GG. Secara khusus, nilai TC ditingkatkan ~1,5 kali lipat, yang memiliki konsekuensi penting bahwa dibandingkan dengan reaksi enzim tipe liar, kelebihan GOH yang digunakan dalam proses tersebut dapat dikurangi. Pendekatan rekayasa protein yang secara khusus menargetkan TC untuk optimasi katalis transglikosilasi (misalnya, Lundemo et al. 2017 ; Teze et al. 2021 ) dengan demikian didukung secara umum. Namun, rekomendasi dari studi P134Q- Ba SucP adalah bahwa TC harus dievaluasi dalam kondisi pengujian yang sama, atau setidaknya cukup mirip dengan, kondisi yang digunakan dalam proses tersebut. Alasannya adalah karena efek khusus dari konsentrasi donor dan akseptor pada laju transfer dan hidrolisis, TC dapat menunjukkan variasi substansial dengan kondisi reaksi yang digunakan. Singkatnya, P134Q- Ba SucP menggabungkan sifat-sifat yang menguntungkan dari selektivitas, reaktivitas, dan stabilitas untuk kemungkinan aplikasi dalam glikosilasi GOH dari Suc untuk lebih meningkatkan produksi biokatalitik 2GG (Kruschitz dan Nidetzky 2022 ; Luley-Goedl et al. 2010 ). Secara mekanistis, menarik untuk menemukan bahwa P134Q- Ba SucP melibatkan gangguan reaktivitas dengan fosfat. Penggunaan penting pemodelan kinetik untuk mengoptimalkan transglikosilasi enzimatik ditunjukkan (lihat juga, Fagundes et al. 2022 ; Mitchell dan Krieger 2022 ; Weber et al. 2024 ). SucP menunjukkan spesifisitas yang luas untuk substrat akseptor yang digunakan dalam transglikosilasi dari Suc (Franceus dan Desmet 2020). SucP dari berbagai sumber juga direkayasa untuk meningkatkan kinerja (misalnya, aktivitas, selektivitas) dalam reaksi dengan berbagai akseptor (untuk tinjauan, lihat Franceus dan Desmet 2020 ; Zhu et al. 2025 ). Analisis yang disajikan di sini dapat relevan untuk karakterisasi dan optimalisasi berbagai reaksi sintetis yang dikatalisis oleh bentuk SucP tipe liar dan rekayasa (lihat juga Klimacek et al. 2020 ; Sigg et al. 2021 ).



Tinggalkan Balasan