Abstrak
Latar belakang
Kacang tanah diatur sebagai alergen makanan utama di Amerika Serikat. Produk makanan yang mengandung kacang tanah harus diberi label sesuai dengan Undang-Undang Makanan, Obat, dan Kosmetik (FD&C), dan pelabelan yang akurat memerlukan metode deteksi yang efektif. Metode berbasis reaksi berantai polimerase (PCR) sangat sensitif, spesifik, dan kuat untuk tujuan ini. PCR digital adalah teknologi PCR generasi terbaru dan menawarkan potensi keuntungan dibandingkan teknik PCR yang lebih mapan, tetapi sangat sedikit penelitian yang melaporkan evaluasi PCR digital untuk digunakan dalam deteksi alergen makanan.
Hasil
Dalam penelitian ini, uji PCR digital multipleks dievaluasi untuk mendeteksi kacang tanah dalam bahan makanan pada tingkat mulai dari 0,1 mg/kg (ppm) hingga 106 mg /kg (100% kacang tanah), dan dibandingkan dengan uji PCR waktu nyata. PCR digital dan waktu nyata mendeteksi kacang tanah secara efektif pada semua tingkat dalam semua bahan makanan. PCR digital memiliki batas deteksi (LOD) pada 0,1 mg/kg untuk ketiga target dan batas kuantifikasi (LOQ) pada 1–10 mg/kg tergantung pada target. PCR waktu nyata memiliki LOD pada 0,1–10 mg/kg tergantung pada target, dan LOQ pada 100 mg/kg.
Kesimpulan
PCR digital lebih tepat dan lebih sensitif daripada PCR waktu nyata untuk mendeteksi kacang tanah yang dicampurkan ke dalam bahan makanan. Meskipun pengujian lebih lanjut diperlukan untuk menentukan efek relatif dari matriks makanan kompleks dan pemrosesan, hasil awal ini menunjukkan bahwa PCR digital merupakan metode inovatif yang dapat membantu memastikan keamanan bahan kimia makanan melalui deteksi DNA yang sensitif dan tepat dari makanan yang bersifat alergen seperti kacang tanah.
PERKENALAN
Di Amerika Serikat, kacang tanah diatur sebagai alergen makanan utama menurut Undang-Undang Makanan, Obat, dan Kosmetik (FD&C). Produk makanan yang mengandung kacang tanah harus diberi label yang sesuai, dan ini memerlukan metode deteksi yang sangat sensitif dan spesifik. Metode harus bekerja dengan baik dalam berbagai matriks makanan yang kompleks serta dalam bahan mentah, yang sering kali menjadi sumber alergen kacang tanah yang tidak dideklarasikan atau tidak sengaja dimasukkan.
Deteksi DNA makanan alergenik melalui teknik berbasis reaksi berantai polimerase (PCR) berfungsi sebagai indikator keberadaan protein alergenik dalam makanan. DNA telah terbukti menjadi target yang lebih stabil dan kuat daripada protein, dan menawarkan opsi untuk memilih wilayah target mana pun yang memberikan tingkat spesifisitas dan sensitivitas yang diinginkan. 1 , 2 Metode awal dikembangkan menggunakan PCR konvensional generasi pertama, atau PCR titik akhir, untuk mengamplifikasi wilayah target yang terletak di antara dua primer oligonukleotida spesifik urutan. PCR konvensional memerlukan pemrosesan pasca-PCR manual untuk analisis hasil dan tidak menawarkan opsi kuantisasi. Pendekatan yang dominan dalam beberapa tahun terakhir adalah PCR waktu nyata, di mana penambahan probe oligonukleotida fluorogenik dalam wilayah target digunakan untuk memantau PCR selama amplifikasi—dalam waktu nyata—dan untuk menentukan nomor siklus, atau nilai C T , di mana amplifikasi melebihi ambang batas tertentu. PCR waktu nyata menghilangkan kebutuhan untuk pemrosesan tambahan, memungkinkan kuantisasi, dan menambahkan tingkat spesifisitas tambahan. 1 , 3 Baru-baru ini, deteksi makanan alergen difokuskan pada PCR digital generasi ketiga. 1 , 2 , 4
PCR digital (dPCR) menggunakan primer dan probe fluoresens yang sama seperti PCR real-time tetapi berbeda dalam hal lain (Tabel 1 ). Sampel dPCR sangat terpartisi, hingga membatasi pengenceran, sebelum amplifikasi PCR. Dalam dPCR, sinyal fluoresens dibaca pada titik akhir, saat semua siklus amplifikasi selesai, dan digunakan untuk memberi skor pada setiap partisi sebagai positif atau negatif. Penerapan statistik Poisson pada hitungan partisi positif dan negatif menghasilkan nomor salinan untuk setiap target. 5 , 6 Nomor salinan dPCR berbanding lurus dengan jumlah target dan menghasilkan kurva kalibrasi dengan kemiringan positif. Sebaliknya, nilai C T dari PCR real-time berbanding terbalik, dan kurva standar, yang diperlukan untuk mengubah nilai C T menjadi jumlah target yang diketahui, memiliki kemiringan negatif (Tabel 1 ). Kurva standar atau bentuk kalibrasi lainnya telah dianggap opsional dengan angka absolut yang dihasilkan oleh dPCR, tetapi penggunaan kalibrator tetap disarankan untuk membantu menentukan dan memastikan keakuratan dan konsistensi. 7 Dalam aplikasi deteksi alergen, kalibrator memiliki fungsi penting tambahan untuk membantu mengubah jumlah salinan DNA menjadi kadar makanan alergen utuh. Dibandingkan dengan PCR waktu nyata, pembacaan data pada titik akhir membuat dPCR lebih tangguh terhadap efek efisiensi amplifikasi. Pemartisian membuat dPCR lebih tepat dan tidak terlalu rentan terhadap efek penghambat PCR. 8 , 9
| PCR waktu nyata | PCR digital (sistem QX200) | |
|---|---|---|
| Format Reaksi | Massal: berair | Terpartisi: tetesan dalam minyak |
| Pengumpulan Data | Pada setiap siklus (dalam waktu nyata) | Di akhir semua siklus (titik akhir) |
| Keluaran Data | Plot Amplifikasi → Nilai C T | Jumlah tetesan → Salin nomor |
| Kurva Standar, Kurva Kalibrasi | C T vs. ppm → kemiringan negatif | Salinan # vs. ppm → kemiringan positif |
| Multipleksing (penggandaan) | Warna fluorofor: 4-5 saluran fluoresensi | Warna fluorofor, level, kombinasi: 2 saluran fluoresensi |
Multiplexing juga didekati secara berbeda. Sebagian besar sistem PCR real-time memiliki 4–5 saluran fluoresensi yang berbeda, sehingga multiplexing dari 4–5 target dilakukan dengan menggunakan fluorofor yang berbeda untuk memberi label probe. Karena sistem dPCR merekam sinyal fluoresensi di titik akhir dan untuk setiap partisi secara individual, panjang gelombang emisi dan intensitas sinyal dapat digunakan dalam multiplexing, dan jumlah target yang mungkin lebih besar daripada jumlah saluran fluoresensi yang tersedia. 9 , 10 Misalnya, pada sistem PCR digital droplet (ddPCR) dengan 2 saluran, multiplexing dari 3–5 target dapat dicapai dengan memvariasikan konsentrasi dan kombinasi fluorofor probe (Gambar 1 ). 9 , 10
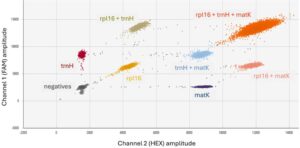
Pengujian dPCR telah dilaporkan untuk beberapa alergen makanan—wijen, kacang tanah, kedelai, seledri, dan ikan. 11 – 15 Beberapa laporan hingga saat ini telah mencakup pengujian menyeluruh dalam makanan atau matriks, tetapi yang melakukannya telah menunjukkan dPCR efektif untuk deteksi tingkat rendah makanan alergenik dalam matriks. Ini termasuk deteksi seledri dalam daging giling, sup, dan saus tomat 14 serta wijen dalam biskuit dan adonan mentah. 11 Dalam karya ini, pengujian triplex droplet digital PCR (ddPCR) telah dievaluasi untuk mendeteksi kacang tanah dalam tiga bahan makanan berbeda yang telah terbukti bermasalah untuk kontaminasi kacang tanah: bubuk bawang putih, bubuk kakao, dan tepung buncis. Primer dan probe menargetkan gen kloroplas dengan jumlah salinan tinggi seperti yang dijelaskan sebelumnya. 16 Deteksi kacang tanah diuji pada berbagai konsentrasi di ketiga bahan, dan batas deteksi dan kuantifikasi (LOD dan LOQ) ditentukan dalam satu bahan, tepung buncis. Dalam semua kasus, pengujian ddPCR dibandingkan dengan PCR waktu nyata.
BAHAN DAN METODE
Persiapan sampel dan ekstraksi DNA
Kacang tanah dan bahan makanan—bubuk bawang putih, bubuk kakao, dan tepung kacang arab—diperoleh dari Nuts.com ( www.nuts.com , Cranford, NJ). Kacang tanah diperoleh sebagai varietas “dalam kulit” dan dikeluarkan dari kulitnya di bawah kondisi laboratorium yang terkendali untuk memastikan tidak ada kontaminasi silang. Kacang tanah utuh dicampur ke dalam 5 g setiap bahan makanan pada kadar 0,1, 1, 10, 100, 1000, 10, 4 dan 10 5 mg/kg (ppm), dan sampel kacang tanah 100% (10 6 ppm) tanpa matriks disertakan dalam semua pengujian. Sampel dihomogenisasi dalam 20 mL buffer SDS (natrium dodecyl sulfate) 1%–2% menggunakan IKA TubeMill dengan tabung penggiling MT 40 (IKA, Wilmington, NC, www.ika.com ). Baik sampel yang hanya diberi buffer maupun sampel matriks yang tidak dicampur disertakan sebagai kontrol negatif. DNA diekstraksi dari 300 μL homogenat menggunakan DNeasy Plant Kit sesuai dengan petunjuk pabrik (Qiagen, Valencia, CA) dan diukur menggunakan NanoDrop Lite Spectrophotometer (ThermoFisher Scientific). Sampel DNA dinormalisasi hingga total DNA 10 ng/μl (Qiagen, Valencia, CA) dan disimpan pada suhu 4°C hingga digunakan.
Primer dan probe
Untuk dPCR, multiplexing dicapai menggunakan format triplex pencampuran-probe. 10 , 18 Primer dan probe (Integrated DNA Technologies; Coralville, IA) yang sebelumnya dikembangkan untuk menargetkan tiga daerah berbeda dari genom kloroplas kacang tanah, dalam gen rpl16 dan matK dan daerah spacer trnH-psbA , 16 disertakan sebagai berikut: trnH-psbA : primer forward 500 nM (5′-AGG AGC AAT AGA AAC TGC GT-3′), primer reverse 500 nM (5′-TTT TTG TCT TAA GGG ATA CGA GT-3′), probe FAM 150 nM (5′-FAM-TGA TAT TGC/ZEN/TCC TTT ACT TTC AAA A-IowaBlackFQ-3′); matK : primer maju 500 nM (5′-AAG CGA AAT TTT GTA ATA TAT TAG G-3′), primer terbalik 500 nM (5′-CTG CAT ATC CGC AAA TAC-3′), probe HEX 150 nM (5′-HEX-CAT CCC ATT/ZEN/AGT AAG CCC GTT TG-IowaBlackFQ-3′); rpl16 : primer forward 500 nM (5′-GCG ATG GGA ACG ACG AAA AC-3′), primer reverse 500 nM (5′-TTA GTT CGT TCC GCC ATC CC-3′), probe FAM 75 nM + probe HEX 75 nM (5′-FAM/HEX-ACC TAA GAT/ZEN/TCA TTT GAC GGG A-IowaBlackFQ-3′). Untuk PCR real-time, urutan primer dan probe sama seperti yang dilaporkan di atas untuk ddPCR. Probe trnH-psbA diberi label dengan TexasRed, probe matK diberi label dengan Cy5, dan probe rpl16 diberi label dengan FAM. PCR real-time berisi primer forward 500 nM, primer reverse 500 nM, dan probe 200 nM untuk setiap target kacang tanah. 16
PCR digital tetesan
ddPCR dilakukan sesuai dengan petunjuk pabrik menggunakan Sistem PCR Digital Tetesan QX200 17 (BioRad, Hercules, CA) sebagai berikut: PCR berair disiapkan sebagai reaksi 22-μl menggunakan ddPCR Multiplex Supermix, primer, probe, dan sampel DNA ternormalisasi 2 μL. Reaksi dipartisi pada Generator Tetesan QX200 menggunakan kartrid DG8 yang diisi dengan 70 μL minyak pembangkit tetesan dan 20 μL sampel PCR berair per sumur. Dari setiap sumur, 40 μL tetesan dipindahkan ke pelat ddPCR 96-sumur dan disegel panas menggunakan PX1 PCR Plate Sealer dengan segel panas foil yang dapat ditusuk (BioRad, Hercules, CA). PCR pada C1000 Touch Thermal Cycler terdiri dari denaturasi awal pada 95°C selama 10 menit, 45 siklus denaturasi pada 94°C selama 30 detik ditambah annealing/ekstensi pada 57°C selama 2,5 menit, dengan siklus akhir stabilisasi droplet pada 98°C selama 10 menit. Reaksi yang diperkuat ditahan pada 4°C hingga dibaca dan dihitung pada QX200 Droplet Reader. Seperti yang diharapkan untuk format triplex pencampuran probe ini, pengujian menghasilkan populasi droplet yang sesuai dengan semua kemungkinan kombinasi satu, dua, atau tiga target; populasi droplet diidentifikasi seperti yang ditunjukkan (Gambar 1 ). 18 Hitungan droplet positif dan negatif digunakan untuk menghitung jumlah salinan absolut. Data dianalisis menggunakan opsi pengujian triplex campuran probe dalam QuantaSoft Analysis Pro (BioRad, Hercules, CA) dan perangkat lunak Excel (Microsoft, Redmond, WA).
PCR waktu nyata
PCR waktu nyata dilakukan seperti yang dijelaskan sebelumnya 16 dengan 1x buffer PCR, 7 mM Mg, 2 mM dNTP, 0,625 unit Platinum Taq Polymerase (Invitrogen/Life Technologies, Grand Island, NY, AS), primer dan probe seperti yang dijelaskan di atas, dan volume reaksi total 12,5 μL. Siklus pada sistem PCR Waktu Nyata CFX96 Touch (BioRad, Hercules, CA) terdiri dari 3 menit pada suhu 95°C, diikuti oleh 45 siklus denaturasi pada suhu 95°C selama 15 detik, annealing pada suhu 65°C selama 30 detik, dan ekstensi pada suhu 65°C selama 2 menit. Data dianalisis menggunakan CFX Manager (BioRad, Hercules, CA) dan perangkat lunak Excel (Microsoft, Redmond, WA).
LOD, LOQ, dan presisi
Uji LOD, LOQ, dan presisi pengulangan untuk PCR digital dan real-time dilakukan pada tepung kacang arab menggunakan 12 replikasi teknis DNA yang diekstraksi pada masing-masing dari 7 tingkat spike—0,1, 1, 10, 100, 1000, 10 4 , dan 10 5 mg/kg (ppm)—serta pada 100% kacang tanah (10 6 ppm). LOQ ditetapkan sebagai konsentrasi terendah di mana nilai C T PCR real-time memiliki deviasi standar kurang dari atau sama dengan 0,5 C T , dan di mana jumlah salinan ddPCR memiliki CV 25% atau kurang. 19 LOD ditetapkan sebagai konsentrasi terendah di mana semua 12 replikasi teknis menghasilkan hasil positif. 19
HASIL DAN PEMBAHASAN
Pengujian pada bahan makanan
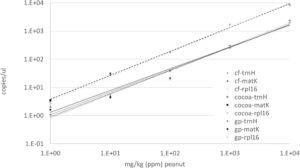
Data yang diperoleh dari pencampuran kacang tanah utuh ke dalam tepung kacang arab, bubuk kakao, dan bubuk bawang putih menunjukkan bahwa uji ddPCR mampu mendeteksi kacang tanah di semua bahan pada semua level yang diuji, dari 0,1 ppm hingga 106 mg /kg (ppm), dan linear dari 1 hingga 104 ppm (Tabel 2 ; Gambar S1 ). Data ddPCR menunjukkan variasi rendah dalam hitungan jumlah salinan antara tiga target dalam setiap matriks pada level hingga 104 mg /kg (ppm; Gambar S1 ). PCR waktu nyata juga mendeteksi kacang tanah secara efektif di semua matriks, dengan linearitas dari 0,1 hingga 106 mg /kg (100% kacang tanah; Tabel 3 ). Untuk dPCR, rentang dinamis yang lebih sempit seperti yang diharapkan: rentang dinamis sistem dPCR sebagian besar bergantung pada jumlah partisi, yang menjadi jenuh dengan sinyal positif pada level target yang tinggi. Sistem QX200 yang digunakan dalam karya ini memiliki maksimum teoritis 20.000 partisi (tetesan) dan 5 orde besaran dalam jangkauan dinamis .
| Tepung kacang arab (kopi/μl) | Bubuk kakao (kopi/μl) | Bubuk bawang putih (kopi/μl) | |||||||
|---|---|---|---|---|---|---|---|---|---|
| mg/kg (ppm) | trnH-psbA | tikarK | rpl16 | trnH-psbA | tikarK | rpl16 | trnH-psbA | tikarK | rpl16 |
| 0.1 | 0.639 | 0.639 | 0.639 | 0.796 | 0.239 | 0.876 | 1.55 | 1.24 | 1.63 |
| 1 | 2.13 | 1,95 | 1.87 | 3.19 | 3.48 | 2.63 | 1.07 | 1.61 | 1.79 |
| 10 | 4.81 | 5.05 | 4.42 | 31.7 | 29.4 | 26.8 | 5.78 | 4.41 | 5.86 |
| 100 | 41.1 | 39.4 | 36.6 | 186 | 181 | 187 | 22.6 | 20 | 18.7 |
| 10 3 | 256 | 264 | 241 | tahun 1649 | tahun 1611 | tahun 1610 | 298 | 295 | 288 |
| 10 4 | tahun 2074 | tahun 1995 | Tahun 1934 | tahun 8038 | tahun 8038 | 7824 | tahun 2464 | tahun 2401 | tahun 2489 |
| 10 5 | 8576 | 8715 | 6882 | 9754 | 9754 | 9754 | 8696 | 8482 | 7485 |
| 10 6 | 6946 | 6946 | 6459 | 8781 | 8781 | 7703 | 10.556 orang | 10.556 orang | 10.556 orang |
| Matriks | Target | Kisaran linier (mg/kg = ppm) | Statistik R 2 | Efisiensi (%) |
|---|---|---|---|---|
| Tepung kacang arab | trnH-psbA | 0,1–10 6 | 0,98 | 100 |
| tikarK | 10–10 6 | 0,98 | 101 | |
| rpl16 | 0,1–10 6 | 0,99 | 125 | |
| Coklat bubuk | trnH-psbA | 0,1–10 6 | 0,99 | 121 |
| tikarK | 0,1–10 6 | 0,98 | 104 | |
| rpl16 | 0,1–10 6 | 0,99 | 142 | |
| Bubuk bawang putih | trnH-psbA | 1–10 6 | 0,98 | 92 |
| tikarK | 10–10 6 | 0,95 | 99 | |
| rpl16 | 1–10 6 | 0,99 | 126 |
Baik data PCR digital maupun real-time menunjukkan bahwa amplifikasi lebih kuat dalam bubuk kakao daripada dalam tepung buncis dan bubuk bawang putih: jumlah salinan ddPCR untuk semua target umumnya lebih tinggi dalam bubuk kakao (Tabel 2 ; Gambar 2 ), dan—meskipun tidak ada perbedaan yang nyata dalam nilai C T mentah antara bahan makanan (data tidak ditampilkan)—efisiensi reaksi PCR real-time dan rentang linier secara keseluruhan lebih tinggi untuk bubuk kakao (Tabel 3 ). Ini kemungkinan mencerminkan variabilitas normal baik dalam bubuk kakao maupun antara matriks. Set data ini mencakup satu eksperimen untuk setiap matriks dan dirancang untuk menguji uji di berbagai bahan makanan, bukan untuk menilai variabilitas dalam matriks. Perbedaan antara matriks mencerminkan variabilitas seluruh prosedur eksperimen, yang mencakup spiking, persiapan sampel, dan ekstraksi DNA selain langkah-langkah PCR. Efek matriks diketahui terjadi dalam deteksi alergen, dan pekerjaan dPCR baru-baru ini telah menunjukkan bahwa efek ini bervariasi. 11 , 14 Secara keseluruhan, baik ddPCR maupun PCR real-time berkinerja baik di semua bahan makanan yang diuji.
LOD, LOQ, dan pengujian presisi
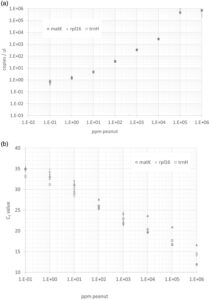
LOD, LOQ, dan presisi pengulangan untuk ddPCR dan PCR waktu nyata ditentukan menggunakan kacang tanah dalam tepung kacang arab (Tabel 4 , Tabel 5 ). Kemiringan kurva positif untuk ddPCR dan negatif untuk PCR waktu nyata seperti yang diharapkan (Tabel 1 ; Gambar 3 ). Uji dPCR menunjukkan presisi yang jauh lebih tinggi, baik di dalam maupun di antara target, pada kadar hingga 104 mg /kg (ppm; Gambar 3 ). Pada kadar kacang tanah yang lebih tinggi, jumlah tetesan menjadi hampir sepenuhnya jenuh dengan sinyal positif, variabilitas meningkat, dan jumlah salinan berhenti menjadi linier (Gambar 3a ). Replikasi yang sepenuhnya jenuh dan tidak menghasilkan tetesan negatif menghasilkan perbedaan besar dalam keluaran jumlah salinan dari perhitungan Poisson: misalnya, jumlah tetesan mentah untuk 12 replikasi teknis matK pada 105 mg /mg (ppm; Tabel 6 ) menunjukkan variasi yang luas dalam jumlah salinan yang dihitung dalam kondisi ini. Untuk pengujian ddPCR, LOD adalah 0,1 ppm untuk ketiga target kacang tanah, sementara LOQ adalah 10 ppm untuk rpl16 dan 1 ppm untuk matK serta trnH-psbA (Tabel 4 ). Untuk PCR waktu nyata, baik LOD maupun LOQ lebih bervariasi di antara target dan lebih tinggi untuk pengujian secara keseluruhan: LOD adalah 0,1 mg/kg untuk matK serta trnH-psbA , dan 10 mg/kg untuk rpl16 . LOQ adalah 100 mg/kg untuk ketiga target dalam PCR waktu nyata. Sementara penelitian sebelumnya menunjukkan bahwa ddPCR lebih tepat—tetapi tidak lebih sensitif—daripada PCR waktu nyata untuk mendeteksi DNA yang diencerkan dalam buffer, 8 , 18 penelitian ini telah menunjukkan bahwa dPCR lebih tepat dan lebih sensitif daripada PCR waktu nyata untuk mendeteksi kacang tanah dalam bahan makanan. Hal ini konsisten dengan laporan sebelumnya untuk wijen dan seledri alergenik 11 , 12 dan menunjukkan bahwa teknologi partisi reaksi dPCR menguntungkan untuk mendeteksi DNA target (kacang tanah atau alergen lainnya) terhadap latar belakang DNA non-target (matriks makanan) yang tinggi.
| tikarK | rpl16 | trnH-psbA | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Jumlah gram/kg (ppm) | Cp/ μl (jumlah total) | RSD | # pos | Cp/ μl (jumlah total) | RSD | # pos | Cp/ μl (jumlah total) | RSD | # pos |
| 0.1 | 0.66 | 28 | 12 | 0.66 | 38 | 12 | 0.68 | 48 | 12 |
| 1 | 1.45 | 16 | 12 | 1.62 | 30 | 12 | 1.54 | 24 | 12 |
| 10 | 4.85 | 16 | 12 | 4.42 | 16 | 12 | 4.88 | 20 | 12 |
| 100 | 36.68 | 6 | 12 | jam 34.45 | 4 | 12 | 37.69 | 7 | 12 |
| 10 3 | 336.90 | 4 | 12 | 331.55 | 4 | 12 | 356.79 | 4 | 12 |
| 10 4 | 2758.48 | 4 | 12 | 2695.60 | 4 | 12 | 2905.43 | 4 | 12 |
| 10 5 | 505.130 | 102 | 12 | 422.381 | 121 | 12 | 505.130 | 102 | 12 |
| 10 6 | 752.201 orang | 60 | 12 | 669.338 | 73 | 12 | 752.201 orang | 60 | 12 |
Singkatan: LOD, 0,1 ppm semua target; LOQ, 1 ppm untuk matK dan trnH-psbA , 10 ppm untuk rpl16 .
| matK -Cy5 | rpl16 -Keluarga | trnH-psbA TexMerah | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Jumlah gram/kg (ppm) | C T | SD | # pos | C T | SD | # pos | C T | SD | # pos |
| 0.1 | 34.91 | 0,58 | 12 | 35.04 | 0.20 | 2 | 33.16 | 0.43 | 12 |
| 1 | 32,99 dolar | 0.62 | 12 | 34.24 | 0.72 | 9 | 31.21 | 0.22 | 12 |
| 10 | Tanggal 31.08 | 1.05 | 12 | 29.52 | 0,87 | 12 | 28.90 | 0.74 | 12 |
| 100 | 25.48 | 0.31 | 12 | 27.58 | 0.14 | 12 | tanggal 26.06 | 0,15 | 12 |
| 10 3 | 21.81 | 0.49 | 12 | tanggal 24.16 | 0.39 | 12 | 22.96 | 0.36 | 12 |
| 10 4 | 19.65 | 0.11 | 12 | 23.60 | 0,07 | 12 | 20.37 | 0.10 | 12 |
| 10 5 | 16.71 | 0.17 | 12 | 20.92 | 0.10 | 12 | 17.70 | 0.23 | 12 |
| 10 6 | 11.91 | 0.22 | 12 | 16.59 | 0,08 | 12 | 14.38 | 0.51 | 12 |
Singkatan: LOD, 0,1 ppm untuk matK dan trnH-psbA , 10 ppm untuk rpl16 ; LOQ, 100 ppm untuk semua target.
| Replikasi # | Salinan/ μ l | Tetesan yang diterima | Tetesan positif | Tetesan negatif |
|---|---|---|---|---|
| 1 | 1.000.000,00 | 15.923 orang | 15.923 orang | angka 0 |
| 2 | 11.254,51 | 14.276 orang | 14.275 orang | 1 |
| 3 | 9300.95 | 13.565 orang | 13.560 orang | 5 |
| 4 | 11.245,00 | 14.161 orang | 14.160 orang | 1 |
| 5 | 8047.70 | 12.155 orang | 12.142 orang | 13 |
| 6 | 11.250,63 | 14.229 | 14.228 | 1 |
| 7 | 1.000.000,00 | 13.757 orang | 13.757 orang | angka 0 |
| 8 | 1.000.000,00 | 14.563 orang | 14.563 orang | angka 0 |
| 9 | 1.000.000,00 | 12.250 | 12.250 | angka 0 |
| 10 | 10.469,95 | 14.656 orang | 14.654 orang | 2 |
| 11 | 1.000.000,00 | 14.762 orang | 14.762 orang | angka 0 |
| 12 | 1.000.000,00 | 13.441 orang | 13.441 orang | angka 0 |
KESIMPULAN
dPCR merupakan teknologi berbasis PCR baru yang masih dalam tahap awal penerapannya untuk mendeteksi makanan yang bersifat alergen. Makalah ini menunjukkan bahwa dPCR lebih sensitif dan lebih tepat daripada PCR waktu nyata untuk mendeteksi kacang tanah dalam berbagai konsentrasi bahan makanan.




Tinggalkan Balasan