ABSTRAK
Pseudouridin ( Ψ ) merupakan blok penyusun penting RNA sintetis untuk aplikasi medis, sehingga metode untuk produksinya yang efisien semakin diminati. Reaksi balik dari Ψ -5′-fosfat ( ΨMP ) C -glikosidase, yaitu, d -ribosa 5-fosfat ( Rib5P ) + urasil (Ura) → ΨMP + H 2 O, memungkinkan pemasangan struktur inti β- C- ribosida dari Ψ dalam transformasi satu langkah yang sepenuhnya selektif dan digerakkan oleh kesetimbangan yang efisien. Namun, menyediakan substrat Rib5P merupakan tantangan untuk pengembangan proses dan solusi optimal dapat bervariasi tergantung pada tugas produksi spesifik yang dipertimbangkan. Di sini, kami mengeksploitasi aktivitas purin/pirimidin nukleotida 5′-fosfat nukleosidase (PpnN; EC 3.2.2.10) yang kurang dikenal untuk membelah uridin 5′-fosfat ( UMP ), bahan awal yang relatif cepat untuk sintesis ΨMP , dengan melepaskan Rib5P dan Ura . Dengan menggunakan transformasi kaskade linier dalam dua langkah enzimatik yang dilakukan dalam satu pot, kami menunjukkan penyusunan ulang UMP menjadi ΨMP (hasil: ≥ 95%) dan dengan demikian memperoleh produk C -riboside pada batas kelarutan (∼1,5 mol/L) dalam produktivitas 2,9 × 10 2 g/L/jam. Kami menunjukkan bahwa varian ganda R341A-Y347A dari Escherichia coli PpnN (RY) yang dilaporkan sebelumnya menunjukkan aktivitas spesifik ∼5 kali lipat lebih tinggi terhadap UMP, dan ∼12 kali lipat kurang sensitif terhadap penghambatan Rib5P , daripada enzim tipe liar. Dalam kondisi C -glikosidase yang diaplikasikan dalam kelebihan dua kali lipat pada PpnN untuk meminimalkan efek penghambatan Rib5P , reaksi kaskade dengan RY dibandingkan dengan PpnN tipe liar masih memberikan peningkatan produktivitas ∼5 kali lipat. Singkatnya, kami menyajikan rute sintetis baru ke ΨMP melalui penataan ulang N – ke C -glikosida dari UMP . Dibandingkan dengan pendekatan biokatalisis kaskade sebelumnya untuk produksi ΨMP dari uridina atau UMP , rute baru ini disederhanakan karena pelepasan langsung Rib5P dari substrat UMP yang dikatalisis oleh PpnN.
Singkatan
m1Ψ
N 1 -metil- Ψ
ppGpp
guanosin 3′,5′-bispirofosfat
PpnN
purin/pirimidin nukleotida 5′-fosfat nukleosidase (EC 3.2.2.10)
Iga
d -ribosa
Tulang rusuk 5P
d -ribosa 5-fosfat
RY
Varian ganda R341A-Y347A dari PpnN
UMP
uridin 5′-fosfat
Ura
urasil
Ya
ΨMP – C -glikosidase (EC 4.2.1.70)
aku
pseudouridin
ΨMP
pseudouridin 5′-fosfat
ΨTP
Ψ 5′-trifosfat
1 Pendahuluan
Pseudouridin ( Ψ , Gambar 1A ) adalah isomer 5-β- C -riboside alami dari uridin (Spenkuch et al. 2014 ). Ψ ditemukan dalam RNA tempat posisi U tertentu diisomerisasi pascatranskripsi (Borchardt et al. 2020 ; Cerneckis et al. 2022 ; Hamma and Ferré-D’Amaré 2006 ). Ψ dan turunan N 1 -metilasinya ( m1Ψ ) memiliki kegunaan penting dalam mRNA sintetis untuk aplikasi medis (Karikó et al. 2008 ). Sebagai contoh, vaksin mRNA saat ini terhadap COVID-19 melibatkan substitusi seragam U oleh m1Ψ (Andries et al. 2015 ; Nance and Meier 2021 ). Meningkatnya pentingnya terapi berbasis mRNA membawa serta persyaratan teknologi (bio)proses yang kuat untuk produksi mRNA. Rantai pasokan m1Ψ dan prekursor sintetis langsungnya Ψ sangat penting untuk pembuatan mRNA melalui transkripsi in vitro (Light dan Lexchin 2021 ). Rute sintetis saat ini untuk Ψ melibatkan prosedur multi-langkah yang memerlukan gugus pelindung dan tidak memiliki stereoselektivitas yang diperlukan untuk pembentukan β- C -riboside secara eksklusif (Hanessian dan Machaalani 2003 ; Van Rijssel et al. 2015 ). Oleh karena itu, metode baru untuk produksi Ψ yang lebih efisien dan lebih berkelanjutan menarik perhatian yang lebih besar. Biokatalisis kaskade yang dikembangkan di sekitar kondensasi CC oleh Ψ -5′-fosfat ( ΨMP ) C -glikosidase sebagai reaksi inti menjanjikan untuk menghasilkan inovasi proses yang penting. C – glikosidase adalah enzim mikroba yang peran biologisnya adalah hidrolisis ΨMP untuk mendaur ulang d- ribosa 5-fosfat ( Rib5P ) dan urasil ( Ura ) ke dalam metabolisme (Preumont et al. 2008 ). Penggabungan CC antara Rib5P dan Ura melibatkan gaya pendorong besar dari termodinamika, sehingga pembentukan C -riboside, yang secara formal merupakan pembalikan hidrolisis, berlangsung dalam hasil yang hampir kuantitatif, bahkan dalam air (Pfeiffer dan Nidetzky 2020 ). Hidrolisis ΨMP berfungsi secara in vivo karena penghapusan Rib5P yang berkelanjutan oleh metabolisme sentral (Preumont et al. 2008)). Namun, jika digunakan dalam kondisi yang dioptimalkan secara in vitro, reaksi C -glikosidase terbalik menghasilkan ΨMP dalam konsentrasi yang lebih tinggi (≥ 1 mol/L) dan produktivitas (≥ 93 mmol/L/jam) (Pfeiffer et al. 2023 ; Ribar et al. 2024 ). Konsep proses untuk sintesis biokatalitik berbeda dalam cara Rib5P dipasok ke reaksi C -glikosidase (Gambar 1B ). Mereka juga berbeda dalam apakah Ψ atau ΨMP adalah produk target yang sebenarnya. Rib5P diperoleh dengan fosforilasi d- ribosa yang dilakukan dalam satu pot bersama dengan sintesis ΨMP . Defosforilasi ΨMP dalam langkah enzimatik terpisah digunakan untuk menyiapkan Ψ (Gambar 1B ). Rib5P diperoleh tambahan dari adenosin 5′-fosfat dengan hidrolisis kimia yang dilakukan dalam langkah terpisah dengan isolasi produk (Riley et al. 2021 ). Terakhir, Rib5P dilepaskan bersama dengan Ura dari U atau UMP menggunakan transformasi kaskade empat enzim satu pot untuk menghasilkan Ψ , seperti yang ditunjukkan pada Gambar 1B . Sintesis Ψ ditunjukkan pada skala gram melalui reaksi kaskade dari U (Pfeiffer et al. 2023 ).
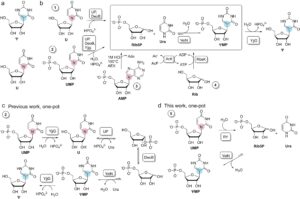
Ψ dan ΨMP merupakan produk yang berguna dengan sendirinya. Rute sintetis menuju m1Ψ telah dikembangkan dari Ψ (Bhattacharya et al. 1995 ; Earl dan Townsend 1977 ; Reichman et al. 1977 ). Produksi mRNA melalui transkripsi in vitro memerlukan turunan 5′-trifosfat yang diaktifkan dari Ψ atau m1Ψ (Nance dan Meier 2021 ). Dalam konteks ini, ΨMP dapat dianggap telah disiapkan untuk fosforilasi enzimatik lebih lanjut guna menghasilkan ΨTP (Pfeiffer et al. 2023 ; Pfeiffer dan Nidetzky 2020 ).
Dalam studi terkini, kami mengidentifikasi UMP sebagai bahan awal yang menarik (yaitu, relatif murah) untuk produksi ΨMP . Pekerjaan kami sebelumnya telah menunjukkan penggunaan U dan UMP untuk sintesis produk tak terfosforilasi Ψ . Penting untuk dicatat bahwa ΨMP tidak dapat diakses melalui reaksi kaskade satu pot yang digunakan sebelumnya (Gambar 1C ). Di sini, kami menyadari peluang untuk menyederhanakan reaksi kaskade enzimatik melalui pelepasan langsung Rib5P dari UMP (Gambar 1D ). Enzim untuk reaksi ini (nukleotida purin/pirimidin 5′-fosfat nukleosidase, PpnN; EC 3.2.2.10) pada prinsipnya diketahui (Sévin et al. 2017 ), tetapi belum dieksplorasi untuk biokatalisis terapan. Kami menunjukkan PpnN dari Escherichia coli untuk pembelahan UMP yang efisien menjadi Rib5P dan Ura . Karakterisasi PpnN yang dilakukan dalam penelitian ini mengidentifikasi penghambatan oleh Rib5P sebagai kriteria penting dalam memilih enzim yang sesuai untuk reaksi kaskade dengan C -glikosidase. Kami menunjukkan bahwa varian ganda PpnN yang dilaporkan sebelumnya (R341A-Y347A, singkatnya: RY; Zhang et al. 2019 ) menunjukkan aktivitas spesifik ∼5 kali lipat lebih tinggi terhadap UMP dan menunjukkan penghambatan ∼12 kali lipat lebih rendah oleh Rib5P daripada enzim tipe liar. Menggabungkan varian ganda PpnN dan C -glikosidase dalam transformasi satu pot dalam dua langkah, kami menunjukkan penataan ulang UMP yang bersih dan sangat efisien menjadi ΨMP (hasil: ≥ 95%). Produk C -riboside diperoleh pada batas kelarutannya (∼1,5 mol/L) dalam produktivitas 2,9 × 10 2 g/L/jam. Secara keseluruhan, integrasi dengan reaksi PpnN secara signifikan memperluas cakupan sintetik reaksi C -glikosidase untuk menyediakan prekursor Ψ ( MP ) yang penting untuk produksi blok penyusun mRNA.
2 Metode
2.1 Bahan
UMP (garam disodium) dan bahan kimia lainnya berasal dari Carl Roth (Karlsruhe, Jerman). Enzim yang digunakan berasal dari E. coli : ΨMP C -glikosidase (YeiN; nomor akses UniProt: P0ADR8) dan PpnN (nomor akses UniProt: P33025).
2.2 Persiapan Enzim
YeiN disiapkan melalui prosedur yang dilaporkan menggunakan ekspresi dalam E. coli NiCo21(DE3) dan pemurnian dengan kromatografi afinitas logam (Pfeiffer et al. 2023 ). Enzim dilengkapi dengan tag His 6 pada terminal N.
Teknik kloning standar digunakan untuk memperoleh vektor ekspresi plasmid untuk PpnN dan RY. Gen sintetis PpnN tipe liar diperoleh secara komersial. Mutasi yang mengakibatkan substitusi Arg341 oleh Ala dan Tyr347 oleh Ala untuk menghasilkan RY diperkenalkan melalui mutagenesis terarah. Prosedur yang digunakan diberikan secara lengkap dalam Informasi Pendukung. Untuk ekspresi, gen dikloning ke dalam vektor pET28a(+) untuk memperoleh enzim yang dilengkapi dengan tag His 6 terminal -C . Vektor ditransformasikan ke dalam E. coli kompeten NiCo21(DE3) dan dipilih pada pelat agar LB dengan kanamisin 0,05 mg/mL. Enzim disiapkan melalui ekspresi standar dan pemurnian melalui kromatografi afinitas logam. Rincian metode yang digunakan diberikan dalam Informasi Pendukung.
Kemurnian enzim yang digunakan dikonfirmasi oleh PAGE (Gambar S1 ).
2.3 Karakterisasi Enzim
2.3.1 Prosedur Umum Analisis Tingkat Awal
Kecuali disebutkan sebaliknya, semua reaksi dilakukan dalam buffer HEPES 50 mM (pH 7,5) pada suhu 40°C dalam volume total 100 µL. Eppendorf Thermomixer (Hamburg, Jerman) digunakan dan agitasi diatur pada 300 rpm. Reaksi dimulai dengan larutan enzim (≤ 2% dari volume total) yang ditambahkan ke larutan substrat yang suhunya seimbang. Konsentrasi substrat divariasikan dan ditentukan dalam masing-masing percobaan. Sampel sebanyak 15 µL diambil pada waktu tertentu, didinginkan dengan 65 µL campuran metanol dan air (1:1, berdasarkan volume), disentrifugasi selama 5 menit pada 27.150 × g , dan dianalisis dengan HPLC. Laju awal ditentukan dari rentang linier pembentukan produk (atau konsumsi substrat) dalam kondisi konversi substrat di bawah 20%. Dalam pengujian aktivitas, satuan (U) merujuk pada laju awal 1 µmol/menit produk yang dilepaskan atau substrat yang dikonsumsi.
2.3.2 Uji YeiN
Laju awal pelepasan ΨMP ditentukan pada 15 mM masing-masing Ura dan Rib5P menggunakan enzim 0,025 mg/mL. Sediaan YeiN menunjukkan aktivitas spesifik sebesar 7,0 U/mg, konsisten dengan literatur sebelumnya tentang enzim tersebut (Pfeiffer dan Nidetzky 2020 ).
2.3.3 Uji PpnN
Laju awal pelepasan Ura ditentukan menggunakan 30 mM UMP dengan 0,4 mg/mL enzim tipe liar atau 0,1 mg/mL RY. Aktivitas spesifik enzim dilaporkan pada Hasil. Uji standar dilakukan pada suhu 40°C dan pH 7,5. Profil suhu (30°C–60°C, pH 7,5) dan profil pH (40°C, pH 6,0–8,0) dari aktivitas juga dicatat.
2.3.4 Karakterisasi Kinetik PpnN
Laju awal pelepasan Ura ditentukan pada 6 konsentrasi UMP yang bervariasi (40°C, pH 7,5). Kisaran konsentrasi UMP dipilih secara individual untuk PpnN tipe liar dan RY. Penghambatan oleh Rib5P dipelajari pada tiga konsentrasi inhibitor yang bervariasi, mengukur laju awal tergantung pada konsentrasi UMP . Persamaan Michaelis–Menten standar dengan atau tanpa istilah untuk penghambatan kompetitif (Persamaan 1 ) oleh Rib5P digunakan untuk menyesuaikan data dengan regresi kuadrat terkecil nonlinier (SigmaPlot V10.0; Erkrath, Jerman). V (mM/menit) adalah laju awal, V maks (mM/menit) adalah laju awal maksimum, K m (mM) adalah konstanta Michaelis, dan K i (mM) adalah konstanta penghambatan.
![]()
Hubungan V max = k cat [E] digunakan untuk menentukan frekuensi turnover ( k cat ). [E] adalah konsentrasi molar subunit enzim yang ditentukan dari konsentrasi protein dan massa molekul (PpnN tipe liar: 51,794 Da; RY: 51,440 Da).
2.3.5 Hidrolisis UMP
Reaksi dilakukan seperti yang dijelaskan di atas menggunakan 100 mM UMP sebagai substrat. Konsumsi UMP dan pelepasan Ura tergantung pada waktu inkubasi diukur dengan HPLC. PpnN tipe liar dan RY digunakan. Kurva kemajuan yang dihasilkan disesuaikan berdasarkan Persamaan 1 dan neraca massa reaksi ( UMP → Ura + Rib5P ), menggunakan pemecah persamaan diferensial Berkeley Madonna 10.2.8. Pada waktu tertentu, sampel diambil dari reaksi dan diencerkan ke dalam uji aktivitas PpnN untuk menentukan apakah inaktivasi enzim telah terjadi.
2.4 Reaksi Kaskade untuk Sintesis ΨMP
Reaksi dilakukan dalam buffer HEPES 50 mM (pH 7,5) yang mengandung 15 mM MnCl2 pada suhu 40°C. Kecuali disebutkan sebaliknya, volume total yang digunakan adalah 300 µL. Inkubasi dilakukan dalam Thermomixer dengan agitasi pada kecepatan 300 rpm. UMP digunakan dalam konsentrasi 100 hingga 1700 mM. Konsentrasi R Y dan YeiN disesuaikan dengan konsentrasi substrat dalam kisaran 0,5–4,0 mg/mL. Rasio massa R Y dan YeiN juga divariasikan. Kondisi dilaporkan di bawah Hasil dengan eksperimen masing-masing. Sampel yang diambil dari waktu ke waktu dianalisis dengan HPLC. UMP , Ura , dan ΨMP dikuantifikasi. Telah diverifikasi bahwa hasil yang dilaporkan konsisten berdasarkan keseimbangan massa yang dekat.
2.5 Sintesis Preparatif ΨMP
Sintesis ΨMP dilakukan dalam labu alas bulat 10 mL yang ditempatkan dalam penangas air untuk pengendalian suhu pada suhu 40°C. Pengadukan magnetik (IKA RCT basic, Staufen, Jerman) pada 900 rpm digunakan untuk pencampuran. UMP (garam dinatrium; 1,84 g, 5 mmol; konsentrasi akhir: 1,0 M) dan MnCl2 ( 0,009 g; konsentrasi akhir: 15 mM) dilarutkan dalam 3,0 mL air suling ganda. pH diatur menjadi 7,4 dengan 1 M NaOH. Volume akhir ditetapkan menjadi 5,0 mL dengan menambahkan air. Konsentrasi UMP diperiksa dengan absorbansi pada 260 nm. Reaksi dimulai dengan enzim: 1,0 mg/mL RY, 2,0 mg/mL YeiN.
Setelah konversi UMP (HPLC, 97%) selesai, campuran dipanaskan (100°C selama 5 menit), endapan disentrifugasi (5 menit pada 27.150 × g ) dan supernatan disaring menggunakan Amicon Ultra-15 Centrifugal Filter Units (Millipore, Billerica, MA, AS). Permeat dibekukan dalam nitrogen cair dan dikeringkan dalam kondisi beku beku dengan pengering beku Alpha 1-4 LSCplus (Martin Christ Gefriertrocknungsanlagen GmbH, Osterode am Harz, Jerman) yang dihubungkan ke pompa vakum VACUUBRAND (Wertheim, Jerman) model RZ 6. Produk yang dihasilkan (1,6 g) adalah ΨMP dengan kemurnian 93% (berdasarkan massa).
Hasil : 1,60 g (4,35 mmol), 87%, padatan tidak berwarna, C 9 H 11 Na 2 N 2 O 9 P [368.15].
1 H NMR (400 MHz, D 2 O) δ = 7,69 (s, 1H, H-3), 4,60 (d, J = 3,4 Hz, H-5), 4,07 (t, J = 5,9 Hz, 1H, H-7), 4,02 (d, J = 4,0 Hz, 1H, H-6), 3,93 – 3,84 (m, 2H, H-8, H-9), 3,73 (dd, J = 11,6, 5,0 Hz, 1H, H-9). Gliserol (10 mol %).
13 C NMR (101 MHz, D 2 O) δ = 165,20 (C q , C-1), 152,77 (C q , C-2), 141,02 (CH, C-3), 111,54 (C q , C-4), 81,31 (d, J = 8,3 Hz CH, C-8), 78,60 (CH, C-5), 74,29 (CH, C-6), 69,77 (CH, C-7), 63,00 (d, J = 4,4 Hz, CH 2 , C-9).
2.6 Analisis
2.6.1 Resonansi magnetik nuklir
Spektrum direkam pada spektrometer JNM-ECZL 400 MHz JEOL (Freising, Jerman) ( 1 H: 399,78 MHz, 13 C: 100,53 MHz, 31 P: 161,83 MHz) dan diproses dengan perangkat lunak JEOL. Rinciannya diberikan dalam Informasi Pendukung.
2.6.2 Analisis KCKT
Metode ion-pairing fase terbalik dengan deteksi UV pada 260 nm digunakan (Informasi Pendukung). UMP , Ura , dan ΨMP dipisahkan dari garis dasar dan diukur secara individual menggunakan standar asli sebagai referensi.
2.6.3 Penentuan Konsentrasi
Absorbansi diukur dengan Spektrofotometer DeNovix (Wilmington, DE, AS) DS-11 dan konsentrasi dihitung dengan koefisien kepunahan molar. Ura (258 nm, 8,3 mM −1 cm −1 ), UMP (262 nm, 10 mM −1 cm −1 ), ΨMP (262 nm, 7,5 mM −1 cm −1 ), YeiN (280 nm, 10.095 M −1 cm −1 ; 32.909 Da), dan PpnN/RY (280 nm 10.095 M −1 cm −1 ; 32.909 Da).
3 Hasil dan Pembahasan
3.1 Karakterisasi PpnN
PpnN tipe liar dan varian RY diperoleh sebagai preparat protein murni (Gambar S1 ) dari kultur ekspresi berlebih E. coli dengan hasil sekitar 125 mg/L. Kedua enzim mempertahankan aktivitas penuhnya selama lebih dari 1 bulan saat disimpan beku pada suhu -20°C. RY dipilih karena aktivitasnya untuk hidrolisis xantin 5′-fosfat sebelumnya dilaporkan sekitar 2,3 kali lipat lebih tinggi daripada enzim tipe liar (Zhang et al. 2019 ). RY berbeda dari enzim tipe liar lebih jauh karena aktivitasnya tidak lagi dikontrol secara alosterik oleh pembawa pesan metabolik guanosin 3′,5′-bispirofosfat (ppGpp) dan alih-alih tetramer, ia hadir sebagai monomer dalam larutan (Zhang et al. 2019 ). Aktivitas spesifik RY yang diukur dengan UMP (30 mM) pada suhu 40°C dan pH 7,5 adalah 9,8 (±1,6; N = 6) U/mg yang melebihi PpnN tipe liar dalam kondisi yang sama sekitar ~5 kali lipat (2,6 ± 0,8 U/mg; N = 6). Suhu dan pH ditetapkan agar sesuai dengan kondisi yang digunakan sebelumnya untuk reaksi kaskade C -glikosidase (Pfeiffer dan Nidetzky 2020 ; Pfeiffer et al. 2023 ). Namun, profil suhu dan pH hidrolisis UMP (Gambar S2 dan S3 ) menunjukkan bahwa kondisi yang digunakan jatuh tepat ke dalam kisaran operasional yang sesuai dari enzim tipe liar dan RY. Profil pH enzim tipe liar pada suhu 40°C diperluas sedikit lebih ke dalam kisaran basa (pH 8,0) daripada profil pH RY pada suhu yang sama (Gambar S2 ). Kisaran pH optimum untuk kedua enzim adalah 6,0–7,0. Namun, pH 7,5 masih dapat digunakan dengan ~75—80% dari aktivitas maksimum dipertahankan pada PpnN tipe liar dan RY (Gambar S2 ). Untuk kedua enzim, profil suhu pada pH 7,5 menunjukkan maksimum pada 50°C (Gambar S3 ). Reaksi PpnN yang dilakukan pada pH 7,5°C dan 40°C dengan demikian didukung. Sedikit perbedaan dalam ketergantungan pH dan suhu aktivitas untuk kedua enzim mungkin timbul dari fakta bahwa PpnN tipe liar adalah tetramer fungsional sedangkan RY adalah monomer (Zhang et al. 2019 ).
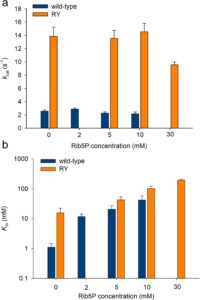
Laju awal hidrolisis UMP menunjukkan ketergantungan hiperbolik pada konsentrasi substrat untuk kedua enzim (Gambar S4 ). Parameter kinetik mengungkapkan bahwa RY ( k cat = 13,4. ± 1,4 s − 1 ) adalah ∼5 kali lipat lebih cepat daripada PpnN tipe liar ( k cat = 2,6 ± 0,2 s −1 ). Namun, pengikatan UMP yang tampak adalah ∼15 kali lipat lebih lemah untuk RY ( K m = 15,5 ± 6,6 mM) dibandingkan dengan PpnN tipe liar ( K m = 1,1 ± 0,4 mM). Dalam hal efisiensi katalitiknya ( k cat / K m ), kedua enzim tersebut serupa (tipe liar: 2,3; RY: 0,9).
3.2 Hidrolisis UMP
PpnN tipe liar dan RY dibandingkan dalam percobaan jangka waktu hidrolisis UMP (Gambar 2 ). Ketika diaplikasikan pada konsentrasi protein yang sama (2,0 mg/mL), RY memberikan konversi yang lebih cepat daripada PpnN tipe liar. Selain itu, laju reaksi tipe liar menurun lebih cepat dengan kemajuan konversi substrat daripada RY (Gambar 2 ). Reaksi RY mencapai 92% hidrolisis UMP yang digunakan (100 mM) hanya dalam ∼120 menit. Reaksi tipe liar yang sesuai mendatar setelah waktu yang sama, sehingga akan memerlukan perpanjangan waktu reaksi yang tidak proporsional (≥ 400 menit) untuk mencapai konversi yang sama. Kami menentukan bahwa kedua enzim mempertahankan aktivitasnya sepenuhnya selama 3 jam dalam kondisi yang digunakan, sehingga mengesampingkan bahwa perbedaan stabilitas enzim merupakan faktor yang relevan. Kami berspekulasi bahwa penghambatan oleh Rib5P mungkin penting dan mengejar gagasan itu dengan dua jenis percobaan.
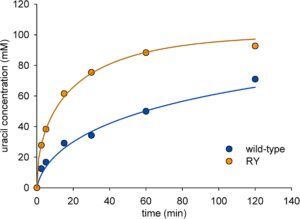
Pertama, kami menerapkan model kinetik Michaelis–Menten dengan penghambatan produk kompetitif oleh Rib5P agar sesuai dengan rangkaian waktu pada Gambar 2. Km dan k cat ditetapkan konstan menggunakan nilai dari karakterisasi laju awal, dan konstanta penghambatan ( Ki ) untuk Rib5P disesuaikan. Ki diperkirakan sebesar 1,2 mM untuk RY yang 12 kali lipat lebih tinggi daripada Ki yang diperkirakan sebesar 0,1 mM untuk enzim tipe liar. Rasio Km / Ki melebihi nilai kesatuan untuk kedua enzim (tipe liar: 11; RY: 13), yang menunjukkan penghambatan yang agak kuat oleh produk yang terakumulasi. Secara umum, orang menganggap rasio Km / Ki sebesar 0,1 atau lebih kecil menguntungkan untuk produksi enzimatik yang sebagian besar tidak terpengaruh oleh penghambatan produk. Namun, efek penghambatan dalam hidrolisis UMP jelas lebih parah pada PpnN tipe liar daripada RY (Gambar 2 ) . Kami memperhitungkan penghambatan Rib5P terhadap PpnN dalam desain reaksi kaskade berikutnya untuk sintesis ΨMP dari UMP . C -glikosidase YeiN selalu digunakan dalam jumlah dua kali lipat lebih banyak daripada PpnN dengan tujuan untuk menghilangkan Rib5P lebih cepat daripada saat dilepaskan dari UMP .
Dalam pendekatan kedua, kami mempelajari penghambatan Rib5P secara langsung (Gambar S5 dan S6 ). Hasil menunjukkan bahwa dengan PpnN tipe liar dan RY, penghambatan oleh Rib5P menghilang pada konsentrasi UMP yang jenuh sehingga k cat yang diestimasikan tidak terpengaruh secara substansial (Gambar 3a ). Sebaliknya, K m yang diestimasikan meningkat tajam untuk kedua enzim (Gambar 3b ), yang menunjukkan bahwa penghambatan tersebut bersifat kompetitif dalam setiap kasus. Hasilnya signifikan mengingat bahwa struktur PpnN tipe liar menunjukkan situs alosterik untuk pengikatan pembawa pesan sekunder ppGpp. Situs alosterik terletak di antarmuka subunit-subunit dari enzim tipe liar tetramerik (Zhang et al. 2019 ). Itu terganggu dalam varian RY yang ditunjukkan dari pekerjaan sebelumnya tidak dapat dioligomerisasi menjadi tetramer (Zhang et al. 2019 ). Penghambatan oleh Rib5P pada PpnN tipe liar mungkin juga muncul karena afinitas primitif situs ppGpp untuk mengikat gula terfosforilasi termasuk Rib5P . Kemungkinan ini dikesampingkan oleh data yang ditampilkan. Efek Rib5P pada Km berbeda antara enzim tipe liar dan RY. Pada 10 mM Rib5P , Km tipe liar meningkat 40 kali lipat (1,1 hingga 41 mM) sedangkan Km RY hanya meningkat 6,7 kali lipat (15 hingga 100 mM). Kesesuaian nonlinier dari data kinetik (Gambar S5 dan S6 ) memberikan estimasi K i sebesar 1,2 ± 0,1 mM untuk RY. Estimasi K i yang sesuai untuk enzim tipe liar adalah 0,1 mM. Kedua nilai tersebut konsisten dengan estimasi K i yang diperoleh dari kesesuaian rangkaian waktu hidrolisis UMP (Gambar 2 ).
3.3 Penataan Ulang Satu Pot UMP Menjadi ΨMP
Waktu tempuh pelepasan ΨMP dari UMP (100 mM) melalui reaksi kaskade RY dan YeiN ditunjukkan pada Gambar 4a . Substrat digunakan secara menyeluruh dalam waktu 30 menit dan jumlah produk yang sesuai (≥ 95%) dilepaskan. Ura hadir dalam jumlah rendah (~5%) sesuai dengan keseimbangan massa yang dekat untuk transformasi keseluruhan. Reaksi kaskade linear (Gambar 1d ) mencapai penataan ulang bersih UMP menjadi ΨMP dengan hasil yang tinggi. Waktu tempuh yang sesuai dari reaksi kaskade PpnN dan YeiN tipe liar ditunjukkan pada Gambar 5. Meskipun penataan ulang keseluruhan sama selektifnya (≥ 95% hasil ΨMP pada UMP yang dikonversi) seperti pada reaksi RY, konversi substrat berlangsung lebih lambat (≥ 2,5 kali lipat) ketika PpnN tipe liar digunakan. Dengan membandingkan kedua reaksi pada konversi UMP sebesar 80% , produktivitas reaksi RY adalah ∼5 kali lipat dari reaksi PpnN tipe liar. Hasilnya menegaskan manfaat optimasi reaksi yang dihasilkan dari penggunaan RY sebagai ganti PpnN tipe liar.
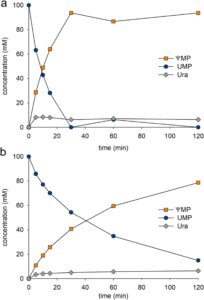
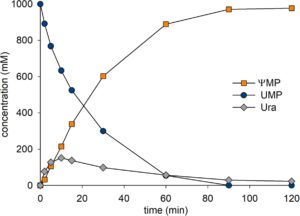
Reaksi RY berlangsung hingga selesai ( konversi UMP ≥ 95%) dengan hanya sedikit penurunan laju reaksi dengan penipisan substrat yang progresif (Gambar 4a ). Ini menunjukkan bahwa efek penghambatan Rib5P rendah, tentu lebih rendah daripada yang tampak dalam reaksi dengan PpnN tipe liar yang melibatkan rangkaian waktu melengkung yang mendekati konversi penuh hanya secara perlahan (Gambar 4b ). Pentingnya tarikan kinetik oleh reaksi YeiN untuk menghilangkan Rib5P yang dilepaskan dari UMP ditunjukkan dalam percobaan di mana rasio massa RY dan YeiN divariasikan pada pemuatan protein total yang konstan. Hasil pada Gambar S7 mendukung gagasan penggunaan RY sebagai enzim pembatas. Ketika YeiN hadir dalam jumlah massa yang sama dengan, atau dua kali lipat lebih tinggi dari, jumlah RY, reaksi berlangsung pada kecepatan penuh yang mungkin (Gambar S7 ). Menurunkan jumlah YeiN di bawah jumlah RY yang digunakan mengakibatkan penurunan konversi yang signifikan, kemungkinan karena meningkatnya penghambatan RY oleh Rib5P yang terakumulasi .
3.4 Intensifikasi Reaksi untuk Produksi ΨMP
Kami menggunakan reaksi kaskade oleh RY dan YeiN untuk menilai produksi ΨMP pada konsentrasi tinggi substrat UMP (500–1700 mM). Dengan menjaga rasio massa RY dan YeiN konstan pada 1:2, konsentrasi enzim disesuaikan untuk memungkinkan konversi substrat sekitar 80% atau lebih dalam 2 jam. Kelarutan UMP ditemukan terbatas pada sekitar 1,5 M dalam kondisi yang digunakan. Gambar S8 menunjukkan rangkaian waktu reaksi yang diperoleh. Hasil yang sangat baik dan selektivitas dari keseluruhan penataan ulang dipertahankan pada konsentrasi UMP yang tinggi . Untuk menghindari presipitasi spontan UMP atau ΨMP , kami memutuskan untuk membatasi konsentrasi awal UMP menjadi 1 M. Peningkatan skala reaksi dari 100 µL menjadi 5,0 mL memungkinkan sintesis preparatif ΨMP . Seperti yang ditunjukkan pada Gambar 5 , reaksi berlangsung hingga menghasilkan 95% hasil dan melibatkan produktivitas unggul sebesar 900 mM/jam atau dalam satuan massa, 294 g/L/jam. Setelah enzim dihilangkan dengan ultrafiltrasi, larutan produk dikeringkan dalam suhu beku untuk memperoleh 1,6 g ΨMP dengan kemurnian 95% (HPLC) dan hasil isolasi sebesar 85%. Struktur kimia ΨMP yang diisolasi diverifikasi dengan NMR (Gambar S9,S10 ).
Tabel 1 merangkum metrik utama efisiensi reaksi (Kaspar et al. 2021 ; Meissner dan Woodley 2022 ) untuk produksi ΨMP dari UMP melalui transformasi kaskade RY-YeiN dan menggunakan metrik ini untuk membandingkan berbagai pendekatan biokatalisis kaskade (Gambar 1b,c ; Rute 1, 2, dan 4) untuk sintesis ΨMP atau Ψ . Cakupan sintesis transformasi RY-YeiN (Gambar 1d ) unik karena ΨMP diperoleh dari UMP . Sebelumnya, reaksi kaskade satu pot dari empat enzim digunakan untuk mengubah UMP tetapi produknya adalah Ψ (Gambar 1c ). Rute ke ΨMP dimulai dari U atau Rib . Dibandingkan dengan rute-rute lain ini, reaksi RY-YeiN disederhanakan untuk melibatkan lebih sedikit langkah dan enzim (2, bukan 3 atau 4). Total penggunaan enzim diturunkan hingga tiga kali lipat dan produktivitas ditingkatkan hingga 16 kali lipat. Hasil konversi (≥ 95%) dan konsentrasi produk akhir (950 mM) keduanya sangat baik. Operasi proses sederhana tanpa persyaratan untuk kontrol pH yang dibutuhkan dalam sintesis ΨMP dari Rib . Pekerjaan yang mudah menghasilkan faktor-E rendah sebesar 3,0 (Informasi Pendukung, berkas perhitungan faktor-E) dan kemurnian produk tinggi (≥ 93%, berdasarkan massa). Ura dan Rib5P hadir di bawah 3% (berdasarkan massa). Lebih lanjut hadir dalam massa% MnCl2 ( 0,5%) dan gliserol (0,5%) sebagai bentuk kontaminasi dari filtrasi sentrifugal. TON berbasis massa dari total enzim yang digunakan dalam reaksi mencapai 100 g produk/g enzim. Perhatikan bahwa daur ulang enzim tidak dipertimbangkan pada tahap ini untuk lebih meningkatkan TON. Berdasarkan beberapa kriteria efisiensi sintetis seperti yang ditunjukkan pada Tabel 1 (Informasi Pendukung, berkas perhitungan faktor-E), produksi ΨMP dari UMP oleh RY dan YeiN yang digabungkan setara, atau bahkan mengungguli, transformasi kaskade yang dilaporkan sebelumnya untuk menghasilkan ΨMP atau Ψ . Dalam hal biaya substrat, UMP merupakan bahan awal yang mudah dijual dalam jumlah kg; harga pasar yang diantisipasi untuk produksi yang ditingkatkan serupa dengan U atau Rib dan Ura . Dengan asumsi skalabilitas sempurna dari skala mL ke skala L, volume reaksi yang diperlukan untuk memperoleh 1 kg ΨMP dihitung sebagai 3,1 L.
| Pengidentifikasi rute a | Enzim b | Substrat | Produk | Produktivitas (g/L jam)/(mM/jam) | TON c (gram/gram) | Pemuatan enzim (mg/mL) | menghasilkan (%) | kemurnian (%) | titer (mM) | Faktor E | Reagen pembantu | Referensi |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2 | YjjG, UP, DeoB, YeiN | UMP | aku | tahun 18/74 | 22 | 9.0 | 80 | 80 hari | 800 | 3,4 kaki | Mn2 + | Pfeiffer dan kawan-kawan ( 2023 ) |
| 1 | UP, DeoB, YeiN | kamu | ΨMP | 30/93 | 74 | 4.3 | 97 | 95 | tahun 970 | 2.4 | Mn2 + | Pfeiffer dan kawan-kawan ( 2023 ) |
| 4 | RbsK, AcK, YeiN | Tulang rusuk, Ura | ΨMP | 38/117 | 146 | 2.0 | 90 | 70 hari | 650 | 43 kaki | ATP, ACP, Mg2 + | Ribar dan kawan-kawan ( 2024 ) |
| 5 | RY, YeiN | UMP | ΨMP | nomor 294/906 | 103 | 3.0 | 95 | 95 | 950 | 3.0 | Mn2 + | Studi ini |
Pengenal rute seperti yang digambarkan pada Gambar 1 . b Nama enzim yang digunakan: RY, R341A-Y347A varian ganda dari PpnN (EC 3.2.2.10); UP, U fosforilase (EC 2.4.2.3); DeoB, fosfopentomutase (EC 5.4.2.7); YjjG, nukleotida 5′-fosfat fosfatase (EC 3.1.3.5); RbsK, ribokinase (EC 2.7.1.15); AcK, asetat kinase (EC 2.7.2.1); YeiN, ΨMP - C -glikosidase (EC 4.2.1.70). c TON (angka turnover) berbasis massa adalah jumlah gram produk yang diproduksi dan enzim yang digunakan. d Senyawa tidak diisolasi, kemurnian mengacu pada kelimpahan relatifnya dalam campuran reaksi. e Faktor E adalah rasio massa limbah per massa produk. Produksi enzim tidak termasuk dalam perhitungan. Lihat Informasi Pendukung (berkas perhitungan faktor E). f Faktor E dihitung dengan mengesampingkan isolasi produk. Lihat Informasi Pendukung (berkas perhitungan faktor E).
4 Kesimpulan
Transformasi kaskade baru UMP untuk memperoleh ΨMP dalam penataan ulang β-riboside NC yang ekonomis secara sempurna telah disajikan. Transformasi tersebut diwujudkan dengan menggabungkan reaksi nukleosidase dari PpnN dan reaksi kondensasi CC dari YeiN. Varian ganda R341A-Y347A dari E. coli PpnN kurang dihambat oleh Rib5P daripada enzim tipe liar dan oleh karena itu lebih disukai untuk digunakan bersama dengan YeiN dalam konversi satu pot UMP menjadi ΨMP . Sebagai strategi untuk meminimalkan penghambatan yang disebabkan oleh akumulasi perantara Rib5P , reaksi dilakukan dengan menggunakan YeiN secara berlebihan dibandingkan dengan PpnN. ΨMP diperoleh dalam hasil ≥ 95% pada lebih dari 300 g/L produk dengan produktivitas unggul sebesar 2,9 × 10 2 g/L/jam. Produk yang diterima setelah penghilangan enzim dan liofilisasi menunjukkan kemurnian tingkat teknis yang tinggi (≥ 93%). Jumlah gram ΨMP diperoleh dari reaksi berjenjang hanya dalam 5,0 mL volume total. Secara keseluruhan, hasil penelitian ini menekankan potensi besar biokatalisis untuk memungkinkan pengembangan proses manufaktur yang lebih efisien dan ramah lingkungan untuk produksi farmasi (Benítez-Mateos et al. 2022 ; France et al. 2023 ; Pollard dan Woodley 2007 ).




Tinggalkan Balasan