Keranjang Anda kosong!
Peningkatan Pertumbuhan Sel Punca Mesenkimal yang Berasal dari Sumsum Tulang pada Mikropembawa yang Diikat dengan Faktor Pertumbuhan Fibroblast Dasar yang Direkayasa

ABSTRAK
Bioreaktor berbasis mikrokarir telah dipelajari secara ekstensif untuk perluasan sel punca mesenkimal manusia (hMSC) untuk digunakan dalam terapi regeneratif. Untuk memaksimalkan efisiensi perluasan, kami mengembangkan mikrokarir yang mengikat faktor pertumbuhan fibroblast dasar (bFGF) pada permukaannya. Dengan menggunakan teknologi DNA rekombinan, bFGF dipadukan dengan peptida pengikat kolagen (CBP) dan diikat ke mikrokarir yang telah dilapisi dengan kolagen tipe I. Dalam penelitian ini, kami memeriksa dua jenis CBP: peptida 28-mer yang berasal dari osteopontin manusia (CBP1) dan peptida 11-mer yang berasal dari dekorin manusia (CBP2). Protein chimeric, CBP1-bFGF dan CBP2-bFGF, disiapkan menggunakan sistem ekspresi bakteri. Strukturnya dianalisis dengan spektroskopi dikroisme sirkuler dan prediksi struktur berbasis komputer, dan fungsi biologisnya dinilai dalam kultur hMSC. Berdasarkan hasil percobaan ini, kondisi pelipatan ulang dioptimalkan untuk meningkatkan hasil CBP1-bFGF dan CBP2-bFGF yang larut dan bioaktif. Mikropembawa yang diikat dengan CBP1-bFGF dan CBP2-bFGF meningkatkan pertumbuhan hMSC tanpa mengubah ekspresi penanda permukaan dan kemampuan diferensiasi osteogenik secara signifikan. Temuan ini menyoroti potensi mikropembawa yang diikat dengan bFGF sebagai komponen bioreaktor penting untuk ekspansi hMSC.
1 Pendahuluan
Sel punca mesenkimal manusia (hMSC) telah menerima perhatian besar karena potensinya sebagai sumber sel untuk terapi regeneratif yang menargetkan berbagai penyakit dan cedera traumatis [ 1 ]. hMSC dan jenis sel serupa dapat diperoleh dari berbagai macam jaringan [ 2 , 3 ], seperti sumsum tulang, jaringan adiposa, tali pusat, pulpa gigi, dan gigi sulung yang terkelupas. Sel-sel ini dapat diperluas secara eks vivo untuk aplikasi klinis hilir. Hingga saat ini, banyak penelitian menggunakan model hewan telah menunjukkan kelayakan penggunaan hMSC dalam terapi regeneratif, yang telah mempercepat studi klinis untuk mengobati gangguan [ 4 , 5 ].
Meskipun potensi terapeutik hMSC besar, jumlah hMSC yang dapat diisolasi dari jaringan donor terbatas dan jauh lebih kecil daripada yang dibutuhkan untuk terapi penggantian sel. Hanya 10 1 −10 2 hMSC yang dapat diisolasi dari 1 mL aspirasi sumsum tulang [ 6 ]. Khususnya, hanya 10 3 −10 4 hMSC yang dapat diisolasi dari sumsum tulang anak Jepang berusia sekitar 9 tahun, yang merupakan usia yang tepat untuk perawatan bedah cacat langit-langit sumbing. Behnia et al. [ 7 ] mentransplantasikan 5 × 10 5 hMSC ke dalam cacat celah alveolar bersama dengan perancah bifasik dan faktor pertumbuhan yang berasal dari trombosit. Dalam kasus ini, sel harus diperbanyak setidaknya 100−1000 kali sebelum transplantasi.
Berbagai upaya telah dilakukan untuk mengembangkan sistem bioreaktor baru untuk perluasan skala besar hMSC yang sesuai secara klinis [ 8 , 9 ]. Sistem ini memanfaatkan pendukung kultur sel, seperti serat berongga [ 10 ], kain bukan tenunan [ 11 ], dan pembawa mikro [ 12 − 15 ]. Luas permukaan spesifik yang besar dari pendukung ini memungkinkan kultur sel dengan kepadatan tinggi sambil mengurangi jumlah media yang dibutuhkan. Sistem bioreaktor juga bermanfaat untuk membangun lingkungan kultur tertutup yang menguntungkan untuk aplikasi klinis produk ini [ 16 ]. Di antara substrat ini, bioreaktor berbasis pembawa mikro telah diperiksa secara ekstensif karena ketersediaannya dan pengalaman sebagai platform serbaguna untuk produk rekayasa sel [ 17 , 18 ].
Salah satu tantangan paling kritis dari sistem mikropembawa saat ini untuk hMSC adalah untuk memaksimalkan efisiensi ekspansi mereka [ 19 ]. hMSC berkembang biak selama beberapa generasi; namun, kultur yang diperpanjang telah dilaporkan menyebabkan penuaan [ 20 ] dan penurunan potensi diferensiasi [ 21 ]. Faktor pertumbuhan fibroblast dasar (bFGF) adalah mitogen hMSC yang kuat yang mempertahankan kesukuan dan menunda penuaan [ 22 , 23 ]. Mempertimbangkan fungsi-fungsi ini, kelompok kami mencoba untuk mengembangkan substrat kultur tempat bFGF diikat di permukaan [ 24 ]. Kami menunjukkan bahwa permukaan yang diikat bFGF meningkatkan proliferasi hMSC sambil mempertahankan potensi diferensiasi multilineage mereka.
Untuk memaksimalkan efisiensi proliferasi hMSC pada mikropembawa, kami menerapkan teknik pengikatan bFGF kami pada permukaan mikropembawa berbasis polistirena. Karena sifat adhesi sel polistirena yang buruk, mikropembawa berlapis kolagen tipe I digunakan dalam penelitian ini. Untuk mengikat bFGF, peptida pengikat kolagen (CBP) digabungkan ke bFGF menggunakan teknologi rekayasa genetika dan diikat ke permukaan mikropembawa berlapis kolagen. Dua CBP yang berbeda digunakan, dan kelayakannya sebagai adaptor antara kolagen dan bFGF dievaluasi. Kami selanjutnya menunjukkan bagaimana pengikatan bFGF secara efektif meningkatkan hasil hMSC yang tidak berdiferensiasi.
2 Bahan dan Metode
2.1 Desain bFGF Pengikat Kolagen
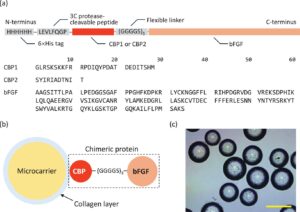
Protein chimeric pengikat kolagen, yang terdiri dari CBP dan bFGF, disintesis menggunakan teknologi DNA rekombinan dan sistem ekspresi bakteri (Gambar 1a ). Protein chimeric dirancang untuk berasosiasi dengan permukaan mikropembawa berlapis kolagen (Gambar 1b ). Dalam penelitian ini, kami memperoleh dua peptida dari osteopontin manusia [ 25 ] dan decorin [ 26 ], dan menggunakannya sebagai CBP. Peptida ini disebut sebagai CBP1 dan CBP2. Tag heksahistidin (6×His) ditambahkan ke N-terminal protein chimeric untuk pemurnian afinitas. Pentadekapeptida, (GGGGS) 3 , disisipkan sebagai penghubung fleksibel [ 27 ]. Selain itu, oktapeptida, LEVLFQGP, terdapat di antara tag 6×His dan CBP. Peptida okta ini dapat dibelah menggunakan protease human rhinovirus 3C [ 28 ] untuk menghilangkan tag 6×His dari protein chimeric bila diperlukan.
2.2 Prediksi Struktur
Struktur tersier protein chimeric diprediksi secara komputasional menggunakan program AlphaFold2 berbasis kecerdasan buatan [ 29 , 30 ]. Kami menggunakan struktur primer protein chimeric sebagai input dan memperoleh hasil prediksi dalam format berkas Protein Data Bank (PDB). Dalam penelitian ini, struktur tersier yang paling mungkin diadopsi untuk CBP1-bFGF dan CBP2-bFGF. Untuk memeriksa efek penggabungan CBP dan peptida lain, termasuk tag 6×His, linker, dan peptida yang dapat dibelah protease 3C, pada struktur bFGF, struktur domain bFGF yang diprediksi diselaraskan dengan struktur kristal bFGF asli non-chimeric yang ditentukan untuk 129 asam amino (asam amino 26−154) (PDB ID: 1BFF). Untuk menilai perubahan struktural, deviasi akar rata-rata kuadrat (RMSD) ditentukan menggunakan USCF ChimeraX [ 31 , 32 ] untuk perpindahan setiap atom tulang punggung antara protein chimeric dan bFGF asli.
2.3 Persiapan Protein Chimeric
Persiapan CBP2-bFGF telah dilaporkan sebelumnya [ 33 ]. Dalam penelitian ini, CBP1-bFGF disiapkan menggunakan metode yang serupa. Rincian persiapan CBP1-bFGF dan CBP2-bFGF dijelaskan di bawah ini. Semua percobaan DNA rekombinan dilakukan dengan persetujuan Komite Keamanan Universitas Hiroshima untuk Organisme Hidup yang Dimodifikasi.
Pertama, plasmid pET-22b(+) (Novagen, Madison, WI, AS) dilinearisasi menggunakan reaksi berantai polimerase terbalik sehingga DNA yang teramplifikasi mengandung kodon awal di ujungnya, sedangkan ujung lainnya diakhiri dengan nukleotida tepat setelah kodon stop pada plasmid asli. Selain itu, DNA yang mengkode CBP1-bFGF dan CBP2-bFGF disintesis menggunakan layanan GeneArt DNA Strings DNA Fragments (Thermo Fisher Scientific, Waltham, MA, AS). Ujung DNA dirancang untuk memiliki fragmen 15-mer tambahan yang homolog dengan ujung 5′ dan 3′ dari pET-22b(+) yang dilinearisasi, yang mengandung kodon stop di ujung 3′. DNA diligasikan ke vektor plasmid linierisasi menggunakan metode kloning tanpa sambungan [ 34 ] dengan In-Fusion HD Cloning Kit (Laboratorium Clontech, Mountain View, CA, AS) untuk memperoleh plasmid sirkuler. Plasmid ini dikloning dalam Escherichia coli ( E. coli ), DH5α (Takara Bio, Kusatsu, Jepang) untuk memperoleh vektor ekspresi, pET22b-CBP1-bFGF dan pET22b-CBP2-bFGF. Keakuratan urutan yang disisipkan dikonfirmasi dengan pengurutan.
Vektor ekspresi diperkenalkan ke dalam E. coli , sel kompeten BL21-CodonPlus (DE3)-RIPL (Agilent Technologies, Santa Clara, CA, AS) dan dikultur dalam 200 mL medium lisogeni atau terrific broth. Ketika pertumbuhan sel mencapai fase log, 1 mM isopropil β-D-thiogalactopyranoside (IPTG, Nacalai Tesque, Kyoto, Jepang) ditambahkan untuk menginduksi ekspresi gen yang diatur operon lak , yang mengarah pada pembentukan CBP1-bFGF atau CBP2-bFGF. Setelah 3 jam kultur tambahan, sel dilisiskan menggunakan BugBuster Protein Extraction Reagent (Novagen) yang mengandung benzonase nuclease (Novagen) dan lisozim (Sigma-Aldrich, St. Louis, MO, AS). Akhirnya, protein yang diekspresikan diperoleh dalam bentuk yang tidak larut dan dilarutkan dengan menambahkan 8 M urea. Protein kemudian dimurnikan dengan kromatografi afinitas logam terimobilisasi menggunakan kolom HisTrap HP (Cytiva, Chicago, IL, AS) dalam kondisi denaturasi dengan 8 M urea.
2.4 Pelipatan Ulang Protein Chimeric
Untuk menghilangkan urea, buffer pertukaran, dan melipat ulang protein chimeric, larutan protein chimeric yang dimurnikan didialisis bertahap terhadap tiga rangkaian larutan buffer yang berbeda. Komposisi dialisat tercantum dalam Tabel S1−S3 . Pada Kondisi 1, protein didialisis terhadap buffer sitrat pada pH 5,0, karena penelitian kami sebelumnya menunjukkan bahwa bFGF dengan tag 6×His menunjukkan aktivitas biologis yang lebih tinggi setelah dialisis pada kondisi ini daripada buffer netral lainnya [ 24 ]. Namun, paparan buffer sitrat asam dihindari pada Kondisi 2. Pada Kondisi 3, 500 mM NaCl ditambahkan untuk mencegah agregasi protein [ 35 ]. Dialisis dilakukan pada suhu 4°C selama lebih dari 4 jam pada setiap langkah. Dalam semua kasus, larutan protein yang diperoleh setelah dialisis disterilkan dengan penyaringan melalui filter membran Millipore (ukuran pori 0,22 µm) dan disimpan pada suhu -80°C hingga digunakan.
2.5 Karakterisasi Protein Chimeric
Konsentrasi protein ditentukan menggunakan Micro BCA Protein Assay Kit (Thermo Fisher Scientific). Larutan bovine serum albumin (BSA) pada berbagai konsentrasi digunakan sebagai standar.
Kemurnian dan ukuran molekul protein chimeric dianalisis dengan elektroforesis gel poliakrilamid-natrium dodecyl sulfate (SDS-PAGE) menggunakan gel poliakrilamid 12% (Bio-Rad Laboratories, Hercules, CA, AS). Protein yang dipisahkan pada gel divisualisasikan dengan pewarnaan dengan Coomassie brilliant blue.
Struktur sekunder protein chimeric dianalisis dengan spektroskopi dikroisme sirkular (CD) menggunakan spektrofotometer J-850 (JASCO, Tokyo, Jepang) dan kuvet kuarsa dengan panjang lintasan 2 mm. Spektrum CD ultraviolet jauh direkam pada panjang gelombang berkisar antara 190 hingga 260 nm pada 20°C dengan akumulasi 16. Data dinyatakan sebagai eliptisitas residu rata-rata. Spektrum CD bFGF asli non-chimeric (PBD ID: 1BFF) disimulasikan secara komputasional menggunakan program PDBMD2CD [ 36 , 37 ].
2.6 Uji Pengikatan Kolagen
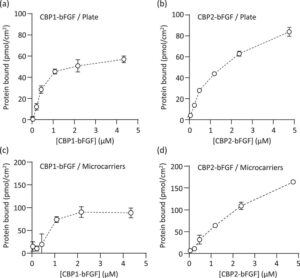
Larutan CBP1-bFGF dan CBP2-bFGF pada berbagai konsentrasi mulai dari 1 hingga 100 µg/mL ditambahkan ke setiap sumur mikroplat berlapis kolagen tipe I (Iwaki AGC Techno Glass, Shizuoka, Jepang; kepadatan permukaan kolagen: 0,19 µg/cm 2 ) dan diinkubasi pada suhu ruangan untuk mengikat protein kimerik ke permukaan berlapis kolagen. Setelah 1 jam inkubasi, permukaan dicuci tiga kali dengan garam penyangga fosfat (PBS) untuk menghilangkan protein kimerik yang teradsorpsi lemah. Jumlah protein kimerik yang terikat pada permukaan sumur mikro ditentukan menggunakan Micro BCA Protein Assay Kit dan serangkaian larutan BSA sebagai standar. Konstanta disosiasi ( K d ) dan kapasitas pengikatan ( B max ) ditentukan dari plot resiprokal isoterm pengikatan.
Lebih jauh lagi, mikropembawa polistirena berlapis kolagen tipe I (Corning, Corning, NY, AS; diameter: 125−212 µm, densitas: 1,026 ± 0,004, luas permukaan spesifik: 360 cm 2 /g, dan densitas permukaan kolagen: 0,13 µg/cm 2 ) (Gambar 1c ) disuspensikan dalam larutan protein kimerik pada berbagai konsentrasi mulai dari 1 hingga 100 µg/mL dan diinkubasi pada suhu ruangan dengan pengadukan lembut pada 70 rpm. Mikropembawa dengan total luas permukaan 4 cm 2 digunakan dalam satu batch. Setelah 1 jam inkubasi, mikropembawa dicuci tiga kali dengan PBS untuk menghilangkan protein kimerik yang teradsorpsi lemah. Jumlah protein yang terikat pada mikropembawa, K d dan B max, ditentukan seperti dijelaskan di atas.
2.7 Evaluasi Fungsi bFGF
hMSC yang diabadikan (UE6E7T-3) diperoleh dari Bank Sel JCRB (Osaka, Jepang) dan digunakan untuk uji in vitro aktivitas biologis domain bFGF yang terkandung dalam protein chimeric. Sel-sel tersebut telah dimodifikasi secara genetik untuk berkembang biak tanpa batas, tidak seperti MSC primer, yang memiliki rentang hidup terbatas dan karenanya tidak cocok untuk aplikasi klinis.
Dalam pengujian pertama, protein chimeric ditambahkan ke medium tempat hMSC dikultur. Pengujian dilakukan untuk mengevaluasi fungsi domain bFGF dalam larutan, terlepas dari kendala potensial yang terkait dengan pengikatan permukaan. hMSC yang diabadikan disemai ke setiap sumur pelat polistirena kultur jaringan 96 sumur (Falcon, Corning) pada kepadatan 3000 sel/cm 2 dan dikultur dalam medium Eagle yang dimodifikasi Dulbecco (DMEM; Fujifilm Wako Pure Chemical, Osaka, Jepang) yang mengandung 10% serum sapi janin (FBS; Sigma-Aldrich, St. Louis, MO, AS) dan larutan penisilin-streptomisin-glutamin 1% (Nacalai Tesque) pada suhu 37°C di bawah atmosfer 5% CO 2 . Setelah 24 jam kultur, CBP1-bFGF atau CBP2-bFGF ditambahkan ke medium pada konsentrasi 0, 0,1, 1, atau 10 ng/mL. Sel dikultur selama 72 jam tambahan, dan jumlah sel hidup ditentukan menggunakan Cell Counting Kit-8 (Dojindo, Kumamoto, Jepang).
Protein kimerik yang terikat pada permukaan berlapis kolagen diuji lebih lanjut. Larutan CBP1-bFGF dan CBP2-bFGF pada 0, 1, 4, 16, dan 64 µg/mL ditambahkan ke setiap sumur mikroplat berlapis kolagen (Iwaki AGC Techno) dan diinkubasi selama 1 jam pada suhu ruangan untuk mengikat protein kimerik ke permukaan plat. Setelah permukaan dicuci tiga kali dengan PBS, hMSC yang diabadikan disemai ke dalam sumur pada kepadatan 3000 sel/cm 2 dan dikultur dalam DMEM yang mengandung 10% FBS dan larutan penisilin-streptomisin-glutamin 1% pada suhu 37°C di bawah atmosfer 5% CO 2 . Setelah 72 jam kultur, jumlah sel hidup ditentukan menggunakan Cell Counting Kit-8.
2.8 Perluasan hMSC
Larutan (50 µg/mL) CBP1-bFGF dan CBP2-bFGF ditambahkan ke suspensi yang mengandung 0,367 g pembawa mikro berlapis kolagen (Gambar 1c ) (setara dengan total luas permukaan 3,3 cm2 / mL media dalam pengaturan sel awal) untuk mengikat protein kimerik ke pembawa mikro seperti yang dijelaskan sebelumnya. Pembawa mikro yang diikat protein kimerik ditambahkan ke labu pemutar 125 mL (Corning) yang berisi 40 mL DMEM dengan 10% FBS dan larutan penisilin-streptomisin-glutamin 1%. Sel punca mesenkimal yang berasal dari sumsum tulang manusia (hMSC; Lot No.: 22TL301024, passage 5, Lonza Group, Basel, Swiss) ditambahkan ke 462.000 sel (setara dengan kepadatan sel 3500 sel/cm 2 permukaan mikrokarrier) dan diinkubasi selama 4 jam pada suhu 37°C di bawah atmosfer 5% CO 2 tanpa pengadukan untuk memungkinkan sel menempel pada mikrokarrier. Setelah itu, suspensi diaduk perlahan dan terus-menerus pada kecepatan 30 rpm menggunakan pengaduk magnetik. Pada Hari ke-3, setengah dari medium disegarkan, dan mikrokarrier yang diikat protein chimeric, bersama dengan medium baru, ditambahkan untuk meningkatkan luas permukaan yang tersedia untuk perlekatan sel dan volume medium sebanyak tiga kali lipat. Metode ini dipilih karena menambahkan sejumlah mikrokarrier yang cukup di awal akan meningkatkan volume medium sejak awal dan akibatnya mengurangi kepadatan sel awal. Luas permukaan total akhir dari mikropembawa adalah 841,5 cm 2 pada saat panen sel. Diharapkan bahwa ruang tambahan akan memfasilitasi transfer sel antarpembawa [ 15 ]. Pada Hari ke-5, sepertiga dari media diisi ulang, dan mikropembawa yang diikat protein chimeric, bersama dengan media baru, ditambahkan lagi untuk meningkatkan luas permukaan yang tersedia untuk perlekatan sel dan volume media hingga tiga kali lipat. Labu pemutar diganti dengan labu pemutar 500 mL pada Hari ke-5, dan kultur sel dilanjutkan hingga Hari ke-7.
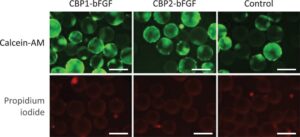
Untuk menentukan jumlah sel, 5 mL suspensi diambil sampelnya pada Hari ke-1, ke-3, ke-5, dan ke-7. Sel dipanen dengan tripsinisasi dan dipisahkan dari mikrokarrier menggunakan saringan nilon dengan pori-pori 70-µm (Falcon). Untuk membedakan sel hidup dari sel mati, sel diwarnai dengan kalsein-AM (Dojindo) untuk memberi label pada sel hidup dan dengan propidium iodida (Dojindo) untuk memberi label pada sel mati, lalu diamati menggunakan mikroskop fluoresensi (IX73, Olympus, Tokyo, Jepang). Jumlah sel hidup ditentukan menggunakan Countess 3 Automated Cell Counter (Thermo Fisher Scientific).
2.9 Sitometri Aliran
hMSC (Lonza) dikulturkan pada mikrokarrier yang diikat dengan protein chimeric selama 7 hari dan dipanen seperti yang dijelaskan sebelumnya. hMSC asli dan yang dikulturkan pada mikrokarrier berlapis kolagen murni tanpa protein chimeric yang diikat digunakan sebagai kontrol. Sel-sel tersebut difiksasi dengan BD Horizon Fixable Viability Stain 780 (BD Biosciences, Franklin Lakes, NJ, AS). Menurut pernyataan posisi oleh International Society for Cellular Therapy [ 38 ], sel-sel direaksikan dengan fluoresceinisothiocyanate (FITC)-, phycoerythrin (PE)-, atau brilliant violet 421 (BV421)- antibodi berlabel terhadap cluster of differentiation (CD) 14 (HCD14, berlabel PE, BioLegend, San Diego, CA, AS), CD34 (581, berlabel FITC, BD Biosciences, Franklin Lakes, NJ, AS), CD45 (HI30, berlabel PE, BioLegend), CD73 (AD2, berlabel BV421, BD Biosciences), CD90 (5E10, berlabel PE, BioLegend), dan CD105 (266, berlabel FITC, BD Biosciences) pada 4 ° C selama 20 menit. Analisis sitometri aliran dilakukan menggunakan BD LSRFortessa X-20 (BD Biosciences).
2.10 Diferensiasi Osteogenik
hMSC (Lonza) dikulturkan pada mikropembawa yang diikat protein chimeric selama 7 hari dan dipanen dengan tripsinisasi diikuti dengan penyaringan melalui saringan nilon dengan pori-pori 70 µm (Falcon) untuk memisahkan sel dari mikropembawa. Sel-sel disuspensikan dalam DMEM yang mengandung 10% FBS dan larutan penisilin-streptomisin-glutamin 1% (Nacalai Tesque) dan disemai ke dalam mikroplat polistirena kultur jaringan 24-sumur dengan kepadatan 8000 sel/cm 2 . Sel-sel dikulturkan dalam media yang sama pada suhu 37°C di bawah atmosfer 5% CO 2 . Setelah mencapai konfluensi 70%−80%, medium diganti dengan α-MEM (Sigma-Aldrich) yang mengandung 10% FBS, deksametason 100 nM, β-gliserofosfat 10 mM, asam askorbat 50 µg/mL, dan larutan penisilin-streptomisin-glutamin 1% dan dikultur selama 21 hari tambahan untuk menginduksi diferensiasi osteogenik [ 24 ], sementara medium disegarkan setiap 3−4 hari. Untuk memeriksa pengendapan kalsium, sel difiksasi dengan larutan paraformaldehida 4% dan diwarnai dengan larutan merah alizarin 2% (pH 4,2) selama 30 menit [ 39 ]. Setelah dicuci dengan air, sel yang diwarnai diamati di bawah mikroskop optik (IX73, Olympus).
2.11 Analisis Statistik
Hasil uji proliferasi sel pada pelat kultur jaringan polistiren dan pembawa mikro dianalisis secara statistik menggunakan uji perbandingan berganda Dunnett dan uji- t Student , masing-masing, untuk menilai apakah perbedaan antara data dari kelompok eksperimen dan kontrol signifikan secara statistik.
3 Hasil
3.1 Prediksi Struktur
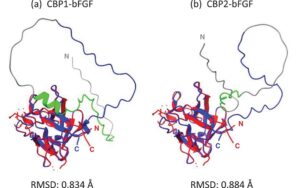
Gambar 2 menunjukkan hasil prediksi struktur berbasis komputer yang dilakukan untuk CBP1-bFGF (Gambar 2a ) dan CBP2-bFGF (Gambar 2b ). Struktur yang diprediksi (biru) disejajarkan dengan struktur kristal bFGF yang terdaftar dalam PDB (merah). Kedua struktur ini mirip satu sama lain untuk kedua domain bFGF di CBP1-bFGF dan CBP2-bFGF. RMSD yang ditentukan untuk atom-atom tulang punggung kurang dari 1 Å untuk kedua protein chimeric, menunjukkan bahwa perbedaan konformasi antara kedua daerah bFGF dapat diabaikan [40 ] .
3.2 Sintesis Protein Chimeric
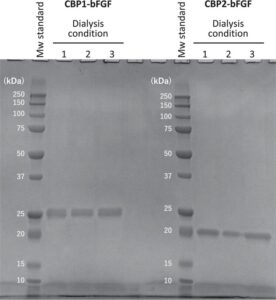
Protein chimeric, CBP1-bFGF dan CBP2-bFGF, diperoleh dari E. coli sebagai agregat yang tidak larut, dan didenaturasi dan dilarutkan dalam larutan buffer yang mengandung 8 M urea, diikuti dengan pemurnian dalam kondisi denaturasi. Selanjutnya, protein terdenaturasi ini didialisis untuk menghilangkan denaturan dan mengaktifkan pelipatan ulang mereka ke dalam struktur yang sesuai. Namun, agregasi dan presipitasi protein chimeric terjadi secara berkala selama dialisis bertahap, yang menghasilkan hasil produk akhir yang sangat rendah. Untuk mengatasi masalah ini, kondisi dialisis perlu dioptimalkan dengan hati-hati. Akibatnya, tiga kondisi (Kondisi 1-3; Tabel S1-S3 ), memberikan hasil protein chimeric yang relatif tinggi. Oleh karena itu, kami fokus pada ketiga kondisi ini. Seperti yang ditunjukkan pada Gambar 3 , CBP1-bFGF dan CBP2-bFGF dipisahkan menjadi pita tebal tunggal pada SDS-PAGE, terlepas dari kondisi dialisis. Hasil ini menunjukkan bahwa pemurnian dilakukan secara memadai, menghasilkan jumlah protein chimeric yang cukup. Berat molekul CBP1-bFGF dan CBP2-bFGF, yang dinilai dari mobilitas pita protein, sangat sesuai dengan berat molekul yang diperkirakan dari struktur primer protein chimeric ini (CBP1-bFGF: 23,1 kDa, CBP2-bFGF: 21,0 kDa). Hasil ini menunjukkan keberhasilan penyiapan kedua protein chimeric.
Spektroskopi 3.3 CD
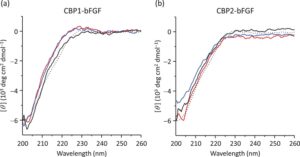
Hasil analisis spektroskopi CD ditunjukkan pada Gambar 4. Spektrum CD yang diprediksi untuk bFGF non-chimeric ditunjukkan oleh kurva putus-putus pada Gambar 4a,b (kedua kurva putus-putus identik). Spektrum ini menyerupai bFGF yang tersedia secara komersial [ 41 ], yang mewakili struktur acak dengan β-sheet tetapi sedikit α-heliks. Efek Cotton positif sekitar 230 nm menunjukkan adanya struktur β-turn. Pengamatan ini konsisten dengan struktur kristal bFGF asli. Dapat dianggap bahwa semua spektrum dari CBD1-bFGF (Gambar 4a ) dan CBP2-bFGF (Gambar 4b ) setelah dialisis dalam tiga kondisi berbeda serupa satu sama lain, dengan mempertimbangkan beberapa noise. Namun, efek Cotton pada sekitar 230 nm lebih menonjol dengan CBP1-bFGF daripada dengan CBP2-bFGF, terlepas dari kondisi dialisis. Pengamatan ini menunjukkan bahwa CBP1 memiliki efek yang lebih kecil pada pelipatan ulang domain bFGF penghubung daripada CBP2.
3.4 Fungsi Domain bFGF
Untuk menilai fungsi domain bFGF dalam CBP1-bFGF dan CBP2-bFGF yang diperoleh setelah dialisis terhadap larutan penyangga yang berbeda, protein chimeric ini ditambahkan ke medium tempat hMSC immortal dikultur. Gambar 5a,b menunjukkan jumlah sel setelah 72 jam kultur dengan adanya CBP1-bFGF (Gambar 5a ) dan CBP2-bFGF (Gambar 5b ), masing-masing. Data dinyatakan sebagai peningkatan lipat dalam jumlah sel dibandingkan dengan percobaan kontrol, di mana tidak ada protein chimeric yang ditambahkan. Kedua protein chimeric yang diperoleh setelah dialisis dalam Kondisi 1 dan 2 menghasilkan peningkatan jumlah sel, meskipun ketergantungan konsentrasi tidak jelas, sedangkan kedua protein yang diperoleh setelah dialisis dalam Kondisi 3 kurang efektif. Dalam keempat kasus, ketergantungan konsentrasi jumlah sel tidak jelas, mungkin karena periode kultur relatif singkat. Ketika bFGF asli yang tersedia secara komersial ditambahkan ke dalam medium, peningkatan jumlah sel menjadi sebagai berikut: [bFGF] = 5,8 × 10 −12 M: 2,4 ± 0,4 kali lipat, [bFGF] = 5,8 × 10 −11 M: 2,0 ± 0,4 kali lipat, dan [bFGF] = 5,8 × 10 −10 M: 2,4 ± 0,2 kali lipat. Dibandingkan dengan bFGF CBP1 dan bFGF CBP2, bFGF asli mendorong proliferasi hMSC yang sedikit lebih besar, kemungkinan karena aktivitas relatifnya yang lebih tinggi yang disebabkan oleh perbedaan galur inang E. coli dan prosedur pelipatan ulang protein.
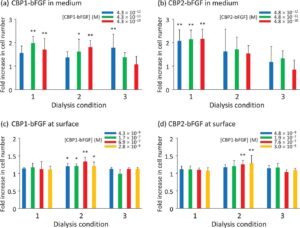
Protein chimeric selanjutnya diuji dalam keadaan terikat permukaan (Gambar 5c,d ). Mirip dengan percobaan yang dijelaskan di atas, data dinyatakan sebagai peningkatan lipat dalam jumlah sel dibandingkan dengan percobaan kontrol, di mana tidak ada protein chimeric yang diikat. Dalam kasus ini, kedua protein chimeric menghasilkan jumlah sel yang lebih besar setelah dialisis dalam Kondisi 2 daripada yang dalam kondisi lain. Mempertimbangkan hasil ini, CBP1-bFGF dan CBP2-bFGF yang didialisis dalam Kondisi 2 digunakan dalam percobaan berikutnya. Dalam uji fungsional protein chimeric yang diikat permukaan, kami tidak menyertakan percobaan menggunakan bFGF asli, karena penelitian kami sebelumnya [ 33 ] menunjukkan bahwa jumlah bFGF asli yang secara fisik diserap ke kolagen sangat rendah dibandingkan dengan CBP-bFGF yang terikat. Oleh karena itu, efek promotif apa pun dari bFGF asli yang diserap permukaan tidak diharapkan.
3.5 Mengikat Kolagen
Gambar 6 menunjukkan hasil uji pengikatan untuk CBP1-bFGF dan CBP2-bFGF yang diperoleh setelah dialisis dalam Kondisi 2 pada permukaan berlapis kolagen. Dalam setiap kasus (Gambar 6a–d ), protein chimeric terikat pada permukaan berlapis kolagen dengan cara yang bergantung pada konsentrasi, yang menunjukkan karakteristik adsorpsi tipe Langmuir. Hasil ini menunjukkan bahwa CBP1 dan CBP2 dalam protein chimeric memiliki kemampuan pengikatan kolagen. K d dan B max ditentukan dari plot resiprokal isoterm pengikatan. Karena penyimpangan yang relatif besar diamati di wilayah konsentrasi rendah, tiga titik data di wilayah konsentrasi tinggi digunakan. Seperti yang ditunjukkan dalam Tabel 1 , nilai K d relatif kecil, sekitar 10 −7 −10 −6 M, dalam keempat kasus. Nilai Bmax adalah 2,0 kali (permukaan polos) dan 3,4 kali (mikropembawa) lebih tinggi untuk CBP2 dibandingkan dengan CBP1.
| Protein kimerik | Permukaan polos berlapis kolagen | Mikro pembawa berlapis kolagen | ||
|---|---|---|---|---|
| K d (M) | B maks (pmol/ cm2 ) | K d (M) | B maks (pmol/ cm2 ) | |
| CBP1-bFGF | 3,8 × 10−7 | 61.0 | 3,6 × 10−7 | 100.0 |
| CBP2-bFGF | 2,0 × 10−6 | 119.0 | 5,2 × 10−6 | 344.8 |
3.6 Perluasan hMSC Menggunakan Mikropembawa yang Ditethering bFGF
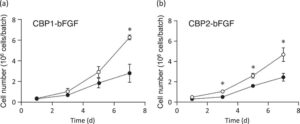
hMSC primer dikultur selama 7 hari pada mikropembawa yang diikat dengan CBP1-bFGF dan CBP2-bFGF, yang diperoleh setelah dialisis pada Kondisi 2. Pada Hari ke-3 dan ke-5, mikropembawa yang mengandung protein chimeric ini dan medium ditambahkan untuk meningkatkan luas permukaan yang tersedia untuk adhesi sel. Seperti yang ditunjukkan pada Gambar 7ab , sel-sel meningkat lebih cepat pada mikropembawa dengan protein chimeric yang diikat daripada pada yang tidak dimodifikasi. Selama 7 hari kultur, jumlah sel meningkat sekitar 13,6 kali dengan CBD1-bFGF dan 10,1 kali dengan CBP2-bFGF, akhirnya mencapai 6,3 × 10 6 dan 4,7 × 10 6 sel per kelompok dengan CBP1-bFGF dan CBP2-bFGF, masing-masing. Jumlah sel pada Hari ke-7 adalah 2,2 kali (CBP1-bFGF) dan 1,9 kali (CBP2-bFGF) lebih tinggi pada mikropembawa dengan protein chimeric daripada yang ada pada yang tidak dimodifikasi. Seperti yang ditunjukkan pada Gambar 8 , sebagian besar hMSC berkembang pada semua jenis mikropembawa yang diwarnai dengan calcein-AM, tetapi tidak dengan propidium iodida. Hasil ini menunjukkan bahwa viabilitas hMSC yang berkembang dipertahankan pada tingkat yang tinggi. Seperti dalam uji fungsional yang dijelaskan sebelumnya, kami tidak menyertakan eksperimen menggunakan bFGF asli, karena jumlah efektif bFGF asli yang secara fisik diserap ke mikropembawa berlapis kolagen tidak dapat diharapkan.
3.7 Sitometri Aliran
Analisis sitometri aliran dilakukan sebelum dan setelah membudidayakan hMSC pada mikropembawa protein murni dan kimerik. Hasilnya disajikan dalam Gambar S1 dan Tabel 2. Sebelum kultur mikropembawa, hMSC negatif untuk CD14, CD34, dan CD45, dan positif untuk CD73, CD90, dan CD105, meskipun persentase sel positif untuk CD105 relatif rendah. Terlepas dari jenis mikropembawa, persentase sel positif CD14, CD34, CD45, CD73, dan CD105 tidak berubah secara signifikan ketika sel dikultur pada mikropembawa ini. Dalam kasus CD90, sel yang dikultur pada mikropembawa dengan CBP1-bFGF dan CBP2-bFGF yang ditambatkan menunjukkan tingkat ekspresi yang berkurang sekitar 15%, sedangkan tidak ada perubahan signifikan yang diamati untuk CD90 pada sel yang dikultur menggunakan mikropembawa berlapis kolagen murni.
| Penanda permukaan | Sebelum kultur mikrokarrier | Setelah kultur pada mikropembawa berlapis kolagen murni | Setelah kultur pada mikropembawa dengan CBP1-bFGF | Setelah kultur pada mikropembawa dengan CBP2-bFGF |
|---|---|---|---|---|
| CD14 | 0,43 ± 0,26 | 0,20 ± 0,18 | 0,17 ± 0,15 | 0,13 ± 0,12 |
| CD34 | 0,15 ± 0,05 | 0,17 ± 0,12 | 0,16 ± 0,12 | 0,10 ± 0,10 |
| CD45 | 0,10 ± 0,06 | 0,03 ± 0,05 | 0,07 ± 0,06 | 0,07 ± 0,06 |
| Bahasa Indonesia: CD73 | 99,70 ± 0,22 | 99,45 ± 0,60 | 99,20 ± 0,63 | 97,83 ± 2,71 |
| CD90 | 94,75 ± 2,36 | 90,42 ± 3,07 | 73,87 ± 5,42 | 75,33 ± 3,19 |
| CD105 | 25,53 ± 16,31 | 34,33 ± 19,22 | 28,37 ± 7,46 | 21,70 ± 10,41 |
Persentase sel positif ditunjukkan untuk hMSC sebelum dan setelah kultur 7 hari pada mikropembawa berlapis kolagen murni atau mikropembawa berlapis kolagen dengan CBP1-bFGF atau CBP2-bFGF. Data dinyatakan sebagai rata-rata ± simpangan baku ( n = 3−6).
3.8 Kultur Diferensiasi Osteogenik
hMSC yang diekspansi pada mikropembawa dengan CBP1-bFGF dan CBP2-bFGF yang diikat dipanen dan dikultur dalam medium diferensiasi osteogenik untuk menilai potensi diferensiasinya. Eksperimen kontrol dilakukan dengan menggunakan hMSC yang dikultur pada mikropembawa berlapis kolagen tanpa protein chimeric yang diikat dan yang dikultur pada pelat kultur polistirena standar. Seperti yang ditunjukkan pada Gambar 9 , hMSC dari empat kondisi yang berbeda diwarnai secara intens dengan alizarin merah, yang menunjukkan bahwa sel-sel ini mempertahankan potensi diferensiasi osteogeniknya. Sebagai eksperimen kontrol, hMSC yang tidak berdiferensiasi terpapar alizarin merah tetapi tidak menunjukkan pewarnaan (Gambar S2 ).

4 Diskusi
Di antara berbagai bioreaktor, sistem berbasis mikrokarir telah dipelajari secara ekstensif untuk perluasan hMSC. Kami bertujuan untuk meningkatkan efisiensi perluasan hMSC, sambil mempertahankan keadaan sel yang tidak berdiferensiasi. Dalam penelitian ini, kami menerapkan teknik kami di mana substrat yang diikat bFGF digunakan untuk memperluas hMSC [ 24 ]. Untuk mengikat bFGF ke mikrokarir polistirena, bFGF direkayasa untuk membawa CBP sementara mikrokarir dilapisi dengan kolagen. Modifikasi ini memungkinkan pengikatan bFGF ke permukaan mikrokarir dalam kondisi ringan. Hasil kami menunjukkan bahwa hMSC dapat diperluas menggunakan mikrokarir yang diikat bFGF lebih efisien daripada mikrokarir berlapis kolagen murni.
Dalam penelitian ini, mikropembawa berlapis kolagen digunakan sebagai bahan dasar, karena kolagen menyediakan substrat yang sangat baik untuk adhesi hMSC, dan pada saat yang sama, pengalaman kami sebelumnya dengan persiapan protein chimeric yang terdiri dari polipeptida pengikat kolagen dan faktor pertumbuhan [ 39 , 42 ] dapat diterapkan dengan tepat untuk penambatan bFGF. Sebelumnya, kami melaporkan [ 24 ] bahwa 74,2% hMSC mengekspresikan reseptor faktor pertumbuhan fibroblast 1 (FGFR1), sebagaimana dinilai dengan flow cytometry. Proliferasi hMSC ditingkatkan dengan menambatkan bFGF ke permukaan substrat berbasis kaca dan sel-sel yang berproliferasi mempertahankan potensi diferensiasi multilineage mereka. Kesimpulan kami adalah bahwa bFGF yang diimobilisasi berfungsi untuk secara selektif menangkap MSC yang mengekspresikan FGFR1 melalui interaksi bFGF-FGFR1, sambil mengaktifkan FGFR1 untuk meningkatkan proliferasi MSC. Berdasarkan temuan ini, kami bermaksud menerapkan teknik ini pada permukaan pembawa mikro dalam penelitian ini. Karena salah satu isu paling kritis dalam pendekatan kami adalah desain molekuler protein chimeric, kami memberikan perhatian khusus pada aspek ini.
Berbagai sekuens peptida pengikat kolagen (CBP) dapat ditemukan dalam protein matriks ekstraseluler. Awalnya, kami mengadopsi domain A3 dari faktor von Willebrand (vWF-A3) [ 39 , 42 , 43 ] dan menyiapkan protein kimerik yang terdiri dari bFGF dan vWF-A3. Namun, protein ini memiliki kelarutan yang buruk, mungkin karena domain bFGF bermuatan positif dalam protein kimerik memiliki kecenderungan untuk berinteraksi secara ionik dengan domain vWF-A3 bermuatan negatif untuk membentuk agregat yang tidak larut. Titik isoelektrik (IEP) bFGF dan vWF-A3 yang diperkirakan dari komposisi asam amino mereka masing-masing adalah 9,58 dan 5,28. Untuk meningkatkan kelarutan kimera bFGF, kami mencari peptida pengikat kolagen yang lebih kecil yang kaya akan asam amino hidrofilik dengan muatan bersih negatif yang relatif kecil. Oleh karena itu, kami memutuskan untuk menggunakan CBP1 (IEP: 8.44) dari osteopontin manusia dan CBP2 (IEP: 5.55) dari decorin manusia. Seperti yang ditunjukkan dalam penelitian ini, kami berhasil memperoleh jumlah CBP1-bFGF dan CBP2-bFGF yang larut dalam jumlah yang cukup, mungkin sebagian karena kriteria desain di atas.
Hasil prediksi struktur (Gambar 2 ) menunjukkan bahwa CBP1 dan CBP2 tidak mempengaruhi struktur domain bFGF. Ini menunjukkan bahwa domain bFGF dalam CBP1-bFGF dan CBP2-bFGF memiliki potensi untuk melipat dengan benar menjadi struktur yang mirip dengan bFGF asli. Dengan demikian, disarankan bahwa penambahan CBP, linker, dan tag 6×His yang mengandung peptida N-terminal (Gambar 1a ) memiliki efek minor pada integritas struktural domain bFGF di kedua protein chimeric. Selain itu, analisis spektroskopi CD mengungkapkan bahwa domain bFGF dalam protein chimeric melipat ulang menjadi struktur yang menyerupai struktur kristal bFGF (Gambar 4 ). Namun, perbedaan yang diamati dalam spektrum sekitar 230 nm menunjukkan bahwa CBP1 menguntungkan untuk pelipatan ulang yang tepat dari domain bFGF penghubung. Perbedaan ini mungkin disebabkan, sebagian, oleh IEP negatif dari CBP2, yang dapat menyebabkan interaksi yang tidak menguntungkan dengan domain bFGF dengan IEP yang sangat positif; sedangkan CBP1, yang memiliki IEP positif, kurang rentan untuk berinteraksi dengan domain bFGF. Kemungkinan lain adalah bahwa CBP1 28-mer membentuk struktur β-turn, yang berkontribusi pada spektrum CD. Fakta bahwa pertumbuhan sel lebih ditingkatkan dengan CBP1-bFGF daripada dengan CBP2-bFGF pada mikropembawa (Gambar 7 ) mungkin disebabkan oleh perbedaan kecil dalam integritas struktural domain bFGF.
Fitur menarik lainnya adalah kemampuan pengikatan kolagen dari protein chimeric. Menurut prediksi struktur (Gambar 2 ), baik CBP1 maupun CBP2 terpapar ke lingkungan luar. Oleh karena itu, aksesibilitas peptida ini ke kolagen tidak diharapkan terhalang oleh domain bFGF. Seperti yang ditunjukkan pada Tabel 1 , K d CBP1 satu orde besaran lebih kecil daripada CBP2, dan B max CBP2 lebih besar daripada CBP1. Perbedaan ini memengaruhi kepadatan permukaannya pada substrat kolagen dan stabilitas; CBP2 mengikat kolagen pada kepadatan yang lebih tinggi daripada CBP1, sedangkan CBP1 tampaknya terikat lebih stabil daripada CBP2.
Ketika CBP1-bFGF dan CBP2-bFGF diikatkan ke permukaan berlapis kolagen (Gambar 5c,d ), proliferasi sel dipromosikan pada kedua permukaan pada tingkat yang sama. Ketergantungan konsentrasi tidak jelas ketika proliferasi sel dipelajari pada permukaan yang diikatkan bFGF (Gambar 5c,d ). Lebih lanjut diamati bahwa kedua protein chimeric yang diperoleh setelah dialisis dalam Kondisi netral 2 menghasilkan peningkatan proliferasi sel yang lebih besar daripada yang diperoleh dalam Kondisi 1 dan 3. Sangat mengejutkan bahwa kondisi dialisis netral menghasilkan chimera bFGF dengan aktivitas yang lebih tinggi, bertentangan dengan temuan Shakya [ 24 ] dan Singh dan Panda [ 44 ], yang melaporkan bahwa dialisat pada pH jauh dari IEP protein yang diinginkan, seperti Kondisi 1, menguntungkan untuk solubilisasi dan pemulihan bentuk bioaktif. Ketidakkonsistenan ini mungkin disebabkan oleh efek menghubungkan CBP dan peptida tambahan yang mengubah IEP seluruh protein. Berdasarkan hasil ini, kami menggunakan Kondisi 2 secara eksklusif dalam percobaan perluasan sel menggunakan pembawa mikro (Gambar 7 ).
Seperti yang ditunjukkan pada Gambar 7 , hMSC primer dapat diekspansi sekitar 13,6 kali dalam 7 hari pada mikropembawa dengan CBP1-bFGF dan 10,1 kali pada mikropembawa dengan CBP2-bFGF. Efisiensi ekspansi ini secara signifikan lebih tinggi daripada mikropembawa kontrol dengan protein chimeric yang tidak terikat, meskipun jumlah protein chimeric yang tersisa pada mikropembawa setelah kultur sel tidak ditentukan karena kesulitan teknis. Dengan demikian, kami menyimpulkan bahwa CBP1-bFGF lebih cocok untuk tujuan kami. Setelah 7 hari, sistem bioreaktor ditingkatkan skalanya dengan menambahkan mikropembawa yang terikat protein chimeric dan medium untuk meningkatkan luas permukaan yang tersedia untuk adhesi sel. Prosedur ini memungkinkan transfer sel dari satu mikropembawa ke mikropembawa lain sambil mencegah agregasi sel [ 14 , 45 ] dan pelepasan dari mikropembawa [ 15 ]. Meskipun hMSC primer diketahui mengurangi aktivitas proliferatifnya dengan pasase, kami akhirnya bisa mendapatkan 6,3 × 106 hMSC dari satu batch. Jumlah sel pada Hari ke-7 kira-kira dua kali lipat lebih tinggi pada mikrokarir dengan protein chimeric dibandingkan dengan yang tidak memiliki protein chimeric. Meskipun terbatas, peningkatan yang diamati memberikan manfaat tambahan pada peningkatan yang dicapai melalui kultur mikrokarir. Lebih jauh, kami mengamati bahwa sel yang diperluas sangat layak (Gambar 8 ) sambil mempertahankan potensi diferensiasi tulangnya (Gambar 9 dan Tabel 2 ). Alasan untuk ekspresi CD90 yang berkurang tidak jelas, tetapi Moraes et al. [ 46 ] melaporkan bahwa pengurangan ekspresi CD90 berfungsi untuk meningkatkan potensi diferensiasi osteogenik hMSC.
Dengan demikian, kami berhasil mencapai ekspansi hMSC sekitar 10 hingga 14 kali lipat dalam 7 hari menggunakan mikropembawa yang diikat bFGF. Laju ekspansi ini melampaui hasil yang dilaporkan sebelumnya menggunakan sistem mikropembawa, yang biasanya berkisar 6 hingga 10 kali lipat selama periode yang sama [ 47 , 48 ]. Dibandingkan dengan strategi ekspansi skala besar seperti yang dilaporkan oleh Zhang et al. [ 49 ], metode kami menunjukkan skalabilitas yang sebanding sambil mempertahankan waktu kultivasi yang lebih singkat. Yang penting, pendekatan kami mempertahankan karakteristik sel induk utama dan berpotensi cocok untuk pembuatan hMSC tingkat klinis. Temuan ini menyoroti potensi metode kami untuk produksi hMSC yang efisien dan cepat dalam pengobatan regeneratif dan aplikasi terapi sel.
5 Kesimpulan
Protein chimeric CBP1-bFGF dan CBP2-bFGF terikat pada permukaan berlapis kolagen dengan afinitas yang cukup tinggi, sementara domain bFGF dalam protein chimeric ini terlipat ulang menjadi bentuk aktif, khususnya dalam kondisi dialisis netral. Karena sifat-sifat ini, mikropembawa polistirena berlapis kolagen dengan CBP1-bFGF dan CBP2-bFGF yang terikat menyediakan substrat kultur yang meningkatkan proliferasi hMSC dibandingkan dengan mikropembawa berlapis kolagen murni tanpa protein chimeric. Perbandingan antara kedua protein chimeric menunjukkan bahwa proliferasi hMSC lebih meningkat pada mikropembawa dengan CBP1-bFGF dibandingkan pada mikropembawa dengan CBP2-bFGF. Dengan menggunakan mikropembawa dengan CBP1-bFGF, 6,3 × 106 hMSC dapat diperoleh per kelompok dalam 7 hari. Berdasarkan hasil ini, dapat disimpulkan bahwa pembawa mikro dengan bFGF pengikat kolagen, lebih disukai CBP1-bFGF, merupakan substrat yang berguna untuk membangun sistem bioreaktor untuk ekspansi hMSC.



Tinggalkan Balasan