ABSTRAK
Komagataella phaffii , juga dikenal sebagai Pichia pastoris , adalah inang yang kuat untuk produksi protein rekombinan, sebagian karena promotor P AOX1 yang sangat kuat dan terkontrol ketat . Sebagian besar bioproses K. phaffii untuk produksi protein rekombinan bergantung pada P AOX1 untuk mencapai kontrol dinamis dalam proses dua fase. Sel pertama-tama tumbuh dalam kondisi yang menekan P AOX1 (fase pertumbuhan), diikuti oleh ekspresi protein rekombinan yang diinduksi metanol (fase produksi). Dalam studi ini, kami mengusulkan pendekatan bebas metanol untuk kontrol metabolik dinamis pada K. phaffii menggunakan optogenetika, yang dapat membantu meningkatkan penyetelan input dan fleksibilitas dalam pengoptimalan dan kontrol proses. Faktor transkripsi responsif cahaya EL222 dari Erythrobacter litoralis digunakan untuk mengatur produksi protein dari promotor P C120 pada K. phaffii dengan cahaya biru. Kami menggunakan dua desain sistem untuk mengeksplorasi keuntungan dan kerugian dari penggabungan atau pemisahan integrasi EL222 dengan gen yang diinginkan. Kami menyelidiki hubungan antara jumlah salinan gen EL222 dan dosis cahaya untuk meningkatkan efisiensi produksi protein intraseluler dan protein yang disekresikan. Eksperimen dalam bioreaktor skala laboratorium menunjukkan kelayakan sistem optogenetik yang diuraikan sebagai alternatif potensial untuk bioproses konvensional yang dapat diinduksi metanol menggunakan K. phaffii .
1 Pendahuluan
Komagataella phaffii , juga dikenal sebagai Pichia pastoris , adalah inang yang kuat untuk produksi protein rekombinan di seluruh industri makanan, farmasi, dan enzim (Barone et al. 2023 ). Kekuatan utama ragi ini meliputi kemampuannya untuk tumbuh hingga kepadatan sel yang tinggi, secara efisien mengeluarkan protein rekombinan, tumbuh subur dalam kondisi kultur sederhana dibandingkan dengan sel mamalia, dan menjalankan modifikasi pascatranslasi eukariotik seperti ikatan disulfida dan glikosilasi. Pembentukan ikatan disulfida dalam retikulum endoplasma relatif lebih sederhana daripada di Escherichia coli , yang memerlukan penargetan protein ke periplasma atau memproduksinya sebagai badan inklusi dan kemudian melarutkan dan melipat ulang secara in vitro (De Marco 2009 ; Przylucka et al. 2017 ; Ma et al. 2020 ). Bahkan dibandingkan dengan ragi pekerja keras lainnya seperti Saccharomyces cerevisiae , modifikasi pascatranslasi K. phaffii untuk protein glikosilasi dapat sangat diinginkan, karena K. phaffii tidak mengalami hiperglikosilasi (Karbalaei et al. 2020 ). Selain itu, K. phaffii dilengkapi dengan promotor yang kuat dan terkontrol ketat seperti P AOX1 (Heistinger et al. 2020 ; Karbalaei et al. 2020 ), yang banyak digunakan untuk ekspresi protein di berbagai industri.
Sifat induksibel promoter P AOX1 memungkinkan bioproses K. phaffii beroperasi dalam dua fase temporal, menangani persaingan inheren antara pertumbuhan dan produksi. Selama fase pertumbuhan awal, sel diberi gliserol atau glukosa, yang memungkinkannya tumbuh dengan cepat sementara P AOX1 , yang mengendalikan protein rekombinan, ditekan. Ini menghindari beban metabolik dan potensi toksisitas protein rekombinan untuk mendorong pertumbuhan sel yang cepat. Setelah kepadatan sel yang diinginkan tercapai, fase produksi dimulai dengan mengganti sumber karbon ke metanol, yang sangat menginduksi P AOX1 untuk mengekspresikan protein rekombinan yang diinginkan. Meskipun efektif, penggunaan metanol, seperti penginduksi kimia ekspresi gen lainnya, menimbulkan tantangan karena keterbatasan penyetelan dan ireversibilitasnya. Setelah metanol ditambahkan ke media, tindakan masukan (korektif) untuk pengoptimalan dan kontrol proses dibatasi oleh kesulitan mentitrasi konsentrasi metanol secara dinamis dalam waktu nyata dan kurangnya respons promoter yang dapat disetel terhadap metanol. Lebih jauh lagi, metanol sering diproduksi dari sumber-sumber yang tidak berkelanjutan dan tidak terbarukan seperti batu bara, gas alam, atau minyak bumi, meskipun ada upaya-upaya yang sedang berlangsung untuk memproduksi metanol secara lebih berkelanjutan, misalnya, dari CO2 ( Sankaran 2023 ; Wiranarongkorn et al. 2023 ). Metanol juga menimbulkan bahaya mudah terbakar dan toksisitas, dan penggunaannya dalam proses K. phaffii memiliki kebutuhan oksigen dan evolusi panas yang tinggi, yang membatasi ukuran reaktor (Wang et al. 2018 ). Promotor P GAP yang sama kuatnya menawarkan alternatif bebas metanol untuk ekspresi protein tinggi dalam glukosa; namun, sifat konstitutifnya membuatnya suboptimal untuk protein toksik dan target-target lain yang mendapat manfaat dari kontrol dinamis dalam proses dua fase. Dengan demikian, agar bioproses K. phaffii mencapai potensi penuhnya untuk produksi protein rekombinan, pengembangan sistem induksibel bebas metanol yang kompetitif menjadi sangat menarik.
Beberapa penelitian dalam beberapa tahun terakhir telah difokuskan pada pengembangan sistem induksibel bebas metanol baru di K. phaffii . Upaya ini melibatkan perubahan regulasi P AOX1 atau induksi produksi dari promotor alternatif. Misalnya, ekspresi P AOX1 dalam gliserol telah mencapai hingga 77% dari induksi metanol tipe liar dengan melumpuhkan represor endogen (Δmig1Δmig2Δnrg1) sambil mengekspresikan aktivator Mit1 secara berlebihan (Wang et al. 2017 ). Penelitian lain juga melaporkan derepresi P AOX1 dalam gliserol dengan meningkatkan aktivator (Vogl et al. 2018 ; Dalvie et al. 2022 ) dan melumpuhkan kinase yang relevan (Shen et al. 2016 ). Dalam studi-studi ini, P AOX1 tetap ditekan dalam glukosa, menjadikan strain-strain ini berguna untuk proses-proses dinamis yang terdiri dari fase pertumbuhan yang diberi glukosa dan fase produksi yang diberi gliserol. Sementara pendekatan-pendekatan ini mempertahankan kontrol ketat P AOX1 , pendekatan-pendekatan ini jarang menyamai kekuatan induksi metanol dari P AOX1 . Studi-studi tambahan telah beralih ke ekspresi yang terderepresi dari promotor-promotor lain yang terlibat dalam pemanfaatan metanol seperti P DAS1 (Takagi et al. 2019 ), P PDF (Garrigós-Martínez et al. 2021 ), P FMD (Shirvani et al. 2019 ) dari K. phaffii serta P HpMOX dan P HpFMD dari Hansenula polymorpha (Vogl et al. 2020 ); Namun, perbandingan langsung promotor ini dengan P AOX1 belum dilaporkan (P DAS1 , P PDF , P FMD1 ) atau tidak cocok dengan kekuatan P AOX1 (P HpMOX , P HpFMD ). Alternatif lain dalam jalur penggunaan metanol adalah promotor P FLD1 , yang memiliki kekuatan yang sebanding dengan P AOX1 dan dapat diinduksi menggunakan metilamina sebagai sumber nitrogen (Cos et al. 2005 ; Resina et al. 2005 ; Wang et al. 2012 ; Zhan et al. 2014 ). Meskipun efektif, penginduksi ini lebih mahal daripada amonium sulfat yang biasanya digunakan, sehingga kurang optimal untuk peningkatan skala. Akhirnya, promotor yang diatur oleh rangsangan alternatif seperti bentuk rekayasa P ADH2 (etanol) (Ergün et al. 2019 ), P THI11 (tiamina) (Landes et al. 2016 ), P DH(kelaparan karbon) (Bernat-Camps et al. 2023 ), dan varian rekayasa P GTH1 (konsentrasi glukosa) (Prielhofer et al. 2018 ) telah dieksplorasi, tetapi dalam banyak kasus (dengan pengecualian P GTH1 ) mereka mengalami waktu fed-batch yang lama atau ekspresi yang lebih lemah daripada P AOX1 .
Dalam studi ini, kami mengusulkan pendekatan induksi optogenetik bebas metanol yang memodulasi ekspresi gen dengan cahaya, bukan dengan perubahan komposisi media. Sistem optogenetik menggunakan protein yang responsif terhadap cahaya, sering kali berupa faktor transkripsi, untuk memulai ekspresi gen sebagai respons terhadap panjang gelombang cahaya tertentu (Hoffman et al. 2022 ). Selain menghilangkan kebutuhan akan penginduksi kimia (terutama metanol dengan masalah keamanannya) dan perubahan media, cahaya dapat dengan mudah diaplikasikan dan dihilangkan pada intensitas dan jadwal waktu yang bervariasi, sehingga memberikan kemampuan penyetelan, pembalikan, dan modulasi waktu nyata. Optogenetika telah diaplikasikan dengan sangat sukses pada berbagai host mikroba untuk mengatur produksi kimia dan protein (Zhao et al. 2018 , 2019 , 2020 , 2021 ; Tandar et al. 2019 ; Senoo et al. 2019 ; Lalwani et al. 2021 ; Duplus-Bottin et al. 2021 ; Lalwani et al. 2021 ; Wu et al. 2021 ), dengan beberapa alat berdasarkan faktor transkripsi EL222 dari Erythrobacter litoralis . EL222 ada sebagai monomer tidak aktif dalam gelap, yang dimerisasi dalam cahaya biru (optimal 450 nm) untuk mengikat promotor P C120 dan mengaktifkan transkripsi (Motta-Mena et al. 2014 ). Dalam penelitian terkini, EL222 terbukti mampu menginduksi ekspresi gen pada K. phaffii dengan cahaya (Wang et al. 2022b ), meskipun produksi optogenetik protein intraseluler kira-kira setengah dari P AOX1 , dan tidak ada perbandingan yang dilaporkan antara cahaya dan induksi metanol untuk produksi protein yang disekresikan.
Di sini, kami menyelidiki interaksi antara jumlah salinan EL222 dan dosis cahaya dalam induksi protein (Gambar 1 ), yang menawarkan derajat kebebasan tambahan untuk desain proses, pengoptimalan, dan kontrol. Dua strategi desain strain diuraikan, berbeda dalam apakah integrasi EL222 digabungkan dengan gen yang diinginkan, yang menawarkan fleksibilitas yang bervariasi dalam memodulasi jumlah salinan elemen-elemen ini. Kami mengusulkan kerangka kerja pemodelan hibrida dengan parameter yang diprediksi oleh proses Gaussian yang dapat menghubungkan jumlah salinan EL222 dan dosis cahaya ( variabel yang dimanipulasi ) dengan perilaku dinamis proses. Kami mengeksplorasi penggunaan EL222 dalam K. phaffii untuk menghasilkan protein intraseluler dan protein yang disekresikan yang diatur secara optogenetik hingga tingkat bioreaktor skala lab, yang memberikan wawasan baru ke dalam pengoptimalan proses. Sebagai bukti konsep, kami membandingkan pendekatan optogenetik yang diusulkan dengan sistem yang diinduksi metanol yang lebih mapan di berbagai kasus dalam mengenali aplikasi serbaguna K. phaffii untuk produksi makanan, enzim, material, dan farmasi (Fahnestock dan Bedzyk 1997 ; Spiegel et al. 2015 ; Tyagi et al. 2016 ; Polez et al. 2016 ; Vallet-Courbin et al. 2017 ; Yang dan Zhang 2019 ; Reyes et al. 2021 ; Bolghari et al. 2022 ; Tian et al. 2024 ). Ini termasuk yEGFP untuk tujuan karakterisasi sistem awal, protein susu β-laktoglobulin (relevan dengan industri makanan) (Ragona et al. 1999 ), protein kaki kerang Mfp5 (bio-lem yang kuat) (H. Zhao dan Waite 2006 ), dan nanobodi SR18 terhadap SARS-CoV-2 (mewakili farmasi biologis potensial) (Chen et al. 2021 ). Meskipun sistem optogenetik secara umum mengungguli sistem berbasis metanol, dalam kondisi yang diuji, penting untuk dicatat bahwa tujuan dari studi ini bukanlah untuk menentukan secara meyakinkan apakah pendekatan optogenetik lebih unggul. Sebaliknya, ini tergantung pada kasus dan konteks spesifik mengenai berbagai faktor teknis, desain, keamanan, dan ekonomi. Sebaliknya, kami bertujuan untuk menunjukkan potensi cahaya sebagai derajat kebebasan yang fleksibel dan dapat diatur dalam produksi protein rekombinan oleh K. phaffii , dan untuk mendorong komunitas bioproses dan rekayasa metabolik untuk menambahkan metode yang diuraikan ke kotak peralatan mereka untuk desain dan pengoptimalan proses.
2 Bahan dan Metode
2.1 Konstruksi Plasmid
Semua plasmid dikloning ke dalam sel E. coli DH5α yang disiapkan menggunakan metode Inoue (Zhang et al. 2018 ). Kami menyusun konstruksi ini menggunakan perakitan Gibson (Gibson et al. 2009 ) atau ligasi restriksi dengan enzim yang dibeli dari NEB. Primer dibeli dari Integrated DNA Technologies, dan fragmen diamplifikasi PCR menggunakan premix PCR CloneAmp Hifi dari Takara Bio. Gen Mfp5, SR18, dan β-laktoglobulin dioptimalkan kodon untuk ekspresi dalam K. phaffii dan disintesis oleh Twist Bioscience, sementara sekuens lain, termasuk promotor P C120 dan EL222 (Informasi Pendukung S1: Sekuens S1 dan S2 ) diperoleh dari plasmid lab atau DNA genomik K. phaffii . Plasmid dan fragmen diekstraksi dan dimurnikan menggunakan Epoch DNA Miniprep dan kit Ekstraksi Gel Omega EZNA. Konstruksi akhir diurutkan menggunakan pengurutan Sanger oleh Genewiz atau pengurutan nanopore melalui Plasmidsaurus. Uraian terperinci semua plasmid yang dibangun dalam penelitian ini dapat ditemukan di Informasi Pendukung S1: Tabel S1 .
2.2 Strain Ragi dan Transformasinya
Semua galur ragi berasal dari NRRL Y-11430, yang diperoleh dari ATCC. Kami melakukan transformasi menggunakan metode elektroporasi terkondensasi standar (Lin-Cereghino et al. 2005 ), dan galur yang dihasilkan dikatalogkan dalam Informasi Pendukung S1: Tabel S2 . Transforman dipilih dengan zeocin atau G418 pada konsentrasi berkisar antara 100 hingga 1000 μg/mL dan diinkubasi selama 2–3 hari pada suhu 30°C hingga terbentuk koloni. Semua pertumbuhan eksperimental dilakukan pada suhu 30°C.
2.3 Kuantifikasi Jumlah Salinan dengan qPCR
Jumlah salinan protein fluoresensi hijau yang ditingkatkan oleh ragi (yEGFP) (Informasi Pendukung S1: Gambar S1 ) dan EL222 (Informasi Pendukung S1: Gambar S2 dan S3 ) diukur dengan qPCR seperti yang dijelaskan sebelumnya oleh Abad (Abad et al. 2010 ). Kami mengekstrak DNA genom dari ragi menggunakan fenol-kloroform (Collart dan Oliviero 1993 ) dan memurnikannya lebih lanjut untuk menghilangkan RNA dengan RNase A (1 μL stok 20 mg/mL per sampel) (Yoshinaga dan Dalin 2016 ). Reaksi qPCR dijalankan menggunakan SYBR Green qPCR Master Mix (Thermo Fisher) dalam Sistem PCR Real-Time ViiA 7 (Thermo Fisher) dengan adaptor 96 sumur. Nilai ambang dipilih oleh perangkat lunak QuantStudio (Thermo Fisher), dan kami menggunakan ARG4 sebagai gen referensi housekeeping untuk mengontrol setiap variasi dalam konsentrasi DNA antara sampel. Primer untuk amplifikasi yEGFP, EL222, dan ARG4 dibeli dari Integrated DNA Technologies dan dapat ditemukan di Informasi Pendukung S1: Tabel S3 . Galur yang mengandung salinan tunggal yEGFP dan EL222 (ySMH3-100-3) diidentifikasi seperti yang dijelaskan oleh Abad (Abad et al. 2010 ) menggunakan dua PCR koloni untuk memeriksa salinan terintegrasi tandem dan digunakan sebagai kontrol dari mana kurva kalibrasi diproduksi. Untuk mengidentifikasi galur dengan jumlah salinan yang bervariasi, galur dipilih dari pelat yang berkisar dalam konsentrasi zeocin atau G418 dari 100 hingga 1000 μg/mL. Konsentrasi antibiotik ditunjukkan oleh angka kedua pada strain ySMH3 dan ySMH5 (misalnya, strain ySMH3-100-3 dipilih pada pelat zeocin 100 μg/mL).
2.4 Pencahayaan dan Pengukuran Intensitas Cahaya
Untuk semua percobaan mikroplat, cahaya biru (465 nm) diaplikasikan menggunakan panel LED (HQRP New Square 12″ Grow Light Blue LED 14 W) yang ditempatkan di atas plat kultur. Jarak disesuaikan untuk setiap panel (antara 40 dan 70 cm) untuk mencapai intensitas cahaya yang diinginkan untuk setiap percobaan (antara 5 dan 70
aku
), yang diukur menggunakan Quantum meter (Apogee Instruments, Model MQ-510) dan setara dengan intensitas antara ~1,3 dan ~18,2 W/m 2 (menurut E photon = hc/λ, dan panjang gelombang panel terukur ~462 nm). Kultur yang tumbuh dalam gelap dilindungi dari cahaya menggunakan aluminium foil.
Karena tutup dan klem penahan untuk labu Erlenmeyer akan menghalangi cahaya dan mempersulit penerapan intensitas yang konsisten, cahaya diterapkan menggunakan pendekatan yang berbeda untuk eksperimen labu. Alih-alih menerangi dari atas, sebuah peralatan dibangun untuk memungkinkan penerangan oleh panel LED dari bawah (Informasi Pendukung S1: Gambar S4 ). Untuk pengaturan ini, kami mengamankan panel cahaya ke pengocok dengan empat braket, memfasilitasi pertukaran panel untuk mencapai intensitas cahaya yang berbeda. Panel ditutupi dengan lembaran akrilik buram 12″ × 12″ × ⅛” (AZM Displays APSheet1/8Milky) dengan bantalan perekat transparan yang dapat digunakan kembali di atasnya (Chemglass CLS-4010). Seperti pada eksperimen mikroplat, intensitas diukur pada 465 nm dengan meter Kuantum (Apogee Instruments, Model MQ-510).
2.5 Produksi Intraseluler yEGFP Menggunakan Sistem Optogenetik Terkopel dan P AOX1
Percobaan yang membandingkan produksi yEGFP intraseluler oleh sistem optogenetik yang digabungkan dan P AOX1 dilakukan pada galur salinan rendah dan tinggi (Gambar 2 , Informasi Pendukung S1: Gambar S5 dan S6 ). Galur optogenetik diperoleh dengan mentransformasi galur tipe liar NRRL Y-11430 dengan plasmid linierisasi (menggunakan PmeI) yang mengandung P ADH2 -EL222 dan P C120 -yEGFP (SMH131). Galur yang diinduksi metanol dibuat dengan mentransformasi NRRL Y-11430 dengan konstruksi linierisasi serupa yang mengandung P AOX1 -yEGFP (SMH5). Transforman ditanam pada zeocin 100 dan 1000 μg/mL untuk memilih galur salinan rendah dan tinggi. Dua belas koloni acak dari masing-masing strain yang diinduksi optogenetik dan metanol dianalisis dengan qPCR, dan strain dengan salinan tunggal (ySMH3-100-3 dan ySMH5-100-5) dan sekitar 8 salinan (ySMH3-1000-3 dan ySMH5-1000-3) dipilih untuk analisis lebih lanjut (Informasi Pendukung S1: Gambar S1 ).
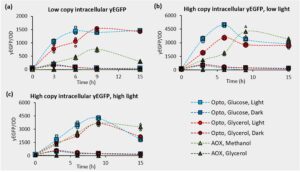
Untuk membandingkan ekspresi antar-strain, pertama-tama kami menginokulasikannya ke dalam 1 mL medium minimal yang dibuffer dalam pelat 24-sumur (USA Scientific CC7672-7524) dan menumbuhkannya dalam gelap selama 20 jam pada suhu 30°C dengan pengocokan pada kecepatan 200 rpm (New Brunswick Innova 2300 Platform Shaker). Pertumbuhan ini dilakukan dalam medium gliserol minimal berpenyangga BMG1 untuk galur ySMH5 yang digerakkan oleh P AOX1 , dan dalam BMG1 dan medium dekstrosa minimal berpenyangga BMD1 untuk galur optogenetik ySMH3 (BMG1: 100 mM kalium fosfat, pH 6; 1,34% basa nitrogen ragi; 0,4 μg/mL biotin; 1% gliserol. BMD1: 100 mM kalium fosfat, pH 6; 1,34% basa nitrogen ragi; 0,4 μg/mL biotin; 1% glukosa). Setelah pertumbuhan semalaman, lempeng disentrifugasi pada kecepatan 234 g (Sorvall Legend XTR Centrifuge) selama 5 menit dan kultur disuspensikan kembali dalam medium minimal yang diberi penyangga tanpa sumber karbon untuk menghilangkan sisa glukosa atau gliserol (BMX: 100 mM kalium fosfat, pH 6; 1,34% basa nitrogen ragi; 0,4 μg/mL biotin). Kami mengukur OD 600 kultur ini dalam pembaca plat TECAN (Infinite F Plex) dan mengencerkan sel ke dalam tiga plat 48-sumur yang identik hingga OD 600 sebesar 1. Sel-sel ySMH3 optogenetik diencerkan ke dalam media BMD1 dan BMG1 (tergantung pada sumber karbon tempat mereka tumbuh) untuk menguji dalam 1% glukosa dan gliserol, sedangkan sel -sel ySMH5 yang digerakkan P AOX1 diencerkan ke dalam media BMM1 atau BMG1 metanol minimal yang dibuffer untuk menguji ekspresi protein dalam 1% metanol dan gliserol (BMM1: 100 mM kalium fosfat, pH 6; 1,34% basa nitrogen ragi; 0,4 μg/mL biotin; 1% v/v metanol). Plat diinkubasi pada suhu 30°C dengan pengocokan 200 rpm (New Brunswick Innova 2300 Platform Shaker), dan setiap plat terkena intensitas cahaya yang berbeda (gelap, 5
aku
, dan 70
aku
). Semua pengukuran OD 600 dan yEGFP diperoleh menggunakan pembaca pelat TECAN. Panjang gelombang eksitasi dan emisi yEGFP 485 dan 535 nm digunakan untuk data fluoresensi, sedangkan kepadatan sel diukur pada panjang gelombang 600 nm. Pengukuran dilakukan pada waktu yang ditunjukkan (Gambar 2 , Informasi Pendukung S1: Gambar S5 dan S6 ), dan pelat segera dikembalikan ke 30°C dengan pengocokan 200 rpm setelah setiap pengukuran. Untuk menghindari aktivasi sistem optogenetik yang tidak diinginkan di pelat gelap, pelat ini diangkut dalam aluminium foil untuk setiap titik waktu guna meminimalkan paparan cahaya sekitar. Tidak seperti percobaan berikutnya dalam labu goyang atau bioreaktor, pengujian ini dilakukan sebagai percobaan batch tanpa penambahan sumber karbon lebih lanjut setelah waktu induksi.
Untuk percobaan berdenyut (Informasi Pendukung S1: Gambar S7 ), ySMH3-100-3 diinokulasi ke dalam medium BMD1 dan BMG1 dalam pelat 24 sumur dan tumbuh dalam gelap selama 20 jam pada suhu 30°C dengan pengocokan pada 200 rpm. Sel kemudian disentrifugasi pada 234 g seperti disebutkan di atas selama 5 menit dan disuspensikan kembali dalam medium BMD1 dan BMG1 segar pada OD 600 sebesar 0,1 dalam empat pelat 24 sumur yang identik. Setiap pelat mengalami jadwal cahaya yang berbeda (gelap, 10 detik AKTIF/100 detik MATI, 1 detik AKTIF/100 detik MATI dan cahaya konstan) dengan semua panel menyala pada intensitas ~70
Jadwal cahaya berdenyut diatur menggunakan Sakelar Pengatur Waktu Digital Plug-in Multifungsi Infinite Loop Programmable Nearpow (Nomor model CECOMINOD036912). OD 600 dan yEGFP diukur setelah 8 jam dalam setiap kondisi cahaya pada suhu 30°C dan pengocokan 200 rpm. Pengukuran untuk percobaan ini diperoleh dengan pembaca pelat TECAN Infinite M200PRO.
Saat mengonversi data mentah dari percobaan ini menjadi nilai yEGFP/OD 600 atau nilai fluoresensi total, kami memperhitungkan autofluoresensi media dan sel serta efek pemutihan cahaya. Untuk nilai yEGFP/OD 600 , kami menggunakan rumus di bawah ini yang sebelumnya telah dilaporkan untuk mengukur fluoresensi dengan pembaca plat yang serupa (Zhao et al. 2021 ) (Persamaan 1 ). Galur NRRL Y-11430 tipe liar digunakan sebagai kontrol negatif “tanpa yEGFP” dan mengalami kondisi yang sama (disingkat sebagai “kondisi”) seperti galur lainnya.
![]()
Untuk mengukur total produksi yEGFP, autofluoresensi kontrol NRRL Y-11430 dikurangi dari nilai terukur strain yang diukur, seperti pada Persamaan ( 2 ).
![]()
2.6 Pengujian Pengaruh Jumlah Salinan EL222 terhadap Pertumbuhan dan Produksi
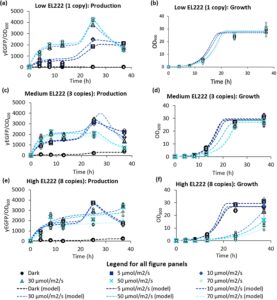
Untuk memeriksa bagaimana jumlah salinan EL222 memengaruhi perilaku galur optogenetik (Gambar 3 , Informasi Pendukung S1: Gambar S8 dan S9 ), pertama-tama kami membuat galur induk, ySMH115-14, yang hanya mengandung bagian P C120 -yEGFP dari sistem optogenetik (SMH6). Untuk meniru galur dengan salinan tinggi yang umumnya digunakan dalam bioproses K. phaffii , kami memilih galur ini dari pelat yang mengandung 1000 μg/mL zeocin. Kami kemudian mentransformasi galur ini dengan plasmid yang mengandung P ADH2 -EL222 dan penanda G418 (SMH139), dan menanamkannya pada 100, 500, dan 1000 μg/mL G418. Beberapa koloni dipilih dari lempeng ini dan dianalisis dengan qPCR untuk mengidentifikasi sekumpulan galur dengan rentang jumlah salinan EL222 yang luas (ySMH193) (Informasi Pendukung S1: Gambar S2 ). Analisis ini menghasilkan pemilihan ySMH193-11, 6, dan 9 yang masing-masing mengandung 1, 3, dan 8 salinan EL222.

2.7 Pemodelan Produksi yEGFP yang Didukung Proses Gaussian
Untuk memodelkan dinamika produksi protein di bawah berbagai jumlah salinan EL222 dan intensitas cahaya, kami mempertimbangkan empat persamaan diferensial, seperti yang dinyatakan di bawah ini. Sebagai bukti konsep, kami berfokus pada produksi yEGFP, meskipun model tersebut dapat diadaptasi ke jenis protein rekombinan lainnya. Modelnya adalah sebagai berikut:



2.8 Mengekspresikan Bersama ROS Scavengers Dengan EL222
Kami menguji ko-ekspresi EL222 dengan total tiga pemulung ROS asli K. phaffii ( katalase CTA1 , superoksida dismutase SOD1 , dan protein membran peroksisomal PMP20 ). Urutan untuk ketiga gen tersebut diidentifikasi dalam penelitian sebelumnya (Yano et al. 2009 ; Lin et al. 2021 ) dan diamplifikasi langsung dari genom K. phaffii saat kloning. Dalam kasus CTA1 , lima asam amino terakhir dipangkas untuk menghilangkan tag penargetan peroksisomal dan memungkinkan ekspresi sitosolik.
Untuk membuat galur yang mengekspresikan enzim pemulung ini bersama EL222, pertama-tama kami menyingkirkan HIS4 dari galur NRRL Y-11430 tipe liar menggunakan CRISPR-Cas9 (SMH60) untuk membuka penanda seleksi ketiga, di luar resistensi zeocin dan G418 (ySMH68). Galur ini kemudian ditransformasi dengan kaset yang mengekspresikan yEGFP di bawah P AOX1 (SMH158, dilinearisasi dengan PmeI untuk menargetkan lokus AOX1) untuk membentuk ySMH196 (disemai pada zeocin 100 μg/mL), dan selanjutnya ditransformasi dengan konstruksi yang mengandung P ADH2 -EL222 (SMH139, dilinearisasi dengan ApaI untuk menargetkan lokus ADH2 ) untuk membentuk ySMH197 (disemai pada 1000 μg/mL G418). Galur ySMH197 ini berfungsi sebagai galur induk untuk integrasi pemulung ROS, yang menargetkan lokus HIS4 dengan melinearisasi SMH219, SMH229, dan SMH230 dengan KasI dan menghasilkan ySMH207 ( CTA1 ), ySMH209 ( SOD1 ), dan ySMH210 ( PMP20 ), masing-masing. Pemulung ROS ini diekspresikan secara konstitutif dari promotor P GAP .
Untuk menguji apakah co-ekspresi pemulung dapat mengimbangi efek fototoksik EL222, kami menginokulasi empat koloni ySMH207, ySMH209, dan ySMH210 ke dalam medium BMD1 500 μL yang dilengkapi dengan 0,3 mM l -histidin dalam pelat 48-sumur, bersama dengan ySMH196 (tanpa kontrol EL222) dan ySMH197 (tanpa kontrol pemulung). Karena galur kontrol ySMH196 dan ySMH197 bersifat auksotrofik untuk l -histidin, media yang dilengkapi ini digunakan untuk semua sumur untuk menjaga kondisi tetap konsisten di antara galur (meskipun ySMH207, ySMH209, dan ySMH210 bersifat prototrofik untuk l -histidin). Pelat ini ditumbuhkan semalaman selama 20 jam dalam gelap pada suhu 30°C dengan pengocokan pada 200 rpm. Keesokan harinya, plat disentrifugasi pada 234 g selama 5 menit dan disuspensikan kembali dalam medium BMD1 segar yang ditambah dengan 0,3 mM l -histidin. Strain diencerkan dalam dua plat 48-well yang identik hingga OD 600 sebesar 0,1 dalam BMD1 yang ditambah dengan 0,3 mM l -histidin sebagaimana diukur oleh pembaca plat TECAN (Infinite F Plex). Seperti sebelumnya, l -histidin ditambahkan ke semua kultur untuk menjaga kondisi media tetap konsisten antara strain yang mengekspresikan scavenger prototrofik dan strain kontrol auksotrofik. Akhirnya, kedua plat diinkubasi pada suhu 30°C dengan pengocokan 200 rpm dalam kondisi cahaya masing-masing (gelap atau 70
aku
cahaya). Pelat dilepas sebentar pada titik waktu yang ditunjukkan (Informasi Pendukung S1: Gambar S10 ) untuk mengukur OD 600 , dengan sampel diencerkan dalam pelat 48-sumur terpisah untuk titik waktu di mana OD 600 berada di atas 8 dan melampaui rentang linier instrumen. Data ditunjukkan dari satu koloni representatif dari empat koloni yang diuji.
2.9 Produksi Intraseluler Mfp5
Mfp5 dari Mytilus californianus dioptimalkan kodon untuk ekspresi dalam K. phaffii (Twist Bioscience) menggunakan urutan asam amino yang dilaporkan sebelumnya (Zhao dan Waite 2006 ). Kami membuat konstruksi yang mengekspresikan gen dari P AOX1 dan P C120 (SMH207 dan SMH244). Untuk ekspresi dari P AOX1 , SMH207 ditransformasi ke dalam sel NRRL Y-11430 untuk menghasilkan ySMH186, yang ditanam pada pelat agar zeocin 500 dan 1000 μg/mL. Untuk produksi optogenetik, pertama-tama kami membuat galur yang mengandung satu salinan P ADH2 -EL222 dengan mentransformasi NRRL Y-11430 dengan plasmid SMH139 yang dilinearisasi (ySMH203-16) (Informasi Pendukung S1: Gambar S3 ). Untuk menggabungkan kaset ekspresi Mfp5, kami mentransformasi galur ini dengan SMH244, menghasilkan ySMH238. Transformasi ini ditaburkan pada pelat agar zeocin 500 dan 1000 μg/mL.
Untuk menyaring transforman untuk produsen kuat, 14 koloni dari setiap galur diinokulasi ke dalam media minimal (BMG1 untuk galur yang digerakkan oleh ySMH186 P AOX1 dan BMD1 untuk galur optogenetik ySMH238) dalam pelat 24 sumur dan tumbuh selama 24 jam pada suhu 30°C dengan pengocokan 200 rpm. Pertumbuhan ini dilakukan dalam gelap untuk galur optogenetik guna menghindari induksi prematur. Selanjutnya, kultur disentrifugasi selama 5 menit pada 234 g dan disuspensikan kembali dalam media minimal baru (BMM1 untuk ySMH186 dan BMD1 untuk ySMH238). Kepadatan sel diukur menggunakan pembaca pelat TECAN (Infinite F Plex) dan disamakan dengan OD 600 sebesar 10 dalam media masing-masing dalam pelat 24 sumur. Plat ini diinkubasi selama 24 jam pada suhu 30°C dengan pengocokan pada kecepatan 200 rpm, dengan plat optogenetik terkena cahaya biru pada intensitas 50
aku
. Setelah periode ini, sel-sel dipasok kembali dengan sumber karbon masing-masing hingga konsentrasi akhir 1% (menggunakan 100% metanol untuk ySMH186 atau 40% glukosa untuk ySMH238) dan dikembalikan ke 30°C untuk periode produksi tambahan selama 24 jam. Kami kemudian melisiskan kultur pada massa sel yang sama menggunakan protokol lisis asam trikloroasetat (TCA) standar. Untuk protokol lisis TCA, kami memanen setara dengan 5 mL sel pada OD 600 sebesar 2 untuk mempertahankan jumlah sel yang sama di setiap sampel. Kami mensentrifugasi sel-sel selama 2,5 menit pada 2500 rpm dalam mikrosentrifus dan membuang supernatan. Kami menangguhkan kembali pelet dalam 1 mL air dan memindahkannya ke tabung 1,5 mL. Kami mepeletkan sel-sel lagi dengan metode sentrifugasi yang sama dan membuang airnya. Selanjutnya, kami mensuspensikan kembali sel-sel dalam 1 mL TCA 5% dan menginkubasinya di atas es selama minimal 10 menit. Kemudian, kami mensentrifugasi sel-sel selama 2 menit pada kecepatan maksimum dalam mikrosentrifugasi dan membuang supernatan. Kami mencuci pelet sekali dengan menambahkan 500 µL Tris 1 M (tanpa pH yang disesuaikan) dan membalikkan tabung. Sekali lagi, kami mensentrifugasi sel-sel selama 2 menit pada kecepatan maksimum sebelum membuang supernatan. Kami kemudian mensuspensikan kembali pelet dalam 113 µL air dengan sonikasi pada daya rendah, yang hanya memerlukan waktu beberapa detik. Terakhir, kami menambahkan 20 µL DTT 1 M dan 67 µL buffer pemuatan SDS 3X untuk mendapatkan ~200 µL sampel. Sampel kemudian direbus dalam bak pasir (pada suhu 100°C) selama 5 menit dan kemudian disentrifugasi dalam mikrosentrifugasi selama 3 menit pada kecepatan 12.000 rpm. Terakhir, 5–20 mL sampel dimasukkan ke dalam gel SDS PAGE. Selanjutnya, kami melakukan SDS-PAGE diikuti dengan western blot (lihat rincian di bawah) untuk mengidentifikasi koloni dengan kinerja terbaik dari setiap galur (Informasi Pendukung S1: Gambar S11 ).
Setelah mengidentifikasi galur yang paling produktif (ySMH186-9 dan ySMH238-9), produksi dari galur ini dibandingkan secara lebih ketat dalam rangkap tiga dalam labu Erlenmeyer. Setiap galur diinokulasi ke dalam 1 mL media minimal (BMG1 untuk ySMH186-9 dan BMD1 untuk ySMH238-9) dalam pelat 24 sumur dan ditumbuhkan selama 20 jam pada suhu 30°C dengan pengocokan 200 rpm. Setelah pertumbuhan ini, 400 μL dari setiap kultur diinokulasi ke dalam 40 mL media segar (BMG1 untuk ySMH186-9 dan BMG1 dan BMD1 untuk ySMH238-9) dalam labu Erlenmeyer 500 mL untuk pertumbuhan semalam kedua. Seperti sebelumnya, kami menumbuhkan sel optogenetik dalam gelap. Kami kemudian mensentrifugasi sel pada 234 g selama 5 menit dan disuspensikan kembali dalam 40 mL media minimal segar (BMM1 untuk ySMH186-9 dan BMG1 dan BMD1 untuk ySMH238-9). Kepadatan sel diukur menggunakan spektrofotometer Eppendorf (Eppendorf BioSpectrometer basic) dan μCuvette (Eppendorf μCuvette G1.0). Untuk memastikan kepadatan sel yang diukur berada dalam rentang linier instrumen (OD 600 < 10), 0,25 mL sampel dari setiap kultur pertama-tama diencerkan 1:5 dalam media segar sebelum pengukuran. Kemudian, media segar tambahan ditambahkan ke setiap kultur sehingga semuanya berada pada OD 600 sebesar 10 (BMM1 untuk ySMH186-9 dan BMG1 dan BMD1 untuk ySMH238-9). Langkah ini memastikan bahwa kepadatan sel pada saat induksi akan sama untuk semua kondisi. Setelah menyamakan kepadatan sel dengan OD 600 sebesar 10, 12,5 mL dari setiap kultur dipindahkan ke tiga labu Erlenmeyer 125 mL yang identik (total sembilan labu), yang kemudian diinkubasi pada suhu 30°C dengan pengocokan pada kecepatan 200 rpm. Labu dengan galur optogenetik disinari dengan intensitas cahaya 50
aku
menggunakan platform iluminator labu (Informasi Pendukung S1: Gambar S4 ), sementara strain P AOX1 -didorong diekspos ke cahaya sekitar. Setelah 24 jam inkubasi, sel-sel tersebut diisi ulang dengan sumber karbonnya masing-masing hingga konsentrasi 1% (menggunakan 100% metanol, 40% glukosa, atau 60% gliserol) dan dikembalikan ke 30°C untuk periode tambahan 24 jam. Kami melisiskan massa sel yang sama dari setiap kultur menggunakan protokol TCA yang disebutkan sebelumnya dan mengukur produksi menggunakan western blot dan analisis ImageJ (lihat detail di bawah) (Gambar 4 ). Untuk mengonfirmasi pemuatan sampel yang sama dan menghindari bias dalam hasil, kami mewarnai membran menggunakan Coomassie blue R-250 seperti yang dijelaskan sebelumnya (Goldman et al. 2016 ) (Informasi Pendukung S1: Gambar S12 ).
2.10 Kuantifikasi Protein Melalui SDS-PAGE dan Analisis Western Blot
Produksi Mfp5 dan tiga target yang disekresikan dianalisis melalui SDS-PAGE diikuti oleh western blot. Untuk strain produksi intraseluler, sampel dilisiskan menggunakan protokol TCA yang disebutkan sebelumnya diikuti dengan penangguhan ulang dalam buffer sampel SDS (Gallagher dan Wiley 2008 ). Untuk strain yang disekresikan, kultur akhir disentrifugasi selama 5 menit pada 234 g dan supernatan dicampur dengan buffer sampel (Gallagher dan Wiley 2008 ). Kami merebus sampel selama 5 menit pada 100 °C menggunakan blok panas (VWR), dimuat ke gel SDS-PAGE 12%, dan dipisahkan. Kami menggunakan volume pemuatan 15 μL untuk semua gel SDS-PAGE. Untuk Informasi Pendukung S1: Gambar S23c,d , kami menggunakan gel Bio-Rad 12% Mini-PROTEAN.
Setelah diselesaikan, kami menganalisis dengan western blot menggunakan protokol yang telah ditetapkan. Protein dipindahkan ke membran PVDF menggunakan Trans-Blot Turbo Transfer System (Bio-Rad). Semua protein yang dianalisis dengan western blot mengandung tag His C-terminal yang diuji menggunakan THE His Tag Antibody [HRP], mAb (Genscript) dengan pengenceran 1:10.000. Blot diungkapkan menggunakan substrat Clarity ECL (Bio-Rad) dan dicitrakan dengan Bio-Rad ChemiDoc MP Imaging System dengan perangkat lunak Image Lab, menggunakan protokol chemiluminescence. Setelah pencitraan, blot dapat diukur dengan menggunakan perangkat lunak Fiji ImageJ (Schindelin et al. 2012 ) untuk mengkorelasikan intensitas piksel dengan produksi protein.
2.11 Verifikasi Efek Fototoksik EL222 pada Strain Sekresi
Kami menguji apakah fototoksisitas akan mempengaruhi produksi yang disekresikan dengan mengekspresikan bersama EL222 dalam strain yang mengeluarkan yEGFP dari P AOX1 menggunakan tag sekresi faktor-α (Gambar 5 ). Untuk membuat strain ini, pertama-tama kami mentransformasi NRRL Y-11430 dengan plasmid untuk sekresi yEGFP (SMH158) dan menanamkannya pada pelat agar zeocin 1000 μg/mL, menghasilkan ySMH154-1. Strain ini kemudian ditransformasi dengan plasmid yang mengandung EL222 (SMH139) dan ditanamkan pada G418 1000 μg/mL untuk membuat ySMH185. Setelah membuat kedua strain ini, kami menginokulasi masing-masing ke dalam medium BMG1 1 mL dalam pelat 24 sumur dan diinkubasi selama 20 jam dalam gelap pada suhu 30°C dengan pengocokan 200 rpm. Setelah periode ini, 150 μL dari setiap kultur diinokulasi ke dalam 15 mL BMG1 dalam labu Erlenmeyer 125 mL dan ditumbuhkan lagi selama 20 jam pada suhu 30°C dan pengocokan 200 rpm dalam gelap. Kultur kemudian disentrifugasi selama 5 menit pada 234 g dan disuspensikan kembali ke dalam medium BMM1 15 mL. Spektrofotometer Eppendorf (BioSpectrometer basic) digunakan untuk mengukur kepadatan sel, dan kultur disamakan dengan OD 600 sebesar 10 dalam BMM1 dan dipipet dalam rangkap tiga ke lima pelat 24-sumur yang identik. Setiap pelat diinkubasi 24 jam pada suhu 30°C dan pengocokan 200 rpm, dengan setiap pelat terkena intensitas cahaya yang berbeda (gelap, 10
aku
, 30
aku
, 50
aku
, atau 70
aku
). Setelah periode ini, kultur diisi ulang dengan metanol hingga mencapai konsentrasi akhir 1% dan dikembalikan ke kondisi cahaya masing-masing selama 24 jam. Terakhir, pelat disentrifugasi selama 5 menit pada 234 g dan dianalisis dengan dot blot menggunakan 350 μL supernatan (Gambar 5a ). Dot blot ini selanjutnya diukur menggunakan perangkat lunak Fiji ImageJ (Schindelin et al. 2012 ) untuk mengubah intensitas piksel menjadi produksi relatif (Gambar 5b ).
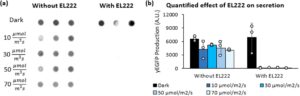
2.12 Analisis Dot Blot Protein yang Disekresikan
Dot blot digunakan untuk menganalisis eksperimen sekresi di mana jumlah sampel melebihi apa yang dapat dijalankan pada gel SDS-PAGE (Gambar 5a , Informasi Pendukung S1: Gambar S14, S15 , dan S16 ). Kami mensentrifugasi pelat kultur selama 5 menit pada 234 g dan menyaring 350 μL supernatan dari setiap sumur melalui membran nitrocellulose dalam Bio-Dot Microfiltration Apparatus (Bio-Rad) menggunakan protokol yang direkomendasikan untuk peralatan tersebut. Setelah penyaringan, membran diinkubasi selama 1 jam pada suhu kamar dalam buffer pemblokiran (1X TBS, 0,1% Tween-20 dengan 5% b/v susu bubuk tanpa lemak) dan diuji menggunakan THE His Tag Antibody [HRP], mAb (Genscript) pada pengenceran 1:10.000. Setelah diinkubasi dengan antibodi selama 1 jam pada suhu ruangan, kami mencuci membran empat kali selama 10 menit dengan TBST (1X TBS, 0,1% Tween-20). Terakhir, kami mencitrakan bercak dengan substrat Clarity ECL (Bio-Rad) pada Sistem Pencitraan Bio-Rad ChemiDoc MP menggunakan protokol chemiluminescence.
2.13 Sekresi yEGFP, SR18, dan β-Lactoglobulin Menggunakan Optogenetika dan P AOX1
Produksi tiga protein yang disekresikan dibandingkan antara P AOX1 dan dua versi sistem optogenetik yang dipisahkan (berbeda berdasarkan jumlah salinan EL222). Galur yang diinduksi metanol dibuat dengan mentransformasi NRRL Y-11430 dengan konstruksi yang mensekresikan gen yang diinginkan dari P AOX1 menggunakan tag sekresi faktor-α, menghasilkan ySMH154 (yEGFP), ySMH223 (SR18), dan ySMH51 (β-laktoglobulin), semuanya menggunakan PmeI untuk melinearisasi plasmid. Kami mengkonstruksi galur optogenetik dengan mentransformasi ySMH203-16 (salinan tunggal EL222) dan ySMH203-2 (lima salinan EL222) dengan plasmid yang dilinearisasi dengan PmeI untuk mensekresikan gen yang diinginkan dari P C120 menggunakan tag sekresi faktor-α yang sama. Galur yang dihasilkan dengan satu salinan EL222 adalah ySMH217 (yEGFP), ySMH230 (SR18), dan ySMH224 (β-laktoglobulin), sedangkan galur dengan lima salinan EL222 adalah ySMH219 (yEGFP), ySMH231 (SR18), dan ySMH226 (β-laktoglobulin). Semua transformasi ditanam pada zeocin 500 dan 1000 μg/mL.
Kami menyaring 94 koloni dari setiap strain dalam format 96-well dalam pelat deep-well (USA Scientific). Untuk strain yang diinduksi metanol, setiap koloni diinokulasi ke dalam 500 μL medium BMG1 dalam pelat deep-well, dengan dua well terakhir disimpan untuk kontrol tipe liar dan kontrol negatif kosong. Setelah masa inkubasi 1 hari pada suhu 30°C dan pengocokan pada 300 rpm, pelat disentrifugasi pada 234 g selama 5 menit dan supernatan diganti dengan 500 μL medium BMM1 segar. Sel diinduksi selama 48 jam pada suhu 30°C dengan pengocokan 300 rpm, dengan metanol ditambahkan setelah 24 jam untuk mengembalikan konsentrasi akhir ke 1% (dengan asumsi semua metanol awal telah dikonsumsi dalam 24 jam pertama). Setelah fase produksi, pelat disentrifugasi lagi selama 5 menit pada 234 g dan 350 μL supernatan dari setiap sumur dianalisis dengan dot blot (Informasi Pendukung S1: Gambar S14a, S15a , dan S16a ). Koloni dengan produksi tertinggi dari setiap galur dipilih untuk percobaan selanjutnya pada skala labu.
Untuk menyaring galur optogenetik, 94 koloni dari setiap galur diinokulasi ke dalam medium BMD1 500 μL di pelat sumur dalam dan ditumbuhkan dalam gelap selama 1 hari pada suhu 30°C dengan pengocokan 300 rpm. Pelat kemudian disentrifugasi selama 5 menit pada kecepatan 234 g dan disuspensikan kembali dalam medium BMD1 segar. Kami menempatkan pelat dalam kondisi cahaya yang sesuai (5
aku
untuk strain EL222 5 salinan dan 50
aku
untuk galur EL222 1-salinan) untuk diproduksi selama 48 jam pada suhu 30°C dengan pengocokan pada 300 rpm. Glukosa ditambahkan ke konsentrasi akhir 1% pada titik 24 jam inkubasi ini (dengan asumsi semua glukosa awal telah dikonsumsi dalam 24 jam pertama). Akhirnya, kami mensentrifugasi pelat pada 234 g selama lima menit dan dianalisis dengan dot blot seperti pada galur yang diinduksi metanol (Informasi Pendukung S1: Gambar S14b,c , S15b,c , dan S36b,c ).
Setelah produsen terbaik dari setiap galur diidentifikasi, kami kemudian melakukan pengujian dalam tabung goyang untuk membandingkan produksi antara optogenetika dan P AOX1 dalam rangkap tiga. Pertama, setiap galur diinokulasi ke dalam 1 mL media minimal (BMG1 untuk ySMH154-C5, ySMH223-G5, dan ySMH51-D2 dan BMD1 untuk ySMH217-A2, ySMH219-D7, ySMH230-A6, ySMH231-G2, ySMH224-A11, dan ySMH226-C1) dalam pelat 24 sumur dan ditumbuhkan selama 20 jam pada suhu 30°C dengan pengocokan 200 rpm dalam gelap. Setelah pertumbuhan ini, 400 μL dari setiap kultur diinokulasi ke dalam 40 mL media segar (BMG1 untuk galur yang diinduksi metanol dan BMG1 dan BMD1 untuk galur optogenetik) dalam labu Erlenmeyer 500 mL untuk pertumbuhan kedua semalam dalam gelap. Setelah 20 jam, kami mensentrifugasi kultur selama 5 menit pada 234 g dan disuspensikan kembali dalam 40 mL media segar lagi (BMM1 untuk galur yang diinduksi metanol dan BMG1 dan BMD1 untuk galur optogenetik). Kami mengukur kepadatan sel dengan spektrofotometer Eppendorf (BioSpectrometer basic) dan menyamakannya dengan OD 600 sebesar 10 di media masing-masing. 12,5 mL dari setiap kultur dipindahkan ke tiga labu Erlenmeyer 125 mL yang identik, yang kemudian diinkubasi pada 30°C dengan pengocokan pada 200 rpm. Labu optogenetik disinari dengan intensitas cahaya 50
aku
untuk strain EL222 1 salinan dan 5
aku
untuk strain EL222 5-salinan menggunakan platform iluminator (Informasi Pendukung S1: Gambar S4 ). Setelah 24 jam inkubasi, sel-sel tersebut diisi ulang dengan sumber karbonnya hingga konsentrasi 1% dan dikembalikan ke 30°C selama 24 jam tambahan. Kami memanen fermentasi dengan cara mensentrifugasi kultur selama 5 menit pada 234 g dan menganalisis supernatan menggunakan western blot kuantitatif (Gambar 6 , Informasi Pendukung S1: Gambar S17, S18 , dan S19 ).
2.14 Peningkatan Produksi dalam Bioreaktor 2 L
Produksi nanobody SR18 ditingkatkan ke level bioreaktor 2-L menggunakan galur ySMH223-G5 (diinduksi metanol) dan ySMH230-A6 (optogenetik dengan 1 salinan EL222), yang diidentifikasi sebagai penghasil terbaik melalui penyaringan dot blot. Kedua galur pertama kali diinokulasi ke dalam 5 mL media YPD dengan 100 μg/mL zeocin dan ditumbuhkan dalam gelap selama 20 jam dengan pengocokan 200 rpm. Kami menggunakan 2 mL kultur yang ditumbuhkan untuk menginokulasi 50 mL YPD dalam labu Erlenmeyer 500 mL yang berisi 100 μg/mL zeocin dan menumbuhkannya lagi selama 20 jam dalam gelap. Setelah pertumbuhan ini, sel-sel dipekatkan dengan sentrifugasi selama 5 menit pada kecepatan 234 g dan membuang 25 mL supernatan, setelah itu OD 600 diukur menggunakan spektrofotometer Eppendorf (BioSpectrometer basic). Untuk memastikan kepadatan sel yang diukur berada dalam rentang linier instrumen (OD 600 < 10), sampel 0,1 mL dari setiap kultur pertama-tama diencerkan 1:10 dalam media segar sebelum pengukuran. Percobaan bioreaktor mengikuti resep yang telah ditentukan sebelumnya, dipilih secara acak dan tidak berasal dari desain percobaan atau prosedur pengoptimalan apa pun. Namun, hal ini bertujuan untuk memberikan wawasan awal tentang dinamika proses pada skala ini.
Kami menyiapkan sistem BioFlo120 dengan bioreaktor 2 L (Eppendorf, B120110001) dan menambahkan 1 L medium garam basal (BSM) yang dilengkapi dengan 4,35 mL garam jejak PTM1 (Invitrogen 2000 ) dan 4% b/v gliserol, bersama dengan 100 μL Antifoam 204 (Sigma-Aldrich). Reaktor diatur pada suhu 30°C dengan pH 5,0, yang dipertahankan menggunakan 14% amonium hidroksida. Setelah mencapai titik setel ini, probe oksigen terlarut dikalibrasi dan diatur pada persentase minimum 30% dengan menyesuaikan kecepatan agitasi (200–600 rpm) dan laju aliran udara (0,1–3 SPLM). Kepadatan sel diukur menggunakan sensor biomassa noninvasif dengan rentang linier lebar dari kurang dari 0,1 hingga lebih dari 300 unit OD (bug lab BE2100). Kami kemudian menginokulasi reaktor dengan kultur terkonsentrasi (baik ySMH223-G5 atau ySMH230-A6) hingga OD 600 sebesar 1. Sel-sel ditumbuhkan selama ~24 jam dalam kondisi represif (kegelapan dalam kasus galur optogenetik ySMH230-A6) hingga lonjakan oksigen terlarut diamati, yang menandakan akhir fase batch. Setelah fase batch, fase semi-batch singkat dilakukan (masih dalam kondisi represif untuk eksperimen bioreaktor optogenetik dan non-optogenetik) dengan memberi makan gliserol 50% b/v yang dilengkapi dengan 12 mL/L PTM1 selama 4 jam pada laju 6 mL/jam. Lonjakan oksigen terlarut diamati setelah penghentian pakan, yang menunjukkan konsumsi gliserol penuh.
Untuk menginduksi produksi pada strain P AOX1 yang dikontrol, 100% metanol yang disuplemen dengan 12 mL/L PTM1 dimasukkan ke reaktor pada laju awal 3,6 mL/jam. Setelah 4 jam pada laju ini, umpan dimatikan hingga lonjakan lain dalam oksigen terlarut diamati, setelah itu laju aliran ditingkatkan menjadi 7,2 mL/jam. Metanol dimasukkan pada laju aliran yang lebih tinggi ini selama 48 jam (sisa fermentasi). Untuk mencegah pembusaan berlebih, 100 μL Antifoam 204 ditambahkan kira-kira setiap 12 jam setelah dimulainya induksi. Sampel sebanyak 5 mL diambil pada setiap titik waktu pasca-induksi untuk analisis menggunakan pewarnaan Coomassie gel SDS-PAGE dan uji Bradford seperti yang dijelaskan sebelumnya (Kielkopf et al. 2020 ; Hoffman et al. 2022 ).
Untuk menginduksi produksi dalam operasi bioreaktor optogenetik, panel LED yang diposisikan di bawah reaktor dinyalakan, dan campuran gliserol (gliserol 50% b/v yang ditambah dengan 12 mL/L PTM1) dimasukkan pada laju 4,5 mL/jam. Laju umpan ini dipilih untuk menyediakan jumlah sumber karbon yang setara secara massa seperti pada percobaan yang diinduksi metanol. Setelah 4 jam, laju aliran ditingkatkan menjadi 9 mL/jam untuk sisa fermentasi. Antibusa 204 ditambahkan, dan sampel diambil seperti yang disebutkan sebelumnya dalam operasi bioreaktor yang diinduksi metanol. Sampel dianalisis menggunakan pewarnaan Coomassie dari gel SDS-PAGE dan uji Bradford seperti yang dijelaskan sebelumnya pada waktu yang sama dan dengan reagen yang sama seperti kultur yang diinduksi metanol (Kielkopf et al. 2020 ; Hoffman et al. 2022 ). Untuk pengujian Bradford, bovine serum albumin (BSA) (Sigma-Aldrich) digunakan untuk menghasilkan kurva standar.
3 Hasil
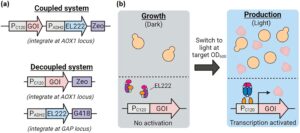
Bahasa Indonesia: Untuk menetapkan kontrol optogenetik ekspresi gen dalam K. phaffii , kami mengekspresikan EL222 secara konstitutif menggunakan promotor P ADH2 asli dengan gen yang diinginkan di hilir promotor P C120 (Motta-Mena et al. 2014 ). Kami memilih promotor P ADH2 untuk mengekspresikan EL222 karena perilaku konstitutif sedang yang dilaporkan sebelumnya dalam glukosa dan gliserol (Vogl et al. 2016 ). Sementara P ADH2 paling kuat dalam etanol, ia masih aktif dalam sumber karbon lain, termasuk metanol, glukosa, dan gliserol (masing-masing sekitar 23%, 10% dan 5% dari kadar etanol) (Ergün et al. 2019 ). Etanol yang diproduksi ketika tumbuh dalam glukosa oleh karena itu diharapkan untuk meningkatkan P ADH2 , terutama ketika glukosa habis (Vogl et al. 2016 ; Ergün et al. 2019 ; Steimann et al. 2024 ). Dengan menggunakan promotor ini, kami mengembangkan dua sistem yang diaktifkan oleh cahaya yang memungkinkan integrasi EL222 dan gen yang diinginkan baik yang digabungkan maupun yang dipisahkan (Gambar 1a ). Sistem yang digabungkan, yang diuntungkan dari kesederhanaan, menggunakan satu vektor dengan penanda seleksi resistensi zeocin, dan dengan demikian mengintegrasikan jumlah salinan EL222 dan gen yang diinginkan yang sama. Sistem yang dipisahkan mengintegrasikan gen-gen ini secara terpisah, yang memungkinkan jumlah salinan EL222 dan gen yang diinginkan dipilih secara independen menggunakan G418 dan zeocin, masing-masing. Kedua sistem menawarkan keuntungan yang berbeda dalam pengembangan galur untuk proses dua fase yang dicirikan oleh fase pertumbuhan gelap dan fase produksi yang diinduksi cahaya (Gambar 1b ).
3.1 Pengembangan dan Karakterisasi Sistem Induksi Optogenetik pada K. phaffii



Selanjutnya kami menyelidiki fototoksisitas EL222. Salah satu hipotesisnya adalah bahwa aktivasi EL222 menghasilkan spesies oksigen reaktif (ROS) yang merusak, yang dapat menghambat pertumbuhan sel dan produksi protein. Dengan demikian, kadar EL222 dan intensitas cahaya yang lebih tinggi akan meningkatkan konsentrasi ROS dan memperburuk efek ini. Meskipun sebelumnya tidak ditunjukkan dengan EL222, protein responsif cahaya lainnya yang mengandung domain LOV diketahui memancarkan ROS, khususnya oksigen tunggal, ketika diaktifkan oleh cahaya (Endres et al. 2018 ; Hernández-Candia et al. 2018 ). Untuk menguji apakah hal yang sama berlaku untuk EL222, kami mengekspresikan berlebihan gen superoksida dismutase ( SOD1 ), protein membran peroksisomal 20 ( PMP20 ), dan katalase ( CTA1 ), yang mengkode enzim pemulung ROS utama dalam K. phaffii (Ragona et al. 1999 ) (Informasi Pendukung S1: Gambar S10 ). Tidak seperti galur induk yang mengandung 7 salinan EL222 tanpa mengekspresikan berlebihan enzim pemulung ROS (Informasi Pendukung S1: Gambar S10b ), galur yang mengekspresikan berlebihan PMP20 tumbuh sama baiknya dengan atau tanpa paparan cahaya (Informasi Pendukung S1: Gambar S10c ) sementara galur yang mengekspresikan berlebihan CTA1 atau SOD1 tidak meningkatkan pertumbuhan dalam cahaya (Informasi Pendukung S1: Gambar S10d,e ). Mengingat bahwa ROS utama yang umumnya dipancarkan oleh protein yang mengandung domain LOV fototoksik adalah oksigen singlet (Endres et al. 2018 ; Hernández-Candia et al. 2018 ), dan bahwa Cta1p dan Sod1p masing-masing mengonsumsi hidrogen peroksida dan superoksida, tidak mengherankan bahwa enzim-enzim ini tidak melindungi pertumbuhan sel dari kombinasi toksik cahaya biru dan EL222. Sementara substrat ROS untuk Pmp20p kurang terkarakterisasi dibandingkan dengan Sod1p dan Cta1p, hasil kami mendukung hipotesis bahwa emisi ROS oleh EL222 adalah penyebab efek fototoksiknya. Emisi ROS ini, yang kemungkinan meningkat seiring dengan jumlah salinan EL222, menawarkan wawasan baru untuk meningkatkan produksi dengan mengoptimalkan kadar EL222 dan cahaya. Strategi terbaik untuk mencapainya adalah dengan menggunakan sistem optogenetik yang dipisahkan karena sistem ini mengintegrasikan EL222 dan gen yang diinginkan secara independen (panel bawah Gambar 1a ). Kami memanfaatkan sistem optogenetik yang dipisahkan untuk menghasilkan protein di luar yEGFP, termasuk protein kaki kerang Mfp5, β-laktoglobulin, dan nanobodi terhadap SARS-CoV-2.
3.2 Induksi Optogenetik untuk Produksi Intraseluler Protein Kaki Kerang Mfp5
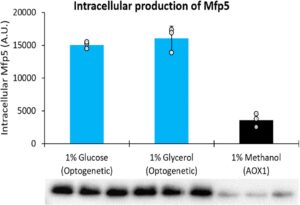
Untuk menunjukkan kemampuan optogenetika untuk mengendalikan produksi protein intraseluler selain yEGFP, kami menggunakan sistem decoupled untuk memproduksi protein kaki kerang Mfp5 dari Mytilus californianus , yang memiliki aplikasi dalam industri biomaterial (Zhao dan Waite 2006 ). Kami mentransformasi strain yang mengandung satu salinan EL222 dengan kaset gen yang mengandung P C120 -Mfp5 dan penanda seleksi zeocin. Untuk membandingkan cahaya dengan induksi metanol, kami juga mentransformasi strain tipe liar untuk mengekspresikan Mfp5 dengan P AOX1 sebagai ganti P C120 dan menguji produksi dengan metanol atau induksi cahaya biru. Setelah menyaring 14 strain optogenetika yang diinduksi dengan cahaya biru (pada 50
aku
Intensitas) dan 14 strain yang diinduksi metanol untuk produksi Mfp5 (Informasi Pendukung S1: Gambar S11 ), produsen teratas masing-masing dibandingkan dalam rangkap tiga (Gambar 4 , Informasi Pendukung S1: Gambar S12 ). Di bawah kondisi yang diuji, kami menemukan bahwa produksi Mfp5 dengan sistem optogenetik lebih besar daripada dengan P AOX1 . Strain diinduksi pada kepadatan sel yang identik (OD 600 = 10) dan setelah 48 jam induksi tumbuh menjadi biomassa yang sebanding dalam media gliserol dan metanol, dengan pertumbuhan yang sedikit lebih rendah dalam glukosa (Informasi Pendukung S1: Gambar S13a ). Meskipun demikian, jumlah biomassa yang sama untuk setiap sampel dimuat pada gel poliakrilamida (Gambar 4 ) untuk memastikan perbandingan yang adil (lihat Bagian 2 ).
3.3 Induksi Optogenetik Protein yang Disekresikan
Berikutnya, kami mengalihkan fokus kami ke sekresi protein, yang sering menyederhanakan operasi pemurnian hilir industri. Pertama, kami menyelidiki apakah efek penghambatan kadar EL222 yang tinggi pada intensitas cahaya tinggi juga terjadi saat mensekresi protein. Untuk menguji ini, kami membandingkan dua galur yang mensekresi yEGFP dari P AOX1 , yang berbeda hanya pada apakah mereka mengekspresikan EL222 secara bersamaan. Dalam percobaan ini, EL222 sebenarnya tidak mengendalikan ekspresi protein, jadi galur harus bekerja secara sebanding terlepas dari intensitas cahaya jika EL222 bukan merupakan faktor. Namun, sekresi protein dari galur yang mengekspresikan EL222 sangat terganggu oleh paparan cahaya apa pun (Gambar 5 ). Sebaliknya, galur kontrol relatif tidak terpengaruh pada semua intensitas yang diuji. Hasil ini konsisten dengan percobaan intraseluler kami (Gambar 3 , Informasi Pendukung S1: Gambar S10 ), yang menunjukkan bahwa aktivasi EL222 pada kondisi cahaya suboptimal memengaruhi pertumbuhan dan produksi protein, baik disekresikan atau diproduksi secara intraseluler. Dengan wawasan ini, kami menerapkan sistem optogenetik terpisah untuk sekresi protein, dengan hati-hati memilih intensitas cahaya berdasarkan nomor salinan EL222.
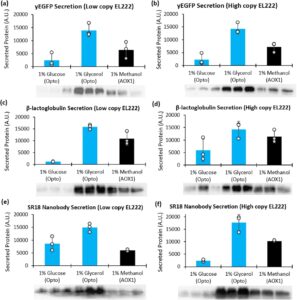
Sebagai target pertama, kami membandingkan sekresi yEGFP antara galur yang diinduksi optogenetik dan metanol. Untuk sistem optogenetik, pertama-tama kami membuat serangkaian galur platform dengan berbagai nomor salinan EL222, yang diverifikasi oleh qPCR (Informasi Pendukung S1: Gambar S3 ). Galur dengan salinan EL222 rendah (satu) dan tinggi (lima) kemudian ditransformasi dengan P C120 -yEGFP dan diuji untuk sekresi yEGFP pada intensitas cahaya yang tidak berbahaya: 50
aku
untuk 1 salinan EL222, dan 5
aku
untuk 5 salinan EL222. Untuk setiap sistem, kami menyaring 94 galur dengan dot blot untuk mengidentifikasi produsen yang sesuai (Informasi Pendukung S1: Gambar S14 ). Setelah memilih galur optogenetik dan yang diinduksi metanol teratas, kami membandingkan sekresi yEGFP mereka dalam rangkap tiga, dengan galur optogenetik yang dibudidayakan (dan diinduksi) dalam media yang mengandung glukosa atau gliserol (Gambar 6a,b , Informasi Pendukung S1: Gambar S17 ). Di bawah kondisi yang diuji, western blot kuantitatif menunjukkan bahwa galur optogenetik dalam media gliserol menghasilkan lebih banyak yEGFP daripada galur yang diinduksi metanol sekitar dua kali lipat. Namun, tidak seperti produksi intraseluler, sekresi optogenetik dalam glukosa lebih lemah daripada P AOX1 . Penyebab perbedaan ini tidak jelas tetapi konsisten di seluruh galur EL222 rendah dan tinggi. Namun demikian, produksi yang kuat dalam gliserol memotivasi kami untuk menguji sekresi protein lain dengan nilai yang lebih tinggi.
Untuk menunjukkan bahwa sekresi optogenetik efektif untuk protein di luar yEGFP, kami menggunakannya untuk memproduksi protein susu β-laktoglobulin (Ragona et al. 1999 ) dan nanobodi SR18 yang menetralkan protein lonjakan virus SARS-CoV-2 (Chen et al. 2021 ). Seperti halnya dengan yEGFP, kami menggunakan dot blot untuk menyaring galur yang diinduksi optogenetik dan metanol dan membandingkan produsen terbaik dalam rangkap tiga (Informasi Pendukung S1: Gambar S15 dan S16 ). Galur diinduksi pada kepadatan sel yang identik (OD 600 = 10) dan setelah 48 jam induksi, sel tumbuh secara berbeda dalam sumber karbon yang berbeda. Dalam kebanyakan kasus, galur tumbuh menjadi biomassa yang sebanding dalam media gliserol dan metanol, sedangkan pertumbuhan dalam glukosa tidak pernah melebihi galur yang tumbuh dalam metanol (Informasi Pendukung S1: Gambar S13b ). Untuk kedua protein, di bawah kondisi yang diuji, induksi cahaya P C120 menghasilkan produksi yang lebih tinggi dalam gliserol dibandingkan dengan induksi metanol P AOX1 , terlepas dari jumlah salinan EL222 (Gambar 6c–f , Informasi Pendukung S1: Gambar S18 dan S19 ). Seperti yang diamati sebelumnya, sekresi dalam glukosa lebih lemah daripada dalam gliserol dan umumnya lebih lemah daripada P AOX1 . Secara keseluruhan, hasil ini menunjukkan bahwa cahaya dapat menjadi alternatif yang kuat untuk induksi metanol untuk berbagai aplikasi, khususnya dalam media gliserol.
3.4 Peningkatan Skala Induksi Cahaya ke Bioreaktor
Bahasa Indonesia: Setelah mencapai induksi cahaya yang kuat dari produksi protein dalam labu kocok, selanjutnya kami menguji sistem kami dalam bioreaktor skala lab. Karena nanobodi SR18 adalah produk dengan nilai tertinggi dari tiga target yang diperiksa, kami memilihnya sebagai contoh representatif untuk peningkatan skala. Meskipun galur dengan lima salinan EL222 membutuhkan lebih sedikit cahaya daripada galur salinan tunggal, kami bergerak maju dengan satu salinan EL222, sebagai bukti konsep, karena ia menawarkan rentang dosis cahaya efektif yang lebih luas (Gambar 3 , Informasi Pendukung S1: Gambar S9 ). Ini juga merupakan opsi paling ketat untuk mengeksplorasi tantangan potensial dari penetrasi cahaya terbatas dalam bioreaktor (skala besar). Kami pertama-tama menumbuhkan sel dalam gelap, dalam bioreaktor batch 2-L menggunakan gliserol sebagai sumber karbon. Selain mengendalikan paparan cahaya, kami juga mengendalikan pH dan memantau oksigen terlarut (DO). Bahasa Indonesia: Ketika gliserol telah sepenuhnya dikonsumsi, kami memulai umpan gliserol untuk menjalankan proses fed-batch, menjaga reaktor dalam gelap selama 4 jam sebelum menerangi bagian bawah reaktor untuk menginduksi produksi SR18 (Informasi Pendukung S1: Gambar S22 ). Sebagai kontrol, kami juga melakukan proses fed-batch yang diinduksi metanol yang lebih tradisional dengan laju umpan sumber karbon yang setara dari metanol berdasarkan massa, menjaga pH dan titik setel DO yang identik. Meskipun baik proses optogenetik maupun yang dapat diinduksi metanol tidak dioptimalkan secara apriori, dan karena itu tidak dapat secara langsung dibandingkan untuk menentukan superioritas, percobaan ini memberikan dasar untuk membandingkan dinamika kedua sistem induksi dan memberikan wawasan terhadap optimasi proses di masa mendatang (misalnya, waktu induksi, laju umpan, DO, dll.). Galur yang optogenetik dan yang diinduksi metanol sama-sama produktif selama 16 jam pertama, dengan keduanya mengeluarkan sekitar 0,5 g/L SR18; Namun, di bawah kondisi yang diuji, galur optogenetik mengungguli proses yang diinduksi metanol pada setiap titik waktu berikutnya, akhirnya mencapai titer akhir 1,5 ± 0,6 g/L pada akhir fermentasi, seperti yang diukur dengan uji Bradford (Gambar 7 ). Galur optogenetik kemungkinan mendapat manfaat dari kebutuhan oksigen yang lebih rendah dari metabolisme gliserol relatif terhadap metanol (Jungo et al. 2007 ) bersama dengan toksisitas yang lebih rendah dari substrat ini, yang memungkinkan konsumsi lebih cepat, kadar oksigen yang lebih rendah, dan berpotensi tingkat produksi yang lebih besar.
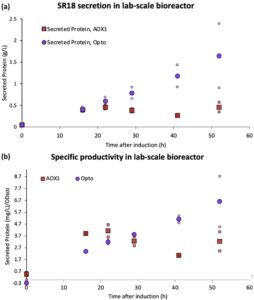
Bahasa Indonesia: Untuk mengonfirmasi bahwa sebagian besar protein yang disekresikan dalam percobaan ini adalah nanobodi SR18 yang dimaksud, kami memasangkan analisis Bradford kami dengan elektroforesis gel (Gambar 7a , Informasi Pendukung S1: Gambar S23 ). Dalam kedua sistem, seperti yang diharapkan, tidak ada sekresi protein yang terdeteksi pada permulaan induksi (selama fase gliserol untuk galur P AOX1 , dan dalam gelap untuk galur optogenetik). Namun, nanobodi ini tampaknya tidak stabil mengingat kemunculannya sebagai beberapa pita dalam gel yang diwarnai; sifat yang perlu dipertimbangkan jika protein ini dipilih untuk bioproses lebih lanjut. Namun demikian, karena pengamatan ini terjadi pada proses optogenetik dan yang digerakkan oleh P AOX1 , titer keseluruhan tetap menjadi perbandingan yang adil antara kedua sistem, bahkan jika analisis Bradford dapat melebih-lebihkan kuantitas absolut protein fungsional.
Bahasa Indonesia: Selain menjadi dua orde besaran lebih besar dalam volume daripada uji labu goyang, kultur bioreaktor mencapai kepadatan sel yang sangat tinggi, dengan sel yang diinduksi cahaya tumbuh lebih banyak daripada rekan-rekan mereka yang diinduksi metanol hampir dua kali lipat (Gambar 7b , Informasi Pendukung S1: Gambar S24 ). Karena biomassa yang lebih besar tidak selalu menguntungkan bagi protein yang disekresikan karena pertukaran metabolik biomassa-produk, kemungkinan ada peluang untuk lebih meningkatkan produktivitas volumetrik protein rekombinan dengan mengoptimalkan strategi kontrol dinamis untuk menambah keseimbangan antara pertumbuhan dan produksi sel. Pada akhirnya, produksi SR18 yang berhasil dengan induksi optogenetik dengan hanya satu salinan EL222 (strain yang paling tidak peka cahaya yang kami kembangkan) menunjukkan bahwa penetrasi cahaya bukanlah hambatan setidaknya pada skala ini. Meskipun demikian, penelitian di masa depan harus mengeksplorasi kelayakan dan kinerja pendekatan optogenetik dalam sistem bioreaktor yang lebih besar, digabungkan dengan desain bioreaktor yang sesuai untuk mendukung kontrol metabolik dinamis yang dimediasi cahaya pada skala industri.
4 Diskusi
Dalam studi ini, kami melaporkan perangkat dan metode untuk induksi produksi protein rekombinan bebas metanol pada K. phaffii dengan cahaya. Dua strategi umum yang kami kembangkan, sistem yang digabungkan atau dipisahkan (Gambar 1a ), memiliki keuntungan yang berbeda: kesederhanaan (digabungkan) versus fleksibilitas dalam desain galur untuk berbagai sensitivitas cahaya terhadap produksi protein (dipisahkan). Kedua sistem diaktifkan secara kuat dalam glukosa atau gliserol, menghilangkan kebutuhan untuk mengganti sumber karbon di tengah proses seperti halnya dengan promotor P AOX1 . Lebih jauh lagi, karena K. phaffii umumnya memetabolisme glukosa dan gliserol lebih cepat dan dapat, dalam beberapa kondisi, mencapai biomassa yang lebih tinggi dengan sumber karbon ini daripada metanol, produksi protein dapat lebih tinggi menggunakan induksi optogenetik dalam kondisi yang diuji (Gambar 7 , Informasi Pendukung S1: Gambar S24 ). Bersama-sama, metode optogenetik yang diuraikan menjanjikan untuk menginduksi produksi protein dan harus dipertimbangkan sebagai alternatif potensial untuk P AOX1 atau pendekatan berbasis media lainnya.
Sebuah studi sebelumnya menunjukkan bahwa EL222 berfungsi dalam K. phaffii (Wang et al. 2022b ), tetapi gagal mengeksplorasi kondisi di mana induksi cahaya dapat dibandingkan dengan induksi metanol. Sebaliknya, kami dengan hati-hati membandingkan kinerja berbagai desain galur optogenetik dengan P AOX1 , dengan mengendalikan faktor-faktor penting seperti jumlah salinan dan intensitas cahaya yang optimal. Jenis karakterisasi yang menghubungkan tingkat ekspresi EL222 dengan dosis cahaya optimal untuk induksi gen sebelumnya belum pernah dilaporkan dalam ragi atau organisme lainnya. Namun, penyesuaian dosis cahaya dalam konteks jumlah salinan EL222 terbukti penting untuk induksi optogenetik produksi protein dalam K. phaffii pada tingkat yang menyaingi induksi metanol. Hal ini menunjukkan bahwa karakterisasi serupa dari sistem optogenetik lain yang melibatkan berbagai protein responsif cahaya kemungkinan akan berharga untuk memperluas kemampuan sistem tersebut.
Temuan utama dalam studi kami adalah pentingnya menyesuaikan intensitas cahaya tergantung pada jumlah salinan EL222. Cahaya biru pada semua intensitas yang kami gunakan tidak menunjukkan fototoksisitas apa pun pada galur tipe liar. Namun, dosis cahaya yang lebih tinggi mengganggu pertumbuhan dan produksi protein rekombinan intraseluler dan yang disekresikan pada galur yang mengandung salinan EL222 yang tinggi (Gambar 3 dan 5 , Informasi Pendukung S1: Gambar S9 ). Pengamatan ini menimbulkan peringatan terhadap rendahnya toksisitas optogenetika yang sering dibahas (Jayaraman et al. 2016 ; Milias-Argeitis et al. 2016 ; Wang et al. 2022b ; Pérez et al. 2022 ; Hoffman et al. 2022 ), karena EL222 hanya tidak beracun di bawah ambang batas cahaya tertentu yang bergantung pada konsentrasi EL222. Kelompok kami telah menunjukkan bahwa paparan cahaya maksimal mengaktifkan EL222 secara maksimal di S. cerevisiae tanpa fototoksisitas yang dapat diamati (Zhao et al. 2018 , 2020 , 2021 ; Lalwani et al. 2021 ), tetapi semua galur dalam penelitian tersebut hanya mengandung satu salinan EL222. Konsisten dengan tren ini, beberapa penelitian melaporkan pertumbuhan yang buruk ketika mengekspresikan regulator optogenetik lain dengan kuat (Camsund et al. 2021 ; Figueroa et al. 2022 ; Romero et al. 2021 ). Temuan kami menunjukkan bahwa sistem ini bisa lebih efektif dan kurang beracun jika diuji pada dosis cahaya yang lebih rendah. Oleh karena itu, hubungan antara dosis cahaya yang sesuai dan jumlah salinan EL222 bertentangan dengan persepsi umum bahwa cahaya maksimum selalu dikaitkan dengan induksi maksimum. Dalam kajian ini, kami mengkarakterisasikan dosis cahaya berdasarkan intensitas, tetapi memanfaatkan pulsa cahaya juga merupakan strategi yang sesuai untuk pengiriman input, seperti yang disarankan oleh kemampuan penyetelan strain yEGFP salinan rendah kami (Informasi Pendukung S1: Gambar S7 ) dan kajian lainnya (Zhao et al. 2018 , 2020 ; Lalwani et al. 2021 ).
Efek perlindungan PMP20 menunjukkan bahwa efek penghambatan cahaya pada pertumbuhan dan produksi protein strain rekayasa berasal dari emisi ROS oleh EL222, yang diperburuk ketika sel yang mengekspresikan faktor transkripsi tingkat tinggi ini terpapar cahaya berlebihan (Informasi Pendukung S1: Gambar S10 ) . Ini konsisten dengan penelitian sebelumnya tentang pembentukan ROS oleh protein berbasis LOV (Endres et al. 2018 ; Hernández-Candia et al. 2018 ). Pmp20p adalah peroksiredoksin endogen yang terlibat dalam degradasi hidrogen peroksida dan hidroperoksida organik pada permukaan membran peroksisom (Yano et al. 2009 ). Meskipun diketahui meningkat dalam metanol dan hampir tidak ada dalam gliserol (Vanz et al. 2012 ; Vogl et al. 2016 ), aktivitasnya dalam kondisi pembangkitan ROS tanpa metanol belum diperiksa. ROS yang dipancarkan oleh protein berbasis LOV umumnya adalah oksigen singlet dan, pada tingkat yang lebih rendah, hidrogen peroksida (Endres et al. 2018 ). Hal ini menimbulkan kemungkinan bahwa Pmp20p juga mampu menetralkan oksigen singlet, atau bahwa EL222 memancarkan hidrogen peroksida sebagai penyebab fototoksisitasnya. Dalam penelitian selanjutnya, mungkin menarik untuk menguji apakah mengoptimalkan tingkat ekspresi PMP20 pada galur yang direkayasa akan meningkatkan toleransinya terhadap tingkat EL222 dan cahaya biru yang lebih tinggi untuk lebih meningkatkan produksi protein. Strategi lain yang layak dieksplorasi dalam penelitian selanjutnya untuk mengurangi fototoksisitas adalah dengan menggunakan mutan EL222 dengan sensitivitas cahaya yang meningkat (Wang et al. 2022a ; Gligorovski et al. 2023 , 2024 ), yang mungkin efektif pada jumlah salinan yang lebih rendah daripada EL222 tipe liar.
Memahami hubungan antara konsentrasi EL222 dan fototoksisitas secara simultan dapat memungkinkan optimalisasi intensitas cahaya di seluruh proses dan memfasilitasi pemilihan sistem yang paling sesuai untuk aplikasi tertentu. Untuk strain yang membutuhkan jumlah salinan rendah dari protein target, kesederhanaan sistem yang digabungkan menjadikannya pilihan yang lebih disukai karena hanya memerlukan satu transformasi. Strategi ini dapat diimplementasikan dengan mengganti yEGFP dalam plasmid SMH131 (disorot dalam Informasi Pendukung S1: Tabel S1 ) dengan gen yang diinginkan dan mengintegrasikannya ke dalam K. phaffii menggunakan seleksi zeocin. Namun, dalam situasi di mana jumlah salinan gen yang diinginkan lebih disukai, sistem yang dipisahkan adalah pilihan yang lebih baik untuk menghindari efek toksik dari jumlah salinan EL222 yang tinggi. Perlu dicatat bahwa, meskipun aktivitas P ADH2 yang mendorong ekspresi EL222 sedikit berbeda dalam gliserol dan glukosa, dan diperkirakan akan bervariasi jika etanol diproduksi dari yang terakhir, variasi ini diperhitungkan dalam percobaan pengoptimalan dan tercermin dalam kondisi akhir yang ditemukan optimal untuk produksi setiap protein spesifik.
Untuk mendukung adopsi strategi kami, kami menghasilkan serangkaian galur dengan berbagai nomor salinan EL222 yang dapat digunakan sebagai galur induk (disorot dalam Informasi Pendukung S1: Tabel S2 ) untuk mengintegrasikan gen yang diinginkan di bawah kendali P C120 pada berbagai nomor salinan yang dipisahkan (Informasi Pendukung S1: Gambar S3 ). Ini dapat dicapai dengan mengganti yEGFP dalam plasmid SMH234 atau Mfp5 dalam SMH244 (disorot dalam Informasi Pendukung S1: Tabel S1 ) dengan gen yang diinginkan, tergantung pada apakah protein tersebut dimaksudkan untuk disekresikan atau diproduksi secara intraseluler, dan menggunakan plasmid yang dihasilkan untuk mentransformasi galur induk dengan seleksi zeocin. Untuk aplikasi di mana penetrasi cahaya mungkin menjadi masalah (misalnya, dalam bioreaktor skala besar), ySMH203-2 dan ySMH203-21 (masing-masing berisi 5 dan 8 salinan EL222) mungkin merupakan galur terbaik untuk digunakan, karena mereka lebih responsif terhadap tingkat cahaya yang lebih rendah (disorot dalam Informasi Pendukung S1: Tabel S2 ). Dalam kasus di mana penetrasi cahaya tidak menjadi masalah, galur ySMH203-16 (hanya berisi 1 salinan EL222) menawarkan rentang intensitas cahaya yang lebih baik, sehingga lebih mudah untuk menghindari fototoksisitas (disorot dalam Informasi Pendukung S1: Tabel S2 ).
Model dinamis hibrida untuk produksi yEGFP, yang dipengaruhi oleh jumlah salinan EL222 dan intensitas cahaya (Gambar 3 ), menguraikan strategi yang sesuai untuk menangkap perilaku dinamis bioproses optogenetik untuk produksi protein rekombinan. Strategi pemodelan ini berpotensi untuk membuka skema pengoptimalan berbasis model loop terbuka dan loop tertutup yang canggih dalam studi masa depan. Masalah kontrol optimal dapat diformulasikan untuk memaksimalkan kinerja bioproses (Jabarivelisdeh et al. 2020 ; Espinel-Ríos dan Avalos 2024 ; Espinel-Ríos, Behrendt, et al. 2024 ; Espinel-Ríos, Morabito, et al. 2024 ), memanfaatkan derajat kebebasan yang tersedia sambil tunduk pada kendala yang diberlakukan oleh beberapa pengetahuan tentang sistem (dalam hal ini, model dinamis hibrida), serta pertimbangan ekonomi, teknis, keselamatan, dan lingkungan yang potensial. Dalam konteks produksi protein rekombinan optogenetik, derajat kebebasan kepentingan mencakup variabel seperti ukuran inokulum, konsentrasi substrat awal, pemilihan galur dengan nomor salinan EL222 tertentu, lintasan intensitas cahaya dinamis seperti dalam proses dua fase, dan laju umpan seperti dalam bioreaktor fed-batch. Lebih jauh, strategi pemodelan memungkinkan potensi penggunaan optimasi terkait Bayesian (Shahriari et al. 2016 ). Menggabungkan varians proses Gaussian ke dalam masalah optimasi berbasis model dapat mengungkap area dengan ketidakpastian (parameter) yang tinggi, memfasilitasi penyeimbangan eksplorasi dan eksploitasi sistem (Espinel-Ríos et al. 2023 ). Implementasi optimasi berbasis model tingkat lanjut dan strategi kontrol ini dalam bioproses berbantuan optogenetik saat ini sedang dikembangkan dalam kelompok kami.
Bahasa Indonesia: Saat menerapkan sistem decoupled untuk menghasilkan protein yang disekresikan, temuan yang tak terduga adalah bahwa produksi dalam glukosa lebih lemah daripada dalam gliserol dan, dalam kebanyakan kasus, metanol. Ini diamati untuk ketiga target protein yang diuji (yEGFP, β-lactoglobulin, SR18) dan pada jumlah salinan EL222 rendah dan tinggi (Gambar 6 ). Meskipun mekanisme yang menyebabkan perbedaan ini tidak dipahami, kami berhipotesis bahwa hal itu terkait dengan beberapa interferensi antara glukosa, cahaya, dan regulasi jalur sekresi, karena tingkat produksi protein intraseluler menggunakan induksi cahaya serupa antara glukosa dan gliserol (Informasi Pendukung S1: Gambar S5 ). Studi masa depan akan diperlukan untuk memahami fenomena ini. Namun demikian, di bawah kondisi yang kami uji, kami menemukan bahwa gliserol adalah sumber karbon terbaik untuk kontrol optogenetik sekresi protein. Dengan demikian, kami memilih gliserol sebagai substrat saat menskalakan ke bioreaktor.
Percobaan bioreaktor kami menunjukkan bahwa induksi cahaya sekresi protein dapat berhasil dicapai dalam kultur 1-L pada kepadatan sel yang sangat tinggi, bahkan dengan strain yang hanya mengandung satu salinan EL222 (Gambar 7 , Informasi Pendukung S1: Gambar S23 dan S24 ). Menggunakan strain ini memberi kami rentang kondisi cahaya yang lebih luas, yang memfasilitasi proses peningkatan skala. Namun, strain ini juga menunjukkan respons cahaya terendah dari strain induk yang kami kembangkan, sehingga membuka kemungkinan untuk memeriksa dosis cahaya yang berbeda pada skala ini. Hasil ini juga meningkatkan prospek untuk mendapatkan induksi cahaya yang kuat dalam bioreaktor skala percontohan atau demonstrasi yang lebih besar menggunakan strain dengan jumlah salinan EL222 yang lebih tinggi, yang setidaknya 10 kali lebih sensitif terhadap cahaya (berdasarkan pengamatan bahwa strain dengan satu salinan membutuhkan 50
aku
untuk memaksimalkan induksi, sementara strain yang mengandung delapan salinan aktif sepenuhnya hanya pada 5
aku
, dan mungkin kurang) (Gambar 3 ). Peningkatan lebih lanjut produksi protein yang diinduksi cahaya dalam K. phaffii dapat dilakukan di masa depan dengan mengadaptasi fotobioreaktor industri yang ada yang digunakan dalam proses mikroalga dan sianobakteri, dengan menerapkan prinsip desain fotobioreaktor yang diketahui untuk membuat sistem baru (Qin et al. 2018 ; Trivedi et al. 2021 ; Chanquia et al. 2022 ; Syafiqa Abdul Nuri et al. 2023 ; Abdur Razzak et al. 2024 ). Solusi lain yang mungkin menggunakan teknologi yang ada termasuk bioreaktor plastik transparan skala industri, LED yang dapat tenggelam, dan ruang penerangan transparan tempat kultur dapat disirkulasikan kembali dari bioreaktor baja tahan karat besar (Carrasco-López et al. 2020 ). Secara keseluruhan, hasil kami mengurangi kekhawatiran mengenai penetrasi cahaya dalam bioreaktor skala laboratorium dan menjadi pertanda baik bagi pengembangan proses skala industri yang dikendalikan secara optogenetik di masa mendatang.
5 Kesimpulan
Sistem dan metode optogenetik yang kami kembangkan menunjukkan bahwa cahaya adalah penginduksi atau masukan kontrol yang cocok dalam konteks kontrol metabolik dinamis dan produksi protein rekombinan oleh K. phaffii . Dengan demikian, pekerjaan kami menawarkan alternatif yang menjanjikan untuk induksi metanol konvensional, dengan potensi untuk meningkatkan penyetelan dan fleksibilitas proses. Interaksi antara jumlah salinan EL222 dan dosis cahaya muncul sebagai derajat kebebasan kritis untuk pengoptimalan dan kontrol di masa mendatang, khususnya dalam pendekatan berbasis model dan desain bioreaktor. Metode yang kami usulkan melengkapi kotak peralatan rekayasa metabolik dan bioproses untuk merancang dan mengoperasikan proses produksi protein rekombinan. Selain itu, di luar aplikasi yang diuraikan, studi ini meletakkan dasar bagi pendekatan sibergenetik tingkat lanjut untuk kontrol metabolik dinamis menggunakan optogenetika, termasuk strategi kontrol umpan balik seperti kontrol prediktif model dan pembelajaran penguatan.




Tinggalkan Balasan