Abstrak
Lebah sosial dari suku Meliponini (lebah tanpa sengat) digunakan sebagai penyerbuk tanaman yang dikelola di seluruh wilayah tropis dan subtropis di dunia. Di Pantai Timur Australia, dua spesies asli— Tetragonula carbonaria dan Tetragonula hockingsi —adalah yang paling banyak diperbanyak di sarang, tetapi pengetahuan tentang biologi dan ekologi mereka di sarang alami masih kurang terdokumentasi. Di sini kami memantau populasi liar Tetragonula di hutan sisa di Queensland tenggara selama periode 5 tahun untuk menilai tiga aspek riwayat hidup mereka: (i) tingkat kematian koloni, (ii) tingkat pergantian ratu dan (iii) insiden perampasan sarang. Yang terakhir terjadi ketika satu koloni merebut rongga sarang yang lain, menempatkan ratunya sendiri dan memperbudak pekerja dan induk yang ada. Kisaran T. hockingsi telah meningkat dalam beberapa dekade terakhir karena perdagangan sarang dan perluasan jangkauan ke selatan. Daerah studi kami terletak di wilayah selatan tumpang tindih dengan T. carbonaria . Sebanyak 58 koloni liar diidentifikasi dalam lokasi studi (1,5 sarang per hektar), tiga perempatnya adalah T. carbonaria . Mortalitas koloni rata-rata 8,3% per tahun, sehingga 40% koloni telah mati pada akhir interval studi 5 tahun. Pengurutan mitokondria-COI dan genotipe mikrosatelit pekerja pada empat titik waktu digunakan untuk menyimpulkan bahwa pergantian ratu (yaitu, ratu digantikan oleh ratu anak) biasanya terjadi setiap 20-30 bulan. Delapan kasus terdeteksi konsisten dengan perebutan sarang antarspesies, di mana T. hockingsi menggantikan T. carbonaria . Namun, koloni T. hockingsi juga memiliki kelangsungan hidup tahunan yang lebih rendah daripada T. carbonaria , yang menghasilkan proporsi yang stabil dari setiap spesies di area studi dari waktu ke waktu. Secara keseluruhan, hasil menunjukkan bahwa meskipun hunian sarang oleh koloni Tetragonula biasanya berlangsung beberapa tahun, kematian koloni dan perebutan sarang umum terjadi pada populasi liar, dan komposisi komunitas dibentuk oleh perbedaan antarspesies dalam keberhasilan perebutan dan mortalitas tahunan.
PERKENALAN
Lebah tanpa sengat (Apidae, Suku Meliponini) merupakan penyerbuk yang melimpah dan penting di seluruh hutan tropis dan subtropis di dunia (Bueno et al. 2023b ; Grüter 2020 ). Mereka merupakan lebah eusosial yang dapat dipelihara dan diperbanyak di sarang dan semakin banyak digunakan sebagai penyerbuk yang dikelola untuk beberapa tanaman buah dan sayuran, termasuk makadamia, mangga, alpukat, bluberi, dan kopi, dengan lebah liar tanpa sengat juga berkontribusi terhadap penyerbukan tanaman (Bueno et al. 2023b ; Halcroft et al. 2015 ; Meléndez Ramírez, Ayala, & Delfín González 2018 ; Slaa et al. 2006 ). Di Pantai Timur Australia, Tetragonula hockingsi (Cockerel, 1929) dan Tetragonula carbonaria (Smith, 1854) merupakan spesies lebah tanpa sengat yang paling umum diperbanyak (Halcroft et al. 2015 ; Heard 2016 ). Spesies ini memiliki beberapa karakteristik yang membuatnya cocok untuk dikelola sebagai penyerbuk tanaman di Australia timur tropis dan subtropis, termasuk pola makan umum, rentang pencarian makan yang sempit, kekonstanan bunga, dan ukuran koloni yang besar (Heard 2016 ; Reynolds & Robinson 2022 ; Smith et al. 2017 ; White, Cribb, & Heard 2001 ).
Memelihara dan membiakkan lebah tanpa sengat di sarang bergantung pada pengetahuan tentang perilaku reproduksinya. Di Australian Tetragonula , koloni terdiri dari satu ratu yang bertelur, dan hingga 10.000 pekerja yang mandul secara ireversibel (Bueno et al. 2020 ; Gloag et al. 2007 ). Koloni juga membesarkan jantan yang setara dengan ~20% dari total induk (Bueno et al. 2022a ) dan sejumlah kecil ratu tambahan (Bueno et al. 2022b ). Jantan dewasa meninggalkan sarang untuk mencari ratu perawan untuk dikawini sementara sebagian besar ratu muda menghilang tidak lama setelah muncul, mungkin karena mereka dibunuh oleh pekerja (Bueno et al. 2022b ). Ketika ratu penghuni koloni mati, satu ratu perawan akan meninggalkan koloni untuk kawin dengan satu jantan saja (Green & Oldroyd 2002 ) setelah itu ia kembali ke koloni untuk mulai bertelur dan tidak akan pergi lagi selama sisa hidupnya.
Ratu perawan juga dapat mewarisi koloni ketika koloni induknya bereplikasi. Tetragonula Australia memiliki dua cara replikasi koloni tersebut. Pada cara pertama, pekerja mengidentifikasi lokasi sarang baru dan perlahan-lahan menyediakannya selama berbulan-bulan dengan simpanan dan propolis dari sarang induk, sebuah strategi yang umum bagi semua spesies lebah tanpa sengat (Grüter 2020 ). Pada cara kedua, pekerja menyerang dan merebut koloni yang sudah ada dan mengambil alih sarang, induk, dan sumber dayanya. Perebutan sarang dapat melibatkan pertempuran ekstensif antarkoloni selama berhari-hari atau berminggu-minggu, yang mengakibatkan ribuan lebah mati (Cunningham et al. 2014 ; Gloag et al. 2008 ). Perebutan sarang yang berhasil mengakibatkan koloni pemenang membunuh dan mengganti ratu penghuni dengan ratu dari koloni mereka sendiri dan memperbudak induk penghuni (Lau et al. 2022 ).
Sebagian besar pemahaman kita tentang biologi Tetragonula dimungkinkan oleh pengamatan dan manipulasi eksperimental koloni yang disimpan dalam kotak buatan manusia (yaitu, sarang lebah). Sarang lebah memiliki beberapa keuntungan dalam penelitian karena dapat dibuka atau dipasangi penutup plastik sementara yang memudahkan pengamatan kerja internal koloni (Heard 2016 ). Namun, pengetahuan tentang keberhasilan reproduksi dan riwayat hidup Tetragonula yang diperoleh dari populasi liar juga diperlukan. Secara khusus, penelitian semacam itu dapat menjelaskan kondisi di mana sifat reproduksi telah berevolusi dan mengidentifikasi cara-cara di mana praktik pemeliharaan lebah dapat memengaruhi perilaku lebah.
Studi pada populasi alami juga menawarkan wawasan tentang persaingan antarspesies. T. carbonaria tersebar di pesisir New South Wales dan Queensland tenggara, dengan populasi terisolasi tambahan di Queensland utara (Dollin, Dollin, & Sakagami 1997 ) sementara T. hockingsi tersebar di sepanjang pantai Queensland. Kisaran T. hockingsi semakin meluas ke selatan dalam beberapa dekade terakhir, dibantu oleh pergerakan sarang oleh manusia (Law et al. 2024 ; Paul et al. 2023 ) dan peningkatan area simpatri di Queensland tenggara antara kedua spesies tersebut. Tetragonula hockingsi dianggap oleh banyak peternak lebah untuk mempertahankan sarang mereka lebih agresif daripada T. carbonaria (Heard 2016 ). Selain itu, studi sebelumnya terhadap lebih dari 260 sarang T. hockingsi dan T. carbonaria yang dikelola di Queensland tenggara mengungkapkan bahwa T. hockingsi lebih mungkin merebut koloni T. carbonaria daripada sebaliknya, dengan 90% pengambilalihan antarspesies yang terdokumentasi melibatkan T. hockingsi yang merebut sarang T. carbonaria (Cunningham et al. 2014 ). Oleh karena itu, pertanyaan yang menarik adalah apakah T. hockingsi mampu menggantikan T. carbonaria dari populasi liar di tepi selatan jangkauan mereka yang semakin maju.
Dalam studi ini, kami memetakan dan mengambil sampel sarang Tetragonula liar selama periode 5 tahun di sepetak hutan di Queensland tenggara tempat rentang T. carbonaria dan T. hockingsi tumpang tindih. Kami kemudian menggunakan ID spesies molekuler dan genotipe mikrosatelit dari sampel deret waktu kami untuk lebih memahami tingkat (i) kematian koloni, (ii) perebutan sarang, dan (iii) pergantian ratu, dalam populasi Tetragonula alami , dan untuk menentukan apakah perebutan sarang oleh T. hockingsi telah meningkatkan prevalensi spesies ini relatif terhadap T. carbonaria di area studi kami.
BAHAN DAN METODE
Contoh
Kami menemukan 58 lokasi sarang yang berisi koloni Tetragonula liar di sepetak semak belukar sisa di Brisbane, Australia (Hutan Toohey, -27.544, 153.047; Gambar 1 dan 2 ). Sarang ditemukan dengan mencari pohon dan batang kayu tumbang dalam area seluas sekitar 40 ha. Tiga sarang terlalu tinggi untuk diambil sampelnya (5–7 m di atas tanah) dan selanjutnya dipantau dengan pengamatan untuk kelangsungan hidup saja (yaitu, tidak termasuk dalam analisis pergantian ratu atau perampasan sarang). Di sarang yang tersisa ( n = 55), setidaknya 12 pekerja per sarang dikumpulkan baik dengan menghalangi pintu masuk sarang dengan kertas kusut saat pengumpul makanan aktif dan kemudian menggunakan aspirator untuk mengumpulkan pengumpul makanan yang kembali berkumpul di atau dekat penghalang atau dengan memegang kantong ziplock di atas pintu masuk untuk menangkap pengumpul makanan yang keluar. Pekerja dipindahkan langsung ke etanol 100% dan disimpan di laboratorium pada suhu -20°C hingga ekstraksi DNA.


Kami mengambil sampel situs sarang yang sama pada empat titik waktu: Mei 2017 ( n = 53), September 2018 ( n = 52), Mei 2019 ( n = 51) dan April 2022 ( n = 39); Gambar 3 ; Tabel S1 dan S2 . Jumlah sarang yang diambil sampelnya setiap periode bervariasi karena beberapa situs sarang tidak lagi ditempati (yaitu, koloni telah mati) dan karena dua sarang, yang mungkin baru saja didirikan sejak periode pengambilan sampel sebelumnya atau mungkin telah mengabaikannya selama pencarian sebelumnya, hanya ditemukan dan diambil sampelnya untuk pertama kalinya pada tahun 2019 (Gambar 3 ). Semua pengambilan sampel dilakukan dengan izin dari Brisbane City Council Parks and Reserves, Queensland.

Genotipe
Kami mengekstraksi DNA dari seluruh abdomen melalui metode Chelex 5% (Walsh, Metzger, & Higushi 1991 ). Kami membuat genotipe 12 pekerja per koloni, per tahun pengambilan sampel, masing-masing pada delapan lokus mikrosatelit menggunakan enam primer yang dirancang untuk T. carbonaria (Tc3.155, Tc4.214, Tc4.287, Tc4.302, Tc4.63, Tc7.13; Green, Franck, & Oldroyd 2005 ) dan dua primer yang dirancang untuk Tetragonisca angustula (Tang60, Tang70; Brito et al. 2009 ). Primer diberi label fluoresensi dengan salah satu dari empat pewarna (FAM, NED, PET, VIC; Sigma-Aldrich, AS). Kami melakukan amplifikasi reaksi berantai polimerase (PCR) menurut Green dan Oldroyd ( 2002 ), dan produk yang dihasilkan dianalisis menggunakan Genetic Analyzer 3130xl (Applied Biosystems, Inc., AS) dan divisualisasikan dalam GeneMapper v5.5 (Applied Biosystems, AS).
Kami menyimpulkan genotipe ratu dan pasangannya untuk setiap koloni dengan memeriksa genotipe pekerja. Di setiap lokus, kami menetapkan alel tunggal yang umum untuk semua pekerja sebagai alel paternal (karena jantan bersifat haploid dan ratu dalam spesies ini hanya kawin satu kali [Green & Oldroyd 2002 ]). Dua alel yang tersisa kemudian diasumsikan sebagai alel maternal (ratu), dengan setiap pekerja membawa salah satu alel ini di setiap lokus (Tabel S3 – S7 ).
Keragaman alel lebih tinggi pada T. carbonaria dibandingkan T. hockingsi untuk semua lokus (Tabel 1 ). Kemungkinan dua ratu berbagi alel yang sama persis di semua delapan lokus mikrosatelit, dan dengan demikian kemungkinan perebutan sarang tidak terdeteksi, dihitung menggunakan rumus probabilitas identitas yang dijelaskan dalam Paetkau dan Strobeck ( 1994 ):
![]()
| Lokus mikrosatelit | T. hockingsi | T.karbonaria |
|---|---|---|
| Jumlah alel (jumlah alel privat) | ||
| Tc3.155 | 5 (2) | 8 (5) |
| Tc4.214 | 4 (1) | 3 (0) |
| Tc4.287 | 5 (1) | 4 (0) |
| Tc3.302 | 3 (0) | 6 (3) |
| Tc4.63 | 7 (2) | 9 (4) |
| Tang60 | 6 (1) | 7 (3) |
| Tang70 | 3 (0) | 5 (2) |
| Tc7.13 | 7 (1) | 7 (1) |
| Rata-rata untuk semua lokus | 5 | 6.25 |
Probabilitas ini ≤0,004 untuk kedua spesies.
Identifikasi spesies
Pekerja T. hockingsi rata-rata sedikit lebih besar daripada pekerja T. carbonaria , tetapi rentang ukuran kedua spesies tersebut tumpang tindih, dan sebaliknya morfologi mereka samar (Dollin, Dollin, & Sakagami 1997 ). Oleh karena itu, kami menugaskan koloni ke spesies dengan mengurutkan fragmen sitokrom oksidase I (COI) mitokondria. Kami mengamplifikasi COI menggunakan primer Barhock_F (CTCCATTGTTACTGGGCATGC) dan Barhock_R AAGGCCGAATCCTGGAAGAA (Francoso et al. 2019 ). Amplifikasi PCR dilakukan menggunakan 94°C selama 8 menit, diikuti oleh 35 siklus 94°C, 60°C, dan 72°C masing-masing selama 30 detik, kemudian 72°C selama 9 menit. Reaksi yang digunakan adalah 1 × buffer PCR, 1,5-mM MgCl 2 , 0,2-mM dNTP, 0,4-μM forward primer, 0,4-μM reverse primer dan 1-U Taq-Ti polymerase (Fisher Biotech). Kami memvisualisasikan produk PCR melalui elektroforesis pada gel agarosa 1,5% untuk mengonfirmasi amplifikasi, setelah itu produk diurutkan oleh Macrogen Inc. (Korea Selatan). Semua koloni yang diambil sampelnya diurutkan COI pada tahun pengambilan sampel pertama (2017: n = 53) dan tahun pengambilan sampel terakhir (2022: n = 40). Pada periode pengambilan sampel kedua dan ketiga, kami melakukan pengurutan COI hanya untuk koloni dengan genotipe yang menunjukkan perubahan ratu (2018: n = 21, 2019: n = 17).
Tingkat perampasan sarang dan pergantian ratu
Dalam mendeteksi tingkat perebutan sarang, kami berasumsi bahwa Tetragonula tidak membangun sarang di lokasi sarang tempat koloni lain baru saja mati. Hal ini konsisten dengan laporan dari peternak lebah tanpa sengat Australia bahwa Tetragonula tidak menggunakan kembali sarang lama, kecuali sarang tersebut telah dibersihkan dari sebagian besar bahan sarang yang mati (D. Haley dan T. Heard, komunikasi pribadi dengan R.Gloag). Hal ini juga konsisten dengan data kami sendiri di mana empat lokasi tempat koloni mati pada tahun 2018 atau 2019 masih kosong pada tahun 2022. Oleh karena itu, kami menyimpulkan bahwa lokasi sarang yang ditempati oleh spesies yang berbeda dengan interval pengambilan sampel sebelumnya kemungkinan besar merupakan hasil dari peristiwa perebutan antarspesies dan bahwa lokasi sarang yang ditempati oleh spesies yang sama dengan alel yang tidak konsisten dengan menjadi keturunan ratu pada periode pengambilan sampel sebelumnya kemungkinan besar merupakan peristiwa perebutan intraspesies.
Untuk setiap perbandingan interval waktu (2017 vs. 2018, 2018 vs. 2019, dan 2019 vs. 2022), kami membandingkan perubahan dalam genotipe ratu yang disimpulkan dan pasangannya dan menilai sarang sebagai salah satu dari lima kategori:
- Tidak ada perubahan ratu (genotipe ratu dan pasangan cocok dengan sampel sebelumnya di semua lokus);
- Sarang yang diwarisi oleh ratu anak (ratu baru membawa alel paternal dari sampel sebelumnya, ditambah satu dari dua alel ratu sebelumnya, di semua lokus);
- Sarang yang diwarisi oleh ratu cucu perempuan (ratu baru membawa alel paternal dari sampel sebelumnya atau salah satu dari dua alel ratu sebelumnya di semua lokus);
- Perampasan sarang intraspesifik (spesies tidak berubah, tetapi genotipe ratu baru tidak konsisten dengan menjadi anak perempuan atau cucu perempuan dari ratu dan pasangan sebelumnya); dan
- Perampasan sarang antarspesies (spesies telah berubah).
Dengan mempertimbangkan ratu cucu dalam kumpulan data, disarankan bahwa tiga generasi dapat berlalu dalam periode antara interval pengambilan sampel, yang bervariasi untuk setiap interval: 12 bulan (2017–2018), 8 bulan (2018–2019), dan 35 bulan (2019–2022). Waktu minimum yang diperlukan ratu T. carbonaria untuk berubah dari telur menjadi dewasa bertelur adalah sekitar 80 hari (5–6 minggu pra-eclosion, 2–3 minggu pematangan pra-kawin, 1–2 minggu pasca-kawin hingga bertelur; Bueno et al. 2022b ), dan waktu tambahan yang diperlukan telur yang diletakkan ratu baru untuk menjadi pekerja mencari makan di luar sarang yang kemudian kami sampelkan sedikitnya 60 hari (3 minggu perkembangan pra-eclosion, 4–5 minggu di sarang sebagai callow dan perawat; Heard 2016 ). Oleh karena itu, kami meramalkan bahwa satu koloni jarang akan mengganti ratu dua kali dalam jangka waktu 12 bulan atau kurang (artinya, kami akan melihat beberapa ratu cucu perempuan teramati dalam periode pengambilan sampel 2017–2018 dan 2018–2019), tetapi mungkin melakukannya lebih sering dalam jangka waktu 35 bulan (periode 2019–2022 kami).
Demikian pula, lebih dari dua pergantian ratu alami (yaitu, deteksi ratu cicit atau lebih) sangat tidak mungkin terjadi antara dua interval pengambilan sampel pertama kami (2017–2018 dan 2018–2019) tetapi masuk akal untuk interval pengambilan sampel akhir (2019–2022). Karena ratu cicit tidak mudah dibedakan dari non-kerabat berdasarkan delapan lokus mikrosatelit, ada beberapa ambiguitas untuk penugasan hunian sarang dalam interval akhir ini. Secara total, enam sarang memenuhi kriteria untuk Kategori (4) di atas untuk interval 2019–2022, tetapi karena ratu yang disimpulkan pada tahun 2022 memiliki genotipe yang secara masuk akal konsisten dengan menjadi cicit dari ratu yang disimpulkan pada tahun 2019, kami menilai koloni-koloni ini secara konservatif, sebagai hasil dari pergantian ratu alami daripada perebutan kekuasaan intraspesifik.
Pengambilalihan koloni antarspesies dikonfirmasi oleh ID spesies COI, dan semua kasus tersebut juga menunjukkan perubahan genotipe mikrosatelit yang konsisten dengan perubahan spesies, berdasarkan alel privat (Tabel 1 ).
Ratu umur panjang
Kami memperkirakan umur rata-rata ratu Tetragonula dalam populasi ini dengan terlebih dahulu memperkirakan usia rata-rata ratu per koloni sebagai
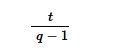
di mana q adalah jumlah ratu yang diperkirakan hidup selama waktu t , periode pengambilan sampel dalam bulan. Perkiraan ini memperhitungkan usia parsial ratu pertama dan terakhir dengan menghitungnya sebagai padanan dari satu ratu karena durasi masa pemerintahan mereka tidak diketahui. Dalam satu koloni T. hockingsi , genotipe pekerja konsisten dengan satu ratu yang memerintah selama periode 5 tahun penuh, dan ratu ini diberi perkiraan usia 5 tahun.
Untuk perhitungan umur ratu, kami mengecualikan periode waktu sebelum interval pengambilan sampel yang mendeteksi peristiwa perebutan kekuasaan atau kematian sarang, artinya, umur ratu hanya dihitung dalam koloni tempat pergantian anak-ratu terjadi terus-menerus.
Perbandingan spesies
Untuk menyelidiki tingkat relatif perampasan dan kematian untuk setiap spesies, kami menggunakan uji pasti Fisher untuk menentukan (i) apakah sarang T. carbonaria lebih mungkin dirampas oleh T. hockingsi (perampasan antar spesies) daripada sebaliknya; (ii) apakah koloni salah satu spesies sama-sama mungkin bertahan hidup dalam periode pengambilan sampel 5 tahun; dan (iii) apakah proporsi keseluruhan setiap spesies di hutan berubah antara periode pengambilan sampel pertama dan terakhir.
Untuk Uji (i), kami menyertakan semua koloni yang ada pada tahun pertama pengambilan sampel (2017) sebagai tambahan terhadap dua koloni yang pertama kali diambil sampelnya pada tahun 2019 (total: 43 koloni T. carbonaria dan 12 koloni T. hockingsi ). Untuk Uji (ii), kami mengamati semua sarang yang musnah selama periode 5 tahun (yaitu, tidak ada koloni yang tersisa di lokasi sarang), mencatat spesies yang menempati sarang sebelum kematian, dan membandingkannya dengan jumlah sarang yang bertahan hidup dari setiap spesies. Oleh karena itu, uji ini hanya mempertimbangkan kematian sarang total dan tidak mencakup kematian koloni melalui perebutan kekuasaan. Uji ini juga mengasumsikan bahwa tidak ada peristiwa perebutan kekuasaan antarspesies yang tidak terdeteksi sebelum kematian koloni, yaitu, bahwa spesies terakhir yang diamati menempati sarang adalah spesies pada saat kematian koloni. Uji terakhir, (iii), membandingkan proporsi T. hockingsi versus T. carbonaria dalam populasi studi selama interval pengambilan sampel pertama (Mei 2017) dengan proporsi yang diamati dalam interval pengambilan sampel terakhir (April 2022). Semua analisis statistik dilakukan di R (v4.2.1), Tim Inti R ( 2021 ).
HASIL
Komposisi spesies, kepadatan sarang dan kematian
Pada saat pengambilan sampel awal (Mei 2017), sekitar tiga perempat dari semua sarang adalah T. carbonaria (77%, n = 41), dan seperempatnya adalah T. hockingsi (23%, n = 12). Sarang masing-masing spesies tersebar di dalam petak hutan (Gambar 2 ). Mengingat ukuran petak yang kami cari, kepadatan sarang Tetragonula setara dengan sekitar 1,5 sarang per hektar, dengan jarak antara sarang dan sarang tetangga terdekatnya berkisar antara 2 hingga 217 m (Gambar 2 ). Termasuk kematian karena perebutan sarang, mortalitas koloni adalah 41% selama periode studi 5 tahun (24 dari 58), memberikan tingkat mortalitas koloni rata-rata 8,3% per tahun.
Perampasan sarang dan kematian berdasarkan spesies
Selama interval studi 5 tahun, delapan koloni T. carbonaria dirampas oleh T. hockingsi (1 antara 2017 dan 2018, 4 antara 2018 dan 2019, dan 3 antara 2019 dan 2022). Sebaliknya, tidak ada contoh T. carbonaria yang merampas T. hockingsi ; Gambar 3 (8 dari 43 koloni T. carbonaria dirampas oleh T. hockingsi vs. 0 dari 12 koloni T. hockingsi yang dirampas oleh T. carbonaria , uji pasti Fisher, p = 0,178).
Sebaliknya, koloni T. hockingsi mati pada tingkat yang jauh lebih tinggi daripada T. carbonaria (10 dari 16 koloni yang mati pada periode pengambilan sampel terakhir telah diidentifikasi sebagai T. hockingsi pada titik pengambilan sampel sebelumnya; uji pasti Fisher: p = 0,003). Kematian total ini mencakup beberapa koloni T. hockingsi yang terbentuk melalui perebutan kekuasaan; dari delapan koloni T. hockingsi yang merebut sarang T. carbonaria , empat telah mati pada titik pengambilan sampel terakhir (Gambar 3 ). Dengan demikian, proporsi keseluruhan setiap spesies di area sampel tidak berubah antara periode pengambilan sampel pertama dan terakhir (proporsi spesies pada pengambilan sampel terakhir tahun 2022: T. carbonaria : 74%, n = 29 dan T. hockingsi 26%, n = 10; uji pasti Fisher: p = 0,8).
Kami tidak dapat mengonfirmasi kasus perebutan kekuasaan intraspesifik di kedua spesies selama periode studi. Untuk T. hockingsi , semua contoh pergantian ratu konsisten dengan ratu anak atau cucu yang mewarisi sarang (Gambar 3 ). Untuk T. carbonaria , tidak ada kasus di mana perebutan kekuasaan intraspesifik dapat ditetapkan dengan jelas, meskipun dalam interval pengambilan sampel terpanjang (2019–2022: 35 bulan), ada enam koloni yang pergantian ratunya tidak konsisten dengan ratu anak maupun ratu cucu. Kami menyimpulkan bahwa ini mungkin merupakan garis keturunan ibu yang sama setelah lebih dari tiga generasi (yaitu, ratu cicit), meskipun mungkin beberapa atau semua sebenarnya merupakan perebutan kekuasaan oleh koloni T. carbonaria lain .
Pergantian ratu dan umur ratu
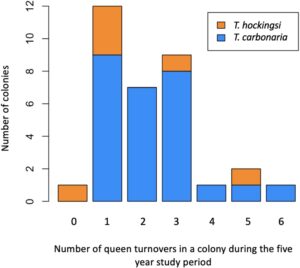
Proporsi koloni yang telah mengganti ratu di antara interval pengambilan sampel (tidak termasuk sarang yang direbut) adalah 40% dalam 12 bulan antara pengambilan sampel pada tahun 2017 dan 2018, 31% pada tahun 2018–2019 (interval 8 bulan) dan 92% pada tahun 2019–2022 (interval 35 bulan); Gambar 3 , Tabel S1 dan S2 . Ini setara dengan, rata-rata, sepertiga dari semua koloni dalam populasi mengganti ratu mereka setiap tahun.
Rata-rata, koloni mengalami 3,2 (±0,2) pergantian ratu selama periode studi lima tahun (median: 3, rentang 1–7; N = 33 koloni; Gambar 4 ). Oleh karena itu, kami memperkirakan rentang hidup rata-rata ratu dalam populasi studi kami sebesar 22 ± 2 bulan (usia rata-rata: 20 bulan, rentang: 8–59 bulan) berdasarkan N = 33 koloni yang tidak mengalami perebutan sarang atau mati ( T. carbonaria : N = 27, T. hockingsi : N = 6).
DISKUSI
Perampasan sarang dan kematian koloni
Studi ini memberikan gambaran singkat tentang perampasan sarang dan kematian koloni pada populasi liar Tetragonula di Queensland tenggara selama periode 5 tahun. Secara umum, riwayat hidup lebah tanpa sengat dicirikan oleh koloni yang berumur panjang, abadi, dan tingkat perkembangbiakan koloni yang rendah (Slaa et al. 2006 ). Memang, koloni lebah tanpa sengat berpotensi abadi, asalkan mereka dapat menghasilkan dinasti garis keturunan ibu yang tidak terputus di mana ratu anak menggantikan ibu mereka untuk mewarisi lokasi sarang (Bueno et al. 2023a ). Dalam penelitian kami, sebagian besar koloni Tetragonula bertahan selama beberapa tahun, tetapi ada tingkat kehilangan koloni yang tetap. Secara keseluruhan, dua perlima koloni dalam penelitian kami telah musnah dalam waktu 5 tahun, termasuk yang menyerah karena perampasan oleh koloni lain. Ini setara dengan kematian koloni tahunan sekitar 8%, yang serupa dengan tingkat yang dilaporkan untuk populasi lebah liar tanpa sengat di daerah tropis Asia (kematian 13,5%–15%, Eltz et al. 2002 ) dan daerah tropis Amerika (kematian 11%, Slaa 2006 ; kematian 7%–13%, Silva, Ramalho, & Rosa 2021 ). Untuk mempertahankan ukuran populasi yang stabil, koloni Tetragonula rata-rata di lokasi studi kami harus berhasil membangun koloni baru sekali setiap 12 tahun (yaitu, 0,08 kawanan yang berhasil/koloni/tahun), atau sekali setiap 10 tahun jika kita mempertimbangkan kematian untuk T. carbonaria saja (0,1 kawanan/koloni/tahun). Dengan kata lain, 1 dari setiap 12 koloni harus berhasil menemukan koloni anak setiap tahun untuk mempertahankan ukuran populasi saat ini. Apakah tingkat pembentukan koloni ini terjadi pada populasi studi kami tidak diketahui, karena kami tidak mencari koloni yang baru didirikan.
Perebutan sarang diyakini sebagai fitur utama ekologi reproduksi Tetragonula Australia , dan peternak lebah T. carbonaria dan T. hockingsi secara teratur mengamati kawanan lebah yang berkelahi yang menyertai upaya perebutan sarang (Cunningham et al. 2014 ; Gloag et al. 2008 ; Lau et al. 2022 ; Stephens, Beekman, & Gloag 2017 ; Wagner & Dollin 1982 ). Studi kami menunjukkan bahwa perebutan sarang juga umum terjadi pada spesies Tetragonula liar dan bahwa 14% dari semua sarang dirampas selama periode studi 5 tahun. Perebutan ini tidak terdistribusi secara merata di antara kedua spesies: kedelapan contoh yang dikonfirmasi melibatkan T. hockingsi yang merebut T. carbonaria . Bias spesies serupa sebelumnya diamati di antara sarang yang dikelola dari wilayah yang sama di Queensland tenggara (Cunningham et al. 2014 ). Dalam penelitian tersebut, mayoritas (41 dari 46 perebutan kekuasaan) yang diamati selama periode 5 tahun di 260 sarang (18% dari semua sarang) melibatkan T. hockingsi sebagai perebutan kekuasaan (Cunningham et al. 2014 ).
Oleh karena itu, pada populasi liar dan populasi yang dikelola, T. hockingsi tampaknya lebih mungkin daripada T. carbonaria untuk berhasil merebut sarang spesies lain. Ini mungkin karena mereka lebih berhasil ketika mereka menjadi koloni penyerang dan/atau lebih mampu mengusir penyerang ketika mereka menjadi koloni yang bertahan. Pekerja T. hockingsi sedikit lebih besar rata-rata daripada pekerja T. carbonaria (masing-masing 4,4–4,7 mm dan 4,1–4,6 mm; Dollin, Dollin, & Sakagami 1997 ), yang mungkin memberi mereka keuntungan selama perang koloni. T. hockingsi mungkin juga lebih baik beradaptasi daripada T. carbonaria untuk bersaing memperebutkan sumber daya yang langka, mengingat habitat yang ditempati oleh kedua spesies tersebut. Jangkauan T. hockingsi meliputi wilayah dataran rendah yang panas dan kering di pesisir Queensland Utara, tempat sumber daya bunga akan lebih sering langka dibandingkan dengan habitat hutan tertutup yang lebih dingin dan basah di New South Wales dan Queensland tenggara, tempat T. carbonaria berada (Dollin, Dollin, & Sakagami 1997 ).
Meskipun demikian, kawanan yang berkelahi juga sering diamati di koloni T. carbonaria yang dikelola , bahkan di bagian jangkauannya di mana T. hockingsi tidak muncul. Oleh karena itu, mengejutkan bahwa tidak ada contoh perebutan intraspesifik dalam populasi T. carbonaria yang dikonfirmasi dalam studi 5 tahun kami. Satu kemungkinan adalah bahwa beberapa perebutan T. carbonaria/T. carbonaria memang terjadi tetapi tidak dapat dideteksi oleh penanda genetik yang kami gunakan. Secara khusus, perubahan ratu selama interval pengambilan sampel terpanjang 35 bulan mencakup enam sarang T. carbonaria yang secara konservatif dinilai sebagai cicit dari ratu sebelumnya (yaitu, tiga suksesi ratu dalam 35 bulan), tetapi beberapa atau semua ini mungkin merupakan perebutan spesies yang sama. Atau, mungkin saja, untuk T. carbonaria , perebutan intraspesifik di lokasi alami benar-benar jarang terjadi. Praktik pemeliharaan lebah yang meluas, seperti pemisahan sarang (di mana koloni diperbanyak dengan cara membelahnya menjadi dua) atau pengelompokan banyak sarang yang berdekatan di tempat pemeliharaan lebah, dapat meningkatkan kecenderungan koloni T. carbonaria yang dikelola untuk mencoba merebut sarang atau menghasilkan kawanan yang bertarung (Gloag et al. 2008 ; Stephens, Beekman, & Gloag 2017 ). Diperlukan penelitian eksperimental lebih lanjut yang membandingkan tingkat perebutan sarang untuk sarang di bawah rezim pengelolaan yang berbeda untuk lebih memahami bagaimana praktik pemeliharaan lebah memengaruhi perilaku perebutan sarang.
Yang penting, kesimpulan yang dibuat tentang tingkat perampasan sarang dalam studi ini didasarkan pada asumsi bahwa Tetragonula di Queensland selatan tidak pernah atau jarang menggunakan kembali lokasi sarang tempat koloni sebelumnya baru saja mati (yaitu, sejak titik pengambilan sampel terakhir). Asumsi ini berasal dari pengamatan kami sendiri tentang kematian koloni dan pengamatan peternak lebah Australia yang berpengalaman yang melaporkan bahwa Tetragonula spp. tidak menggunakan kembali sarang lama kecuali sarang tersebut telah dibersihkan dari bahan sarang yang mati dan rongga kayu alami tetap kosong setelah koloni mati. Sarang yang tidak ditempati dengan cepat mengumpulkan pertumbuhan jamur pada serbuk sari yang tersisa atau anakan yang belum menetas dan dipenuhi oleh hama asli termasuk larva lalat syrphid ( Ceriana ornata ), lalat phorid ( Dohrniphora trigonae ) dan kumbang sarang ( Brachypeplus spp.; (Heard 2016 ). Hama-hama ini mengubah bahan sarang menjadi lumpur berbau tajam yang mungkin sangat tidak menarik bagi lebah. Namun, penggunaan kembali lokasi sarang dapat terjadi dalam skala waktu yang lebih lama, di mana infestasi hama dan dekomposisi sebagian besar bahan sarang telah berjalan dengan sendirinya. Menariknya, sementara re-kolonisasi lokasi sarang tampak langka di Australian Tetragonula , hal itu dilaporkan dari spesies lebah tanpa sengat Neotropis (Slaa 2006 ). Jika perubahan spesies dalam hunian sarang yang diamati dalam kumpulan data kami sebenarnya adalah produk dari re-kolonisasi cepat setelah kematian koloni, daripada perampasan, maka kita dapat menyimpulkan bahwa T. hockingsi lebih cenderung mengalami kolonisasi ulang dibandingkan dengan T. carbonaria .
Prevalensi T. hockingsi di area Brisbane sebelum domestikasi terbaru mereka di sarang lebah tidak terdokumentasikan, tetapi secara anekdot, spesies tersebut telah menjadi lebih umum di sana dalam beberapa dekade terakhir (T. Heard komunikasi pribadi dengan R. Gloag). Keragaman genetik populasi T. hockingsi Brisbane juga konsisten dengan pembentukannya oleh perdagangan sarang yang signifikan dari wilayah di utara (Law et al. 2024 ). Mungkinkah perluasan jangkauan T. hockingsi ke selatan menyebabkan perpindahan T. carbonaria ? Meskipun keberhasilannya lebih tinggi dalam perebutan sarang, kami menemukan bahwa jumlah koloni T. hockingsi tidak meningkat secara proporsional relatif terhadap T. carbonaria dalam periode studi 5 tahun kami. Peningkatan koloni T. hockingsi karena perebutan sarang diimbangi oleh tingkat kematian koloni spesies yang lebih tinggi. Penyebab kematian di koloni dalam studi ini tidak diketahui tetapi mungkin termasuk predasi (Kajobe & Roubik 2006 ), hama atau parasit (Nacko et al. 2020 ), gelombang panas (Nacko et al. 2023 ) dan/atau keterbatasan makanan (Slaa 2006 ). Pada populasi lebah tropis tanpa sengat di Kosta Rika, kematian koloni ditemukan melonjak pada akhir musim hujan ketika ketersediaan makanan paling rendah, menunjukkan bahwa kelaparan dapat menjadi penyebab utama kematian koloni (Slaa 2006 ). Karena Tetragonula spp. adalah lebah yang relatif kecil dengan jangkauan terbang terbatas (500 m; Smith et al. 2017 ), mereka mungkin lebih rentan terhadap fluktuasi pasokan makanan daripada spesies Neotropis berbadan besar (Silva, Ramalho, & Rosa 2021 ). Namun, mengapa T. hockingsi menunjukkan kematian yang lebih tinggi daripada T. carbonaria . Satu kemungkinan adalah bahwa kedua spesies berbeda dalam fisiologi termal mereka (Nacko et al. 2023 ). Suhu minimum mencari makan T. hockingsi adalah sekitar 20°C, dibandingkan dengan 18°C untuk T. carbonaria (Heard 2016 ). Meskipun kecil, perbedaan ini mungkin membatasi total jam mencari makan tahunan yang tersedia untuk setiap spesies di Brisbane, khususnya untuk T. hockingsi di musim dingin pada batas amplop iklim optimal mereka. Tahun-tahun penelitian ini juga mencakup peristiwa El Niño (2018–2019) dan La Niña (2020–2021) di Australia timur yang mungkin telah memberikan stresor yang lebih besar mempengaruhi T. hockingsi: misalnya, 2019 merupakan tahun terpanas dan terkering yang pernah tercatat di Australia dan diikuti oleh curah hujan di atas rata-rata selama periode Agustus 2020–Maret 2021 (Lieber et al. 2023 ). Diperlukan studi lebih lanjut tentang T. carbonaria dan T. hockingsi di wilayah-wilayah tempat rentang mereka tumpang tindih untuk memahami bagaimana distribusi mereka dibentuk oleh persaingan antarspesies.
Pergantian ratu dan umur ratu
Ratu serangga sosial umumnya hidup lebih lama daripada kasta non-reproduksi (Keller & Genoud 1997 ). Berdasarkan perubahan genotipe pada pekerja, kami menemukan bahwa koloni Tetragonula di Hutan Toohey umumnya berganti ratu setiap 20–30 bulan, sehingga rata-rata masa hidup ratu sekitar 1,8 tahun. Satu koloni T. hockingsi disimpulkan telah memelihara ratu yang sama selama periode 5 tahun penuh. Perkiraan untuk rata-rata masa hidup ratu ini secara umum konsisten dengan perkiraan untuk spesies lebah tanpa sengat lainnya, yang berkisar antara 1,5–3 tahun (dengan masa hidup maksimum 3–7 tahun; Grüter 2020 ) dan untuk lebah madu (2–5 tahun; Keller & Genoud 1997 ).
Apa yang menyebabkan kematian ratu? Upaya perampas sarang dapat berhasil membunuh ratu, bahkan jika upaya pengambilalihan akhirnya gagal. Kemungkinan besar, ratu yang menua dapat dibunuh oleh pekerja mereka sendiri karena produksi telur menurun atau mereka bertelur dalam proporsi yang semakin besar (yaitu, haploid, tidak dibuahi) karena kekurangan sperma. Pembunuhan raja oleh pekerja tersebut telah didokumentasikan pada lebah tanpa sengat Neotropis Scaptotrigona postica di mana ratu telah melakukan perkawinan sedarah dan dengan demikian menghasilkan jantan diploid (Vollet-Neto, Imperatriz-Fonseca, & Ratnieks 2019 ). Pada beberapa lebah tanpa sengat Neotropis, ratu muda yang tidak kawin juga berpartisipasi dalam memicu penggantian ratu (Imperatriz-Fonseca & Zucchi 1995 ). Dalam studi sebelumnya, koloni T. hockingsi dipindahkan ke luar jangkauannya sehingga mereka tidak memiliki kerabat terdekat untuk menyediakan pasangan, yang mengakibatkan 50% koloni memiliki ratu yang telah kawin dengan saudara-saudaranya dan 50% gagal untuk mengganti ratu (Paul et al. 2023 ). Mengingat bahwa kami berharap rata-rata 50% perkawinan saudara akan menghasilkan ratu yang menghasilkan proporsi jantan diploid yang tinggi (Hagan & Gloag 2021 ) sementara 50% lainnya tidak akan memiliki kelebihan jantan diploid, hasil ini konsisten dengan pekerja T. hockingsi yang juga membunuh ratu yang menghasilkan jantan diploid (Paul et al. 2023 ). Namun, penyebab umum kematian ratu lebah tanpa sengat yang kawin dengan baik masih kurang dipahami dan sangat sulit untuk diamati. Dalam kasus ini, pengamatan perilaku koloni sarang diperlukan untuk menjelaskan bagaimana dan mengapa pergantian ratu dimulai (misalnya, Bueno et al. 2022b ).
Kami telah memberikan estimasi pertama dari tingkat kematian koloni, pergantian ratu dan perampasan sarang untuk populasi liar T. carbonaria dan T. hockingsi . Data serupa dari populasi liar lain dari Australian Tetragonula di seluruh jangkauan mereka akan membantu untuk membangun gambaran yang lebih lengkap dari ekologi reproduksi mereka. Selain itu, ketahanan populasi dan dinamika komunitas lebah sosial ditentukan oleh tidak hanya kematian koloni tetapi juga kesuburan setiap spesies. Dalam studi saat ini, kami hanya berfokus pada pemantauan sarang yang diidentifikasi pada tahun pengambilan sampel pertama dan tidak secara sistematis mencari sarang yang baru didirikan setiap tahun. Kami merekomendasikan bahwa studi masa depan populasi liar bertujuan untuk menggabungkan estimasi tingkat khas pengerumunan reproduksi dan faktor-faktor yang mempengaruhi kelangsungan hidup sarang yang baru didirikan, untuk lebih memajukan pemahaman kita tentang spesies ini.




Tinggalkan Balasan