Abstrak
Badai debu adalah fenomena atmosfer yang berulang di wilayah kering dan semikering yang menurunkan kualitas udara dan menimbulkan risiko kesehatan yang signifikan. Namun, masih belum ada konsensus tentang mengapa beberapa badai debu lebih beracun daripada yang lain. Untuk memahami pengaruh debu pada ukuran dan komposisi partikel, percobaan in vitro dilakukan untuk mengevaluasi dampak dari lima mineral lempung yang berbeda: montmorillonit (montmorillonit, montmorillonit kaya Na, dan montmorillonit kaya Ca), illite, dan kaolinit pada sel-sel alveolar epitel manusia (A549) dengan menggunakan Analisis Sel Tunggal. Tidak seperti teknik populasi lainnya, analisis ini memantau setiap sel secara individual dengan menggabungkan mikroskopi fluoresensi dengan sistem inkubasi untuk terus menerus mencitrakan sel setiap 15 menit selama 48 jam. Analisis pencitraan sel hidup ini digunakan untuk menghitung waktu kematian yang tepat, laju pembelahan, dan jenis kematian (apoptosis dan nekrosis). Montmorillonit dan Kaolinit yang kaya Ca masing-masing adalah lempung yang paling dan paling tidak beracun. Meskipun Montmorillonite yang kaya kalsium menyebabkan peningkatan signifikan dalam kematian sel dan penurunan proliferasi sel dibandingkan dengan Kaolinite, kedua lempung tersebut memiliki dampak yang sama pada jenis kematian (nekrosis menggantikan apoptosis sebagai mekanisme utama kematian sel). Pengamatan pada waktu kematian yang tepat menunjukkan peningkatan yang signifikan dalam tingkat kematian antara 34 dan 48 jam pasca paparan yang menunjukkan kemungkinan penundaan dalam dampak kesehatan.
Poin-poin Utama
- Mineral lempung yang berbeda memiliki dampak yang berbeda terhadap kematian sel dan pembelahan sel
- Baik mineral lempung Montmorillonite dan Kaolinite yang kaya kalsium menunjukkan peningkatan nekrosis seiring dengan peningkatan konsentrasi partikel.
- Komposisi unsur dan keberadaan logam berat dalam mineral lempung berhubungan dengan kematian sel
Ringkasan Bahasa Sederhana
Menghirup partikel badai debu menimbulkan risiko serius bagi kesehatan manusia. Memaparkan sel ke partikel di laboratorium (in vitro) merupakan metode umum untuk mengukur dampak partikel debu. Studi ini mengevaluasi toksisitas lima mineral lempung, yang umum terjadi selama badai debu, pada sel paru-paru manusia menggunakan Analisis Sel Tunggal, sebuah teknik yang memungkinkan pemantauan berkelanjutan terhadap sel-sel individual dari waktu ke waktu. Analisis Sel Tunggal memungkinkan pencatatan waktu kematian yang tepat, jenis kematian sel, dan laju pembelahan sel. Hasil penelitian menunjukkan bahwa tidak semua mineral lempung memiliki dampak yang sama pada sel. Montmorillonit yang kaya kalsium merupakan yang paling beracun, sedangkan Kaolinit merupakan yang paling tidak beracun. Kedua lempung menunjukkan bahwa apoptosis (jenis kematian sel terprogram) digantikan oleh nekrosis (jenis kematian sel yang cepat dan hebat) seiring dengan peningkatan konsentrasi partikel. Komposisi unsur dan keberadaan logam berat memengaruhi toksisitas lempung. Penurunan kematian sel pada konsentrasi partikel yang tinggi, ditambah dengan penurunan pembelahan sel, menunjukkan bahwa beberapa lempung menyebabkan sel-sel mengalami penghentian. Peningkatan signifikan dalam kematian sel diamati setelah 34 jam paparan, sesuai dengan keterlambatan peningkatan permintaan rawat inap yang ditemukan dalam studi epidemiologi.
1 Pendahuluan
Organisasi Kesehatan Dunia memperkirakan bahwa sekitar 4,2 juta kematian setiap tahunnya terkait dengan kualitas udara yang buruk (WHO, 2020 ). Partikel debu mewakili hingga 40% dari konsentrasi partikel di atmosfer (WMO, 2021 ), terutama karena badai debu, fenomena meteorologi, di wilayah kering dan semi-kering, di mana partikel debu terangkat ke udara dan diangkut oleh angin kencang (Brahney et al., 2024 ). Selama peristiwa ini, partikel debu, terutama PM 2.5 dan PM 10 (partikel materi dengan diameter <2,5 dan 10 μm, masing-masing) akan meningkat (Ardon-Dryer & Aziz, 2025 ; Ardon-Dryer & Kelley, 2022 ; Ardon-Dryer et al., 2022 , 2023 ). Partikel debu selama badai debu ini dapat tetap melayang di udara selama beberapa jam atau hari dan terbawa hingga jarak yang jauh (Fairlie et al., 2007 ; Goudie & Middleton, 2006 ; Robinson & Ardon-Dryer, 2024 ; Sandhu et al., 2024 ). Sekitar 330 juta orang terpapar partikel debu setiap tahun (UNCCD, 2022 ). Badai debu telah dikaitkan dengan eksaserbasi penyakit pernapasan dan tingkat kematian (Aghababaeian et al., 2021 ; Ali et al., 2023 ; Tobias et al., 2019 ). Studi menunjukkan bahwa badai debu dapat menjadi lebih umum karena perubahan iklim dan penggurunan (Achakulwisut et al., 2018 ; Brey et al., 2020 ; Tong et al., 2017 ; UNCCD, 2022 ).
Mineral lempung merupakan komposisi utama (∼80%) dari banyak gurun di seluruh dunia (Holzapfel, 2008 ); oleh karena itu, mereka berkontribusi secara substansial terhadap komposisi partikel aerosol selama peristiwa debu. Mineral lempung terbentuk oleh lembaran dua dimensi tetrahedron silika dan oktahedron aluminium, dengan ion anorganik yang berbeda seperti Mg + , Na + , dan Ca 2+ di ruang interlayer (Massaro et al., 2020 ; Valapa et al., 2017 ). Ilit, kaolinit, dan montmorillonit adalah jenis lempung yang paling melimpah yang ditemukan selama peristiwa debu (Engelbrecht et al., 2009 , 2016 ; Marsden et al., 2019 ). Namun, setiap peristiwa debu mengandung konsentrasi lempung yang berbeda-beda tergantung pada lokasi sumber debu (Goudie & Middleton, 2006 ). Misalnya, Afrika utara dicirikan oleh kandungan karbonat, palygorskite, dan illite yang tinggi; namun, kaolinite menjadi dominan ke arah Khatulistiwa sementara kandungan illite memudar (Alastuey et al., 2005 ; Caquineau et al., 1998 , 2002 ; Chester et al., 1972 ). Di AS, lapisan tanah atas Texas Barat dicirikan oleh 25% kaolinite, 35% illite, dan 15% montmorillonite; ke arah AS bagian tengah, proporsi illite menurun sementara proporsi montmorillonite meningkat. Sebaliknya, di wilayah barat daya AS, illite dan montmorillonite masing-masing berada di antara 20% dan 30%, tetapi kaolinite (hanya 5%) digantikan oleh kuarsa (15%) (Bockheim & Hartemink, 2013 ; Ito & Wagai, 2017 ; Sionneau et al., 2008 ).
Tergantung pada ukurannya, partikel debu dapat menembus berbagai bagian sistem pernapasan. Partikel yang lebih besar dari 10 μm tetap berada di saluran pernapasan bagian atas, memengaruhi mata, hidung, dan tenggorokan, serta menyebabkan batuk, mengi, dan iritasi mukosa (CDC, 2019 ; Kang et al., 2012 ). Partikel kasar toraks (PM 10–2,5 ) dapat mencapai trakea dan bronkus utama (US EPA, 2019 ), sementara partikel halus (PM 2,5 ) dapat menembus lebih dalam ke sistem pernapasan, mencapai bronkiolus dan alveoli, dan memperburuk kondisi yang sudah ada sebelumnya seperti asma, penyakit paru obstruktif kronik (PPOK), dan pneumonia (De Longueville et al., 2013 ; Nakao et al., 2018 ). Orang lanjut usia, anak-anak, dan mereka yang memiliki kondisi yang sudah ada sebelumnya (misalnya, penyakit kardiovaskular kronis) sering kali lebih rentan terhadap partikel ini. Berbagai penelitian melaporkan peningkatan kunjungan ruang gawat darurat setelah kejadian debu akibat asma (Chien et al., 2012 ), konjungtivitis (Aghababaeian et al., 2021 ), pneumonia (Kang et al., 2012 ), PPOK, komplikasi serebrovaskular, dan kardiovaskular (Chan et al., 2008 ; Crooks et al., 2016 ; Kashima et al., 2017 ). Peningkatan ini diamati pada hari terjadinya badai debu (Middleton et al., 2008 ), 24 jam setelahnya (C. Chen et al., 2024 ), atau hingga 3 hari pasca badai debu (Crooks et al., 2016 ). Paparan partikel debu selama badai debu selama kehamilan dilaporkan telah mengurangi jumlah minggu gestasi dan berat lahir bayi (Altindag et al., 2017 ). Studi tambahan juga melaporkan peningkatan mortalitas harian selama hari-hari berdebu untuk pasien rawat inap dengan kondisi yang sudah ada sebelumnya (Johnston et al., 2011 ; Mallone et al., 2011 ; Perez et al., 2008 ), dan yang lain menemukan kejadian debu menyebabkan kematian langsung non-kecelakaan (Achilleos et al., 2019 ; Chan & Ng, 2011 ). Bahkan dengan temuan ini, masih ada perbedaan mengenai dampak partikel debu pada kesehatan manusia karena beberapa studi menemukan korelasi positif antara kejadian debu dan penurunan kesehatan (Aghababaeian et al., 2021 ; Maisanaba et al., 2015 ) sementara yang lain tidak menemukan dampak debu pada kesehatan (Menendez et al., 2017 ; Nakamura et al., 2015 ; Schwartz, 1999 ).
Bahasa Indonesia: Metode umum yang memungkinkan pemeriksaan dampak partikel (termasuk partikel debu) pada kesehatan manusia adalah metode in vitro. Metode ini mengevaluasi dampak partikel debu pada berbagai jenis sel paru-paru. Berbagai sampel debu telah digunakan dalam berbagai penelitian, termasuk sampel tanah gurun (Pardo et al., 2017 ; Veranth et al., 2008 ), partikel udara yang dikumpulkan selama peristiwa debu (J. Chang et al., 2016 ; Higashisaka et al., 2014 ; Naimabadi et al., 2016 ), dan partikel mineral standar termasuk silika murni (SiO 2 ), kalsit (CaCO 3 ) atau berbagai mineral lempung seperti montmorillonit dan kaolinit (Becker et al., 2002 ; Veranth et al., 2008 ; Zeng et al., 2016 ). Sebagian besar penelitian in vitro menggunakan metode populasi sel, yang mengukur dampak pada titik waktu tunggal dan spesifik menggunakan ribuan atau jutaan sel. Dengan menggunakan metode populasi sel, penelitian menunjukkan bahwa paparan partikel debu dapat mengurangi viabilitas sel (J. Chang et al., 2016 ; Pardo et al., 2017 ; Rodriguez-Cotto et al., 2013 ), dan menyebabkan berbagai mekanisme kematian sel seperti apoptosis dan nekrosis (Ardon-Dryer et al., 2020 ; Jordan et al., 2009 ). Kematian apoptosis adalah jenis kematian terprogram yang lambat yang melibatkan pemadatan materi DNA menjadi badan apoptosis dan penyusutan sitoplasma (Edinger & Thompson, 2004 ; Elmore, 2007 ; Pucci et al., 2000 ), sementara kematian Nekrosis dianggap sebagai kematian spontan yang terjadi lebih cepat sebagai respons terhadap cedera sel, di mana membran pecah dan melepaskan materi sel ke dalam medium (Krysko et al., 2008 ; Nikoletopoulou et al., 2013 ), yang dapat menyebabkan peradangan dalam tubuh (Duprez et al., 2009 ). Dalam beberapa kasus, kerusakan DNA telah diamati setelah paparan partikel debu (Zeng et al., 2016 ). Paparan partikel debu juga menyebabkan pelepasan sitokin inflamasi, termasuk IL-6, IL-8, dan LDH (Goudarzi et al., 2019 ; Higashisaka et al., 2014 ; Naimabadi et al., 2016 ), dan dalam jangka panjang juga ditemukan menyebabkan kerusakan kronis pada jaringan paru-paru (Reiser & Last, 1986 ).
Akan tetapi, mekanisme yang menyebabkan partikel debu menimbulkan efek ini masih belum jelas. Terdapat perbedaan dalam efek ukuran partikel; sementara beberapa penelitian menunjukkan bahwa partikel debu yang lebih kecil lebih beracun (Goudarzi et al., 2019 ; Higashisaka et al., 2014 ; Rong et al., 2013 ), penelitian lain menemukan partikel yang lebih besar lebih beracun (Jalava et al., 2015 ; Jordan et al., 2009 ). Penelitian tambahan menentukan tidak ada perbedaan toksisitas di antara ukuran partikel debu yang berbeda (Becker et al., 2002 ; Rodriguez-Cotto et al., 2013 ). Terdapat pula perbedaan dalam efek asal partikel debu, beberapa penelitian menemukan bahwa dampak pada respons peradangan dan kematian sel bervariasi ketika partikel diambil sampelnya dari peristiwa debu yang sama di dua lokasi berbeda (Rodriguez-Cotto et al., 2013 ) atau lokasi yang sama tetapi selama peristiwa debu yang berbeda (Naimabadi et al., 2016 ). Selain itu, berbagai jenis tanah liat sering kali tercampur dalam peristiwa debu yang sama, dan tidak jelas apakah semua tanah liat menghasilkan toksisitas yang sama.
Mayoritas penelitian sebelumnya yang menggunakan metode populasi sel menguji dampak partikel debu pada sel pada satu atau dua titik waktu (biasanya 6, 24, atau 48 jam), dan evaluasinya didasarkan pada respons populasi sel besar (Higashisaka et al., 2014 ; Molavinia et al., 2024 ; Zeng et al., 2016 ). Metode populasi sel ini tidak memungkinkan pengamatan interaksi partikel-sel atau identifikasi waktu kematian yang tepat. Penelitian ini bertujuan untuk meningkatkan pemahaman kita tentang mekanisme yang menyebabkan kematian sel melalui pengamatan dampak partikel tanah liat pada kematian dan pembelahan sel menggunakan metode Sel Tunggal, yang memungkinkan pemantauan berkelanjutan sel-sel individual selama 48 jam. Merekam waktu dan jenis kematian sel yang tepat, serta menilai dampak mineral tanah liat pada pembelahan sel, akan memberikan wawasan tentang efek waktu nyata partikel debu pada sel-sel yang sebelumnya ditutupi oleh metode populasi sel.
2 Bahan dan Metode
2.1 Sampel Tanah Liat
Lima partikel mineral lempung berbeda yang dibeli dari Clay Mineral Society (The Clay Mineral Society, 2025 ) digunakan dalam studi ini: tiga jenis montmorillonit: Montmorillonit kaya Na (SWy-3, NaM selanjutnya), Montmorillonit kaya Ca (SAZ-2, CaM selanjutnya), dan Montmorillonit (STx-1b, Mont selanjutnya), satu jenis Kaolinit (KGa-1b), dan satu jenis Ilit (IMt-2). Lokasi pengambilan sampel, luas permukaan, potensi Zeta (ZP), dan komposisi kimia disediakan di situs web Clay Mineral Society (The Clay Mineral Society, 2025 ), yang disajikan dalam Tabel S1 di Informasi Pendukung S1 . Setelah pembelian, setiap sampel lempung dikeringkan dan digiling selama 3 menit, menggunakan kotak pecahan Mill dengan pecahan Tungsten-Karbida untuk mengurangi ukuran partikel guna mewakili fraksi debu yang dapat dihirup. Setelah digiling, sampel disimpan dalam wadah kaca tertutup untuk percobaan selanjutnya. Perlu dicatat bahwa proses penggilingan meningkatkan konsentrasi partikel yang lebih kecil seperti yang diharapkan (data tidak ditampilkan).
2.1.1 Mengukur Distribusi Ukuran Sampel Tanah Liat
Sistem laboratorium set-up yang meniru proses pembangkitan debu (saltasi) digunakan untuk memeriksa distribusi ukuran partikel dari setiap sampel lempung (Gambar S1 dalam Informasi Pendukung S1 ). Sampel dari setiap lempung (0,5 g) ditempatkan dengan manik-manik perunggu (9,0 g manik-manik perunggu TSI berukuran 100 μm) dalam unit PRIZE (Generator debu PRinted FluidIZed bed gEnerator-3D; Roesch et al., 2017 ). Partikel lempung disuspensikan menggunakan nitrogen kering yang dikontrol oleh flowmeter dengan laju alir 5,5 LPM. Partikel yang disuspensikan dilewatkan ke dalam ruang pencampuran kaca (2.000 mL) dan membagi aliran menjadi dua menggunakan splitter Brechtel Y. Bagian dari aliran (1,2 LPM) dihubungkan ke spektrometer aerosol portabel GRIMM 11-D (Grimm Aerosol Technik GmbH & Co. KG, Jerman) yang mengukur distribusi ukuran partikel dalam rentang ukuran 0,27–35 μm setiap menit, bagian aliran lainnya dibuang ke dalam sungkup. Semua sampel debu diperiksa selama total 30 menit, dan distribusi ukuran setiap sampel dihitung. Pengukuran untuk setiap sampel juga mencakup konsentrasi partikel total (0,25–35 μm), konsentrasi PM 2,5 , dan PM 10 yang diukur menggunakan GRIMM-11D selama pengukuran distribusi ukuran selama 30 menit.
2.1.2 Keberadaan Logam Berat dalam Sampel Tanah Liat
Pemeriksaan keberadaan logam berat vanadium (V), kromium (Cr), mangan (Mn), besi (Fe), kobalt (Co), nikel (Ni), tembaga (Cu), seng (Zn), arsenik (As), selenium (Se), strontium (Sr), kadmium (Cd), cesium (Cs), thallium (Tl), timbal (Pb), dan uranium (U) dilakukan dengan menggunakan pencernaan asam gelombang mikro (MARS6, CEM, NC, AS), diikuti oleh spektrometri massa plasma yang digabungkan secara induktif (7900 ICPMS; Agilent Technologies, Santa Clara, CA, AS). Massa 0,2 g dari setiap sampel tanah liat dicerna semalam dalam 5 mL asam nitrat 69% (HNO 3 , kelas Trace Metal, Fisher Chemical, ON, Kanada), diikuti dengan penambahan 2 mL hidrogen peroksida (30%, kelas Optima, Sigma Aldrich, MO, AS) dan didiamkan selama 30 menit, dan kemudian dicerna dalam microwave selama 15 menit pada 180 ° C. Sampel yang dicerna dipindahkan ke tabung sentrifus 50 mL, diisi hingga 50 mL dengan asam nitrat 1% (kelas trace metal, Fisher Scientific) dan ditimbang, kemudian disentrifugasi (5 menit, 3.000 rpm; Sorvall LegendX1R, Thermo Science, MA, AS) dan disaring dengan jarum suntik (0,45 μm, nilon, VWR, PA, AS) untuk mendapatkan supernatan. Untuk tetap berada dalam rentang kalibrasi untuk analisis ICPMS, supernatan diencerkan dengan faktor 10 dan 1.000 dalam air ultramurni (<18 MΩ * cm, Thermo Fisher GenPurePro, MA, AS). Semua sampel dianalisis dalam rangkap tiga. QA/QC mencakup kalibrasi menggunakan standar kalibrasi multi-elemen (Agilent Technologies, Santa Clara, CA, AS) dalam rentang 0–500 ppb, pemeriksaan kalibrasi berkelanjutan dan blanko, yang dianalisis setiap 12 sampel, dan larutan 10 ppb indium (In) ditambah 10 ppb rhodium (Rh) sebagai standar internal untuk koreksi efek matriks. Analisis Mn, Fe, Se, dan Cd dilakukan dalam mode hidrogen; analisis V, Cr, Ni, Cu, dan As dilakukan dalam mode helium; dan analisis Co, Zn, Sr, Cs, Tl, Pb, dan U dilakukan dalam mode Tanpa Gas. Batas deteksi adalah titik kalibrasi bukan nol terendah pada kurva, yaitu 0,5 ppb.
2.1.3 Pencitraan Sampel Tanah Liat Menggunakan Mikroskop Elektron Pemindaian (SEM)
Gambar SEM diambil dari setiap sampel menggunakan mikroskop Zeiss Crossbeam 540 FIB-SEM. Semua gambar diambil pada tegangan percepatan 3–5 kV dan dengan perbesaran 11,00. Sampel disiapkan dengan menempelkan sejumlah kecil bubuk tanah liat ke pita karbon dua sisi, yang ditempatkan pada dudukan sampel. Sampel kemudian dilapisi dengan lapisan Iridium setebal 4 nm untuk meningkatkan konduktivitas sampel sebelum menempatkan sampel ke dalam SEM.
2.2 Kultur Sel
Sel kanker epitel paru-paru manusia (A549) diberikan ke lab kami dari lab Lahav di Harvard Medical School. Sel-sel tersebut ditumbuhkan dalam RPMI-1640 yang dilengkapi dengan 10% FBS, 2% L-glutamin, dan 1% penisilin/streptomisin dan dipertahankan pada suhu 37°C dengan 5% CO 2 . Sel-sel tersebut mengandung penanda nuklir fluoresensi konstitutif yang terlihat dalam Cyan Fluorescent Protein (CFP, Puncak eksitasi: 405 nm; Puncak emisi: 485 nm), yang memungkinkan pelacakan sel-sel individual dan pembedaan antara sel-sel dan partikel debu. Sel epitel paru-paru manusia (A549) dipilih untuk penelitian ini karena lini sel ini telah banyak digunakan dalam banyak penelitian paru-paru, terutama yang meneliti dampak partikel aerosol terhadap kesehatan manusia menggunakan in vitro (JHM Chang et al., 2024 ; Eychenne et al., 2022 ; Goudarzi et al., 2019 ; Jordan et al., 2009 ; Naimabadi et al., 2016 ; Tomašek et al., 2025 ; Veranth et al., 2008 ; Zeng et al., 2016 ). Garis sel ini telah ditemukan menjadi pengganti yang cocok untuk sel primer atau sel induk epitel alveolar (Fernando et al., 2019 ) karena dapat meniru fungsi utama sel alveolar primer tipe II (Chary et al., 2022 ; Cooper et al., 2016 ; Shapiro et al., 1978 ).
2.2.1 Pencitraan dan Pelacakan Sel Tunggal
Untuk analisis sel tunggal, ∼30.000 sel ditanam dalam cawan kaca berlapis poli-D-lisin 2 mL (MatTek) 48 jam sebelum pencitraan. Sel ditempatkan dalam dudukan logam universal Tokai enam sumur di dalam mikroskop terbalik Nikon Ti2 Eclipse, yang telah memasang inkubator Tokai Thermo Box model STGX yang digunakan untuk menjaga sel pada suhu 37°C dan 5% CO2 selama durasi percobaan. Sepuluh posisi dipilih secara acak di setiap cawan (konsentrasi paparan) dan gambar diambil setiap 15 menit dalam Fase 2 dan CFP. Tiga jam setelah pencitraan dimulai, media diganti dengan pengenceran debu yang disiapkan dalam media. Percobaan dilakukan selama rata-rata 51 jam. Analisis Data dilakukan hanya untuk 48 jam pertama paparan partikel tanah liat. Setiap percobaan memiliki enam konsentrasi paparan partikel lempung (dosis) yang berbeda: kontrol (tanpa partikel), 25, 50, 100, 250, dan 500 μg mL −1 . Konsentrasi dibuat dengan menambahkan konsentrasi massa yang diketahui ke media segar setelah serangkaian pengenceran. Tabung lempung dengan media segar kemudian dicampur dan dikocok untuk memecah agregat partikel sebanyak mungkin sebelum ditambahkan ke sel. Setiap percobaan dilakukan secara duplikasi.
Gambar dianalisis menggunakan kode MATLAB sumber terbuka (Reyes et al., 2019 ), yang secara semi-otomatis mengidentifikasi setiap centroid sel tunggal menggunakan intensitas protein fluoresensi nuklir dan karakteristik bentuk. Hanya sel yang diamati dari awal percobaan hingga akhir yang dilacak, yaitu, sel yang memasuki gambar pasca-paparan partikel atau keluar dari gambar selama percobaan tidak dipertimbangkan. Dalam setiap konsentrasi paparan, rata-rata 425 ± 31 sel tunggal acak (untuk semua pengulangan biologis) dipilih secara acak dan dilacak selama 48 jam pasca-paparan (total 192 gambar). Pengamatan morfologi nukleus dilakukan menggunakan penanda nuklir fluoresensi, yang memungkinkan identifikasi kematian meskipun konsentrasi debu tinggi. Informasi tambahan tentang metode dan analisis sel tunggal dapat ditemukan di Ardon-Dryer et al .
2.2.2 Mengidentifikasi Jenis Kematian Sel
Klasifikasi tipe kematian sel (apoptosis atau nekrosis) didasarkan pada morfologi sel saat mati, seperti yang dijelaskan dalam literatur (Edinger & Thompson, 2004 ; Fink & Cookson, 2005 ; Krysko et al., 2008 ). Kematian sel diidentifikasi dengan mengamati perubahan CFP pada bentuk dan intensitas nukleus dan kemudian dikuatkan dengan mengamati perubahan Fase 2 membran sel dan sitoplasma. Secara umum, sel apoptosis dicirikan oleh penyusutan nukleus dan sitoplasma, diikuti oleh disintegrasinya menjadi fragmen kecil badan apoptosis yang terikat membran (Edinger & Thompson, 2004 ; Elmore, 2007 ; Pucci et al., 2000 ). Di sisi lain, nekrosis diidentifikasi oleh pecahnya membran, ledakan, dan pelepasan komponen intraseluler ke lingkungan sekitar (Krysko et al., 2008 ; Nikoletopoulou et al., 2013 ). Contoh dari dua mekanisme kematian sel di kedua saluran dapat ditemukan dalam film di Supplemental Video oleh Ardon-Dryer et al. ( 2020 ).
2.3 Analisis Statistik
Persentase kematian sel dibandingkan antara konsentrasi paparan dan jenis partikel tanah liat menggunakan uji ANOVA satu arah. Kelompok dianggap berbeda secara signifikan secara statistik jika nilai p <0,001. Regresi dianggap lemah jika nilai R 2 <0,5, kuat jika nilai R 2 ≥0,5, dan sangat kuat jika nilai R 2 >0,8.
3 Hasil dan Pembahasan
3.1 Karakterisasi Lempung: Distribusi Ukuran, Morfologi, Komposisi Kimia, dan Keberadaan Logam Berat
Distribusi ukuran setiap sampel lempung dihitung dan dibandingkan (Gambar 1 ). Kebanyakan lempung menunjukkan modus 0,4 μm, kecuali CaM yang menunjukkan modus 2,3 μm. Untuk rentang ukuran 0,3 hingga 0,6 μm, NaM dan CaM menunjukkan konsentrasi partikel yang lebih rendah dibandingkan sampel lempung lainnya ( nilai- p < 0,05), sementara Mont dan Illite menunjukkan konsentrasi partikel yang lebih tinggi pada rentang ukuran ini dibandingkan sampel lempung lainnya ( nilai- p < 0,05). Tidak ada perbedaan statistik antara lempung dalam konsentrasi partikel dengan ukuran 0,62 hingga 3,23 μm ( nilai- p > 0,08). Untuk rentang ukuran 3,23 hingga 7,36 μm, Mont dan Illite menunjukkan konsentrasi partikel yang lebih tinggi daripada NaM ( nilai- p < 0,05), tetapi tidak ada perbedaan statistik dengan lempung lainnya. Tidak ditemukan perbedaan konsentrasi partikel antara partikel lempung >7,36 μm ( nilai- p > 0,06). Penelitian sebelumnya yang menggunakan tiga jenis Montmorillonit yang sama (NaM, CaM, dan Mont) menemukan ukuran partikel yang serupa (Gormley & Addison, 1983 ). Distribusi ukuran partikel yang serupa juga ditemukan oleh Tan et al. ( 2017 ), yang menggunakan jenis lempung Kaolinit dan Illite yang sama. Perbandingan juga dilakukan berdasarkan konsentrasi partikel total (0,25–35 μm), PM 2,5, dan PM 10 untuk setiap sampel. Illite memiliki konsentrasi partikel total yang serupa (dan tidak signifikan nilai- p > 0,05) seperti Mont, tetapi konsentrasi PM 2,5 dan PM 10 lebih tinggi dan signifikan ( nilai- p < 0,05) dibandingkan dengan Mont, dan konsentrasi partikel total yang lebih tinggi dibandingkan dengan sampel lainnya. Kaolinit memiliki konsentrasi PM 2,5 , PM 10 , dan konsentrasi partikel total yang serupa dengan NaM CaM, dan Mont. NaM dan CaM juga memiliki konsentrasi PM 2,5 , PM 10 , dan konsentrasi partikel total yang serupa. CaM memiliki konsentrasi PM 2,5 , dan PM 10 yang serupa dengan Mont tetapi konsentrasi partikel total lebih rendah daripada Mont. Perlu dicatat bahwa konsentrasi PM 2,5 , PM 10 , dan partikel total ini tidak mewakili konsentrasi yang terpapar pada sel, karena paparan sel didasarkan pada massa yang diencerkan dalam jumlah cairan yang diketahui. Gambar SEM dari masing-masing sampel lempung (Gambar S2 dalam Informasi Pendukung S1)) menunjukkan struktur, ukuran, dan morfologi partikel, di mana partikel menunjukkan struktur berlapis-lapis dengan permukaan kasar. Ketiga jenis lempung Montmorillonite (NaM, CaM, dan Mont) memiliki tekstur selular seperti serpihan jagung yang merupakan representasi dari montmorillonite. Illite menunjukkan tepi bergerigi, melengkung, dan kristal pipih yang relatif besar dan datar, khas Illite, sementara Kaolinite menunjukkan morfologi pseudo-heksagonal dengan lempengan bertumpuk (Keller et al., 1986 ; Makó et al., 2020 ).
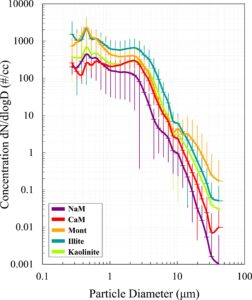
Komposisi kimia dari setiap lempung disediakan oleh Clay Mineral Society seperti yang ditunjukkan pada Gambar 2a . Informasi lengkap disediakan pada Tabel S1 di Informasi Pendukung S1 . Komposisi utama sampel dalam kelompok montmorillonit adalah Si 2 O (60,4%–70,1%) diikuti oleh Al 2 O 3 (16%–19,6%). NaM memiliki persentase Na 2 O yang lebih tinggi dan CaM memiliki persentase CaO yang lebih tinggi dibandingkan dengan montmorillonit lainnya. Illite dicirikan oleh persentase Si 2 O yang lebih rendah (49,3%) dibandingkan dengan kelompok montmorillonit. Hal ini disebabkan oleh kalium (K) di antara lapisannya, yang mewakili 7,83% dari total komposisi lempung. Sampel Illite juga kaya akan zat besi, terutama dalam bentuk Fe 2 O 3 (7,32%). Kaolinit memiliki konsentrasi Si 2 O (44,5%), Fe 2 O 3 , FeO, CaO, dan MgO terendah tetapi konsentrasi Al 2 O 3 (39,7%) tertinggi dibandingkan dengan lempung lainnya. Kaolinit memiliki kadar air tertinggi (12,6%), sementara Illite memiliki bahan organik tertinggi (8,02%) dibandingkan dengan sampel lempung lainnya. Komposisi kimia yang serupa ditemukan untuk sampel lempung ini oleh penelitian lain (Hower & Mowatt, 1966 ; Marsh et al., 2018 ; Mermut & Cano, 2001 ). Pengamatan pada setiap Lembar Data Keselamatan (SDS) lempung, yang ditemukan di situs web Clay Mineral Society (The Clay Mineral Society, 2025 ), menunjukkan perbedaan dalam komposisi kuarsa. Kaolinit dan CaM mengandung 1%–2% kuarsa, Mont memiliki >1% hingga <5% kuarsa, NaM memiliki 5%–10% kuarsa, dan Illite mengandung 10%–15% kuarsa.

Konsentrasi logam berat bervariasi secara signifikan antara sampel lempung (Gambar 2b ). CaM memiliki konsentrasi Mn, Sr, dan Cd yang lebih tinggi daripada lempung lainnya ( nilai- p < 0,001, <0,001, dan <0,01, berturut-turut), sementara NaM memiliki konsentrasi Zn dan U yang lebih tinggi ( nilai- p < 0,001). Illite lebih kaya akan Cu, Ni, Ce, Co, dan Tl dibandingkan dengan lempung lainnya, tetapi perbedaannya tidak signifikan untuk semua kasus. Kaolinit memiliki konsentrasi logam berat terendah, kecuali untuk V, yang konsentrasinya lebih tinggi daripada Mont dan NaM ( nilai- p < 0,001). Konsentrasi (ppm) setiap logam berat dalam sampel lempung yang diberikan dirinci dalam Tabel S2 dalam Informasi Pendukung S1 . Elzea Kogel dan Lewis ( 2001 ), yang meneliti keberadaan logam berat dalam empat sampel lempung yang disajikan dalam karya ini (NaM, CaM, Mont, dan Kaolinit), juga menemukan keberadaan Sr dan Pb yang tinggi. CaM memiliki konsentrasi La, Nd, Pb, Pr, dan Sr yang lebih tinggi dibandingkan dengan tiga lempung lain yang diperiksa (Elzea Kogel & Lewis, 2001 ). X. Chen et al. ( 2020 ), yang meneliti mineral lempung yang dikumpulkan dari dua lokasi di Pegunungan Sierra (AS), menemukan kisaran konsentrasi Cd dan Pb yang sama, dengan konsentrasi As yang jauh lebih rendah dibandingkan dengan yang ditemukan pada Kaolinit dan Illite. Ketiga jenis Montmorillonit (NaM, CaM, Mont) memiliki konsentrasi Cd dan Pb yang lebih tinggi, tetapi dengan konsentrasi As yang sama.
3.2 Dampak Partikel Tanah Liat terhadap Kematian Sel
Dengan menggunakan sistem pencitraan sel hidup sel tunggal ini, interaksi sel dengan partikel dapat diamati (Film S1 ). Pengamatan ini menunjukkan bagaimana sel menangkap dan berinteraksi dengan partikel individu atau dengan kelompok/agregat partikel kecil (<10 μm), dan menempatkannya ke membrannya. Penyerapan dan penelanan partikel ke dalam sel tidak dikonfirmasi. Beberapa partikel tetap berada di sel bahkan setelah pembelahan sel (Film S1a ). Penelitian sebelumnya (Bar-Ziv & Goldberg, 1974 ; Hirsch et al., 1974 ; Schenker, 2010 ) telah mengamati pengendapan partikel debu di paru-paru pada sel, yang menyoroti interaksi sel dengan partikel. Pencitraan sel hidup memungkinkan pengamatan nasib sel individu, mencatat waktu kematian yang tepat dan penyebabnya, serta waktu pembelahan sel, dan bahkan pengamatan berapa banyak partikel yang berinteraksi dengan setiap sel (dibahas dalam Ardon-Dryer et al., 2020 ).
Persentase kematian sel dari sedikitnya dua pengulangan biologis dari setiap sampel tanah liat digabungkan setelah tidak ditemukan signifikansi statistik antara kedua percobaan (data tidak ditampilkan). Secara keseluruhan, peningkatan kematian sel diamati setelah 48 jam paparan sampel tanah liat (Gambar 3a ). Sebagian besar peningkatan kematian sel signifikan secara statistik dibandingkan dengan kontrol ( nilai- p < 0,001). Untuk konsentrasi paparan 50–500 μg mL −1 , Illite dan Kaolinite menunjukkan peningkatan monotonik dalam kematian sel dengan konsentrasi; misalnya, Illite terus-menerus menunjukkan peningkatan persentase kematian sel dari 1,6% ± 0,8% dalam konsentrasi paparan terendah 25 μg mL −1 , hingga 11,1% ± 1,6% dalam konsentrasi paparan tertinggi (500 μg mL −1 ). Demikian pula, Kaolinit menunjukkan peningkatan berkelanjutan dalam persentase kematian sel dari 0,7% ± 0,3% pada konsentrasi paparan terendah (25 μg mL −1 ) hingga 5,5% ± 1,1% pada konsentrasi paparan tertinggi (500 μg mL −1 ).

Dua sampel montmorillonit menunjukkan peningkatan non-monotonik dalam kematian sel, yaitu, kematian sel tidak meningkat dengan meningkatnya konsentrasi. Misalnya, paparan NaM menyebabkan peningkatan kematian sel dari dosis 25–100 μg mL −1 . Pada 100 μg mL −1 , persentase sel mati mencapai puncaknya pada 10,4% ± 1,4%. Dengan konsentrasi paparan >100 μg mL −1 , persentase kematian sel menurun seiring dengan peningkatan konsentrasi. Pada konsentrasi paparan 500 μg mL −1 , persentase kematian sel 3,5 kali lebih rendah daripada pada 100 μg mL −1 (2,9% ± 0,7%). Paparan terhadap CaM memiliki 17,1% ± 1,8% kematian sel pada 100 μg mL −1 , dan konsentrasi paparan berikutnya sebesar 250 dan 500 μg mL −1 menunjukkan penurunan kematian sel (masing-masing 16,2% ± 2,4% dan 13,8% ± 1,6%). Paparan terhadap Mont menunjukkan peningkatan monotonik dengan tren stagnan untuk 250 dan 500 μg mL −1 , yang memiliki persentase kematian sel yang sama (9,6% ± 1,48% dan 9,0% ± 1,55%). Peningkatan non-monotonik dalam kematian sel untuk kelompok montmorillonit juga diamati dalam penelitian sebelumnya yang menggunakan jenis partikel serupa dan metode analisis serupa (Ardon-Dryer et al., 2020 ). Namun, banyak penelitian yang menggunakan partikel lempung serupa menemukan peningkatan monotonik dalam kematian sel, mayoritas dari mereka hanya menguji kematian sel menggunakan konsentrasi partikel hingga 100 μg mL −1 (Rodriguez-Cotto et al., 2013 ; Veranth et al., 2004 , 2006 ; TH Wang et al., 2023 ; Yamada et al., 2012 ), yang berarti mereka tidak dapat mendeteksi penurunan kematian sel pada konsentrasi partikel >100 μg mL −1 yang diamati dalam penelitian ini. Hasil kami setuju bahwa respons kematian sel dengan peningkatan dosis tergantung pada jenis mineral yang diuji. Peningkatan kematian sel bersifat monotonik untuk Kaolinit dan Illite, sebagaimana yang ditemukan pada mineral lain seperti silika murni dan partikel yang terkumpul selama badai debu di Iran dan Korea Selatan (J. Chang et al., 2016 ; Goudarzi et al., 2019 ; Rong et al., 2013 ). Kematian sel juga monotonik untuk konsentrasi paparan di bawah 100 μg mL −1 . Di atas ambang batas ini, kematian sel atau indikator sitotoksik lainnya menurun seiring dengan meningkatnya konsentrasi, yang menunjukkan tren non-monotonik (Ardon-Dryer et al., 2020 ; Grytting et al., 2022 ; Hetland et al., 2004 ; Veranth et al., 2006 ).
Semua percobaan kontrol memiliki persentase sel mati yang sama setelah 48 jam dan tidak ditemukan perbedaan statistik antara sampel lempung. Untuk membandingkan dampak pada kematian sel antara lempung, dampak kontrol setiap sampel dikurangi dari setiap konsentrasi paparan (Gambar 3b ). Di semua konsentrasi yang diperiksa, CaM memiliki persentase kematian sel tertinggi dibandingkan dengan lempung lainnya di semua konsentrasi, dan perbedaan ini signifikan secara statistik ( nilai- p <0,001). Persentase kematian sel yang tinggi untuk CaM dibandingkan dengan Mont bertentangan dengan temuan Gormley dan Addison ( 1983 ), yang memeriksa dampak jenis partikel yang sama pada viabilitas sel dan pelepasan LDH. Gormley dan Addison ( 1983 ) menunjukkan bahwa Mont lebih beracun dibandingkan dengan CaM dan NaM; mungkin konsentrasi partikel yang rendah dan, yang lebih penting, jenis sel yang berbeda yang digunakan adalah penyebab perbedaan ini. Paparan Kaolinit menyebabkan persentase kematian sel terendah di semua konsentrasi. Pada konsentrasi paparan terendah (25 μg mL −1 ), Illite menunjukkan persentase kematian sel yang sama dibandingkan dengan kontrol, dan itu adalah tanah liat yang paling tidak beracun, bersama dengan Kaolinit; namun, ketika konsentrasi meningkat, kematian sel meningkat hingga menjadi tanah liat paling beracun kedua pada konsentrasi paparan 500 μg mL −1 . Kaolinit secara konsisten merupakan tanah liat yang paling tidak beracun dalam konsentrasi paparan 25–250 μg mL −1 , sementara NaM menunjukkan persentase kematian sel terendah pada 500 μg mL −1 . Secara keseluruhan, sampel montmorillonit lebih beracun dibandingkan dengan Illite dan Kaolinit. Selain itu, di seluruh konsentrasi berbeda yang diperiksa, Kaolinit adalah tanah liat yang paling tidak beracun, sementara CaM adalah yang paling beracun.
Penelitian sebelumnya telah menguji dampak mineral lempung yang berbeda pada sel epitel paru-paru. Y. Wang et al. ( 2019 ) dan Ardon-Dryer et al. ( 2020 ) memaparkan sel A549 ke NaM. Y. Wang et al. ( 2019 ) menemukan peningkatan signifikan (monotonik) dalam kematian sel hingga konsentrasi paparan 100 μg mL −1 . Di sisi lain, Ardon-Dryer et al. ( 2020 ) menemukan peningkatan non-monotonik, dengan puncak kematian sel pada 100 μg mL −1 , mirip dengan temuan dalam penelitian ini. Kedua penelitian melaporkan persentase kematian sel yang lebih tinggi daripada yang ditemukan dalam penelitian saat ini. Perbedaan tersebut dapat dikaitkan dengan fakta bahwa sampel NaM yang digunakan dalam penelitian ini digiling untuk meniru fraksi yang dapat dihirup, dan oleh karena itu, partikelnya jauh lebih kecil. Di sisi lain, García-Guzmn et al. ( 2019 ), yang memaparkan sel Fibroblast NIH3T3 ke partikel montmorillonite (selama 24 jam), tidak menemukan dampak pada viabilitas sel bahkan hingga konsentrasi ∼240 μg mL −1 . Jenis sel atau sumber partikel yang berbeda dapat berkontribusi pada perbedaan ketersediaan sel ini. Sangat sedikit penelitian yang menguji dampak illite pada sel paru-paru (Osornio-Vargas et al., 1991 ; Y. Wang et al., 2019 ), dan tidak ada yang meneliti dampak pada viabilitas sel. Osornio-Vargas et al. ( 1991 ) menemukan kadar pelepasan IL-6 yang lebih tinggi ketika sel makrofag terpapar sampel badai debu yang mengandung Illite dalam jumlah tinggi (75%). Potensi toksisitas kaolinit telah dievaluasi secara ekstensif karena merupakan material yang umum digunakan dalam produk farmasi dan kosmetik (Awad et al., 2017 ; Viseras et al., 2007 ). Kaolinit secara umum dianggap menghasilkan toksisitas rendah (Kato et al., 2017 ; Rozhina et al., 2019 , 2021 ; Wu et al., 2023 ), yang mendukung temuan dari penelitian ini. Namun, beberapa penelitian melaporkan potensinya untuk menghasilkan sitotoksisitas dan kerusakan DNA (Gao et al., 2000 ; Totsuka et al., 2009 ). Namun, respons sel terhadap kaolinit dapat bervariasi secara signifikan tergantung pada jenis sel (Zhang et al., 2016 ) atau bahkan garis sel (Müller et al., 2020 ). Dalam penelitian kami, Kaolinit menghasilkan toksisitas keseluruhan yang rendah, dengan kematian sel kurang dari 5% setelah 48 jam paparan pada konsentrasi paparan tertinggi yang diuji (500 μg mL −1 ).
3.3 Dampak terhadap Waktu dan Jenis Kematian, serta Pembelahan Sel Berdasarkan Sampel Tanah Liat yang Paling Tidak Beracun dan Paling Beracun
Perbandingan dilakukan antara CaM, yang ditemukan sebagai lempung paling beracun, dan Kaolinit, yang merupakan lempung paling tidak beracun. Perbandingan ini didasarkan pada proliferasi sel dan waktu kematian sel. Sebagian besar penelitian yang mengevaluasi dampak debu mineral pada sel menggunakan metode populasi sel yang hanya memeriksa dampak pada sel pada satu atau dua titik waktu, biasanya 6, 24, atau 48 jam pasca pajanan (Jordan et al., 2009 ; Rong et al., 2013 ; Veranth et al., 2008 ; Zeng et al., 2016 ). Sangat sedikit penelitian yang memeriksanya pada resolusi waktu tinggi; penelitian dengan resolusi waktu tinggi hanya dilakukan untuk periode pendek, misalnya, 2 jam (Ovrevik et al., 2005 ). Studi ini unik karena menggunakan metodologi sel tunggal yang memungkinkan pemantauan sel terus-menerus, yang memberikan wawasan tentang nasib sel selama periode pendek (observasi setiap 15 menit) dan identifikasi waktu pasti kematian setiap sel. Pada awalnya, persentase kematian sel setiap enam jam dibandingkan antara CaM dan Kaolinit untuk tiga konsentrasi partikel (25, 250, dan 500 μg mL −1 ), disajikan pada Gambar S3 di Informasi Pendukung S1 . Tampaknya pada konsentrasi rendah, kematian sel meningkat secara seragam dari waktu ke waktu, dengan sebagian besar kematian terjadi menjelang akhir percobaan. Tetapi ketika konsentrasi partikel meningkat, kematian mulai terjadi pada waktu yang lebih awal. Perbandingan jumlah kematian sel terakumulasi per jam selama 48 jam paparan debu disajikan pada Gambar 4 untuk tiga konsentrasi partikel (25, 250, dan 500 μg mL −1 ). Secara keseluruhan, laju kematian CaM lebih cepat dibandingkan dengan Kaolinit. Kematian sel pertama untuk CaM pada konsentrasi 25 μg mL −1 terjadi setelah 7 jam paparan, tetapi pada konsentrasi yang lebih tinggi (100 dan 500 μg mL −1 ), kematian sel pertama terjadi dua dan 3 jam setelah paparan (masing-masing). Untuk Kaolinit, kematian sel pertama pada konsentrasi 25 mL −1 , diamati hanya setelah 29 jam paparan. Pada konsentrasi 100 μg mL −1 kematian sel pertama diamati setelah 4 jam paparan, sedangkan untuk konsentrasi 500 μg mL −1 , kematian sel pertama diamati setelah 8 jam paparan. Penundaan kematian sel pertama diamati di semua konsentrasi untuk Kaolinit dibandingkan dengan CaM. Meskipun perbedaan waktu kematian sel pertama diamati antara kedua tanah liat ini, waktu rata-rata di mana 50% sel mati sangat mirip di semua konsentrasi (34,4 ± 2,7 jam pasca-paparan untuk CaM dan 34,6 ± 3,8 jam untuk Kaolinit).
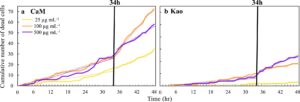
Pengamatan akumulasi waktu kematian sel menunjukkan bahwa laju kematian (kemiringan waktu kematian) sebelum dan sesudah 34 jam berbeda. Untuk memeriksa gagasan ini, kemiringan waktu kematian sel dihitung untuk setiap konsentrasi (hingga 34 jam paparan dan setelah 34 jam paparan). Untuk CaM, laju kematian tampak jauh lebih cepat dalam 12 jam terakhir paparan. Ketika konsentrasi paparan CaM adalah 100 μg mL −1 , kemiringannya meningkat dari 0,8 kematian sel/jam dalam 34 jam pertama hingga 3,2 kematian sel/jam dalam 12 jam terakhir. Peningkatan juga diamati pada konsentrasi paparan lainnya, seperti 25 μg mL −1 , yang meningkat dari 0,5 kematian sel/jam dalam 34 jam pertama hingga 1,3 kematian sel/jam dalam 12 jam terakhir. Tingkat kematian yang lebih cepat juga diamati untuk Kaolinit, tetapi dampaknya jauh lebih kecil. Misalnya, paparan Kaolinit hingga 25 μg mL −1 , kemiringannya meningkat dari 0,04 kematian sel/jam dalam 34 jam pertama hingga 0,09 kematian sel/jam dalam 12 jam terakhir, sementara paparan hingga 100 μg mL −1 , kemiringannya meningkat dari 0,3 kematian sel/jam dalam 34 jam pertama hingga 0,5 kematian sel/jam dalam 12 jam terakhir. Kemampuan untuk mendapatkan waktu pasti kematian sel menggambarkan bahwa mineral lempung memicu kematian pada waktu yang berbeda tergantung pada konsentrasi dan jenis lempung yang digunakan. Temuan seperti itu tidak dapat diamati dalam percobaan dengan satu atau dua waktu (seperti yang digunakan dengan metode populasi sel). Temuan tersebut juga menggambarkan bahwa viabilitas sel menurun drastis setelah 34 jam pasca paparan, yang dapat menjelaskan mengapa beberapa studi in vitro dan epidemiologi menemukan respons yang tertunda, antara satu dan dua hari pasca paparan. Penundaan tersebut diamati dalam penurunan viabilitas sel A549 (Ardon-Dryer et al., 2020 ; Naimabadi et al., 2016 ) dan peningkatan jumlah kunjungan ruang gawat darurat setelah kejadian debu (Herrera-Molina et al., 2024 ; Lopez-Villarrubia et al., 2021 ).
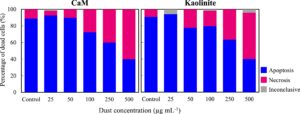
Perbandingan tambahan antara dua sampel tanah liat (CaM dan Kaolinit) dilakukan untuk memeriksa dampak konsentrasi partikel pada jenis kematian sel. Karakteristik morfologi nuklei dan membran sel pada saat kematian digunakan untuk membedakan antara jenis kematian apoptosis dan nekrosis. Untuk setiap konsentrasi paparan, sel-sel yang mati selama percobaan diklasifikasikan ke dalam dua jenis kematian sel ini. Rata-rata 49,3 ± 5,4 digunakan di berbagai konsentrasi untuk kedua tanah liat ini. Sementara tujuannya adalah untuk melacak 50 sel yang mati pada setiap konsentrasi, hanya beberapa kematian sel yang diamati dalam konsentrasi paparan rendah (kontrol, 25 dan 50 μg mL −1 ); oleh karena itu, jumlah kematian sel yang lebih rendah diperiksa dalam konsentrasi ini (rata-rata 11,5 ± 3,7 sel per konsentrasi), untuk konsentrasi <100 μg mL −1 . Dengan demikian, analisis disajikan sebagai persentase jenis kematian sel per jumlah total sel yang mati dalam setiap konsentrasi. Percobaan dilakukan dalam rangkap dua, dan klasifikasi jenis kematian diverifikasi. Analisis kedua lempung menunjukkan bahwa apoptosis adalah mekanisme utama kematian sel tanpa adanya debu (percobaan kontrol) dan pada konsentrasi paparan debu rendah (≤50 μg mL −1 ). Apoptosis bertanggung jawab atas 89% ± 5,8% kematian sel pada konsentrasi paparan rendah ini. Namun, seiring meningkatnya konsentrasi debu, nekrosis menjadi mekanisme kematian sel yang dominan, dengan hingga 60% pada konsentrasi paparan tertinggi diperiksa (500 μg mL −1 ) untuk CaM dan Kaolinit (Gambar 5 ).
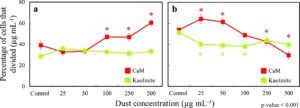
Untuk menentukan apakah sel-sel yang tetap hidup juga terdampak oleh paparan sampel tanah liat, pemeriksaan jumlah pembelahan setiap sel yang tetap hidup sepanjang keseluruhan percobaan (48 jam) dilakukan. Hasil mengungkapkan heterogenitas dalam pembelahan sel. Di berbagai tanah liat dan konsentrasi. ∼5% sel tidak membelah sama sekali; ∼10% sel hanya membelah sekali dalam 48 jam; dan sisanya membelah dua, tiga, atau bahkan empat kali. Tidak ada perbedaan antara konsentrasi kontrol dan debu untuk sel-sel yang tidak membelah atau membelah hanya sekali sepanjang percobaan. Namun, sel-sel yang membelah dua dan tiga kali sepanjang percobaan terdampak oleh partikel tanah liat (Gambar 6 ). Untuk CaM, peningkatan proliferasi sel diamati untuk sel-sel yang terpapar konsentrasi 25 μg mL −1 . Sel-sel membelah tiga kali lebih banyak dibandingkan dengan kontrol. Namun, paparan pada konsentrasi yang lebih tinggi (>50 μg mL −1 ) menghambat proliferasi sel, dan pengurangan signifikan pada jumlah sel yang membelah >3% kali diamati. Ketika sel terpapar Kaolinit, penurunan proliferasi sel yang sedikit namun signifikan secara statistik juga diamati untuk konsentrasi terendah (25 μg mL −1 ); diilustrasikan dalam peningkatan sel yang membelah dua kali dan penurunan sel yang membelah >3% kali. Namun, ketika konsentrasi Kaolinit meningkat, tidak ada perubahan statistik dalam pembelahan sel jika dibandingkan dengan 25 μg mL −1 untuk sel yang membelah tiga kali. Baek et al. ( 2012 ) juga menemukan dampak pada proliferasi sel pada konsentrasi partikel Montmorillonit yang lebih tinggi. Kaolinit, di sisi lain, menunjukkan sedikit penurunan dalam proliferasi sel di semua konsentrasi (tanpa perbedaan yang signifikan secara statistik). Peningkatan proliferasi untuk sel paru-paru yang berbeda di bawah paparan debu telah dilaporkan di masa lalu untuk konsentrasi partikel rendah ≤50 μg mL −1 (Jiang et al., 2024 ; Lemjabbar et al., 2003 ; Timblin et al., 2002 ; TH Wang et al., 2023 ), yang telah dikaitkan dengan peningkatan respons imun terhadap partikel eksternal. Namun, pada konsentrasi paparan yang lebih tinggi (>80 μg mL −1 ), penghambatan pembelahan sel dan penangkapan sel telah dilaporkan (Deng et al., 2007 ; Yang et al., 2017 ; Zeng et al., 2016 ). Penangkapan sel adalah mekanisme yang berkembang sebagai respons terhadap stres lingkungan ketika sel-sel tetap dalam satu fase siklus sel dan tidak lagi terlibat dalam proses pembelahan (Matson & Cook, 2017 ). Sel yang terpapar CaM pada konsentrasi ≥100 μg mL −1mati lebih sedikit karena banyak sel yang bertahan hidup mengalami penghambatan proliferasi sel dan memasuki keadaan henti sel, yang dapat menjelaskan kematian non-monotonik yang diamati. Paparan Kaolinit tidak mempengaruhi proliferasi sel, yang menunjukkan bahwa mekanisme henti sel tidak dipicu pada konsentrasi yang diuji, dan oleh karena itu, peningkatan monotonik dalam kematian sel diamati. Indikator lain henti sel dapat dilihat dari penundaan kematian sel pertama pada konsentrasi paparan CaM yang tinggi dibandingkan dengan Kaolinit. Untuk CaM pada konsentrasi paparan 25–100 μg mL −1 , kematian sel pertama diamati paling cepat empat jam setelah paparan. Namun, pada konsentrasi 500 μg mL −1 , kematian sel dipicu kemudian, karena banyak sel yang mengalami henti sel dan oleh karena itu tidak mati.
3.4 Menjelajahi Apa yang Membuat Beberapa Tanah Liat Lebih Beracun
Temuan dari penelitian ini menunjukkan bahwa sel-sel terpengaruh oleh paparan CaM (tanah liat paling beracun) dengan meningkatkan kematian sel, menghambat pembelahan sel, dan memicu kematian sel sedini 1 jam setelah paparan. Sebaliknya, untuk Kaolinit (tanah liat paling tidak beracun), dampaknya jauh lebih rendah untuk kematian sel dan pembelahan sel. Meskipun demikian, jenis kematian sel dari apoptosis hingga nekrosis serupa untuk kedua sampel tanah liat ini, bahkan ketika dampak kematian sel kurang signifikan untuk Kaolinit, dan setengah dari kematian sel terkonsentrasi dalam 14 jam terakhir paparan untuk kedua tanah liat. Beberapa faktor dapat menjelaskan perbedaan toksisitas ini, termasuk komposisi kimia partikel, keberadaan logam berat, luas permukaan partikel atau distribusi ukuran, serta Kapasitas Tukar Kation (CEC) partikel atau ZP, atau kemampuan pembengkakan tanah liat. Setiap faktor akan diperiksa dan dibahas untuk memberikan wawasan tentang aspek-aspek toksisitas ini.
Perlu dicatat bahwa distribusi ukuran keseluruhan antara sampel lempung yang berbeda serupa. Distribusi ukuran sampel lempung serupa dengan ukuran distribusi ukuran selama kejadian debu di Lubbock, Texas (Ardon-Dryer & Kelley, 2022 ) dan di Xilingele, Tiongkok (Hoffmann et al., 2008 ), tetapi konsentrasi di semua ukuran lebih tinggi dibandingkan dengan yang diukur di Israel (Ardon-Dryer & Levin, 2014 ) dan Mongolia (Zhou et al., 2021 ). Hetland et al. ( 2004 ) dan Jordan et al. ( 2009 ) mengindikasikan bahwa partikel yang lebih besar menyebabkan lebih banyak kematian sel pada sel A549 dibandingkan dengan partikel kecil, tetapi pengamatan distribusi ukuran partikel tidak menunjukkan bahwa satu jenis lempung memiliki partikel yang lebih besar dibandingkan dengan yang lain, tidak memungkinkan untuk mengidentifikasi distribusi ukuran sebagai faktor yang menyebabkan toksisitas lempung. Meskipun distribusi ukuran sampel lempung ini serupa, setiap lempung memiliki luas permukaan yang berbeda (ditunjukkan pada Tabel S1 dalam Informasi Pendukung S1 ). CaM memiliki luas permukaan tertinggi, sementara Kaolinit memiliki yang terendah. Banyak penelitian menunjukkan bahwa luas permukaan partikel memainkan peran penting dalam toksisitas sel, di mana luas permukaan yang lebih tinggi menyebabkan lebih banyak kematian sel (Gormley & Addison, 1983 ; Refsnes et al., 2006 ; Schwarze et al., 2007 ), atau sitotoksisitas yang lebih tinggi (Duffin et al., 2007 ; Monteiller et al., 2007 ). Selain itu, telah disarankan (Nabeshi et al., 2011 ) bahwa sel lebih mungkin berinteraksi dengan partikel dengan luas permukaan yang lebih tinggi, jadi mungkin luas permukaan memiliki peran yang lebih besar dalam toksisitas CaM. Namun, baik CaM, NaM, dan Mont memiliki dampak yang tinggi terhadap kematian sel, tetapi mereka memiliki luas permukaan yang berbeda, di mana luas permukaan NaM hampir tiga kali lebih kecil dibandingkan dengan CaM.
Kami bertanya-tanya apakah pembengkakan lempung dapat memengaruhi toksisitasnya, karena pembengkakan lempung telah ditemukan berdampak pada proliferasi sel (Cervini-Silva et al., 2016 ). Cervini-Silva et al. ( 2016 ) menemukan bahwa berbagai jenis lempung montmorillonit memiliki kemampuan pembengkakan yang berbeda, sedangkan lempung dengan kemampuan pembengkakan yang lebih tinggi menyebabkan lebih banyak kematian sel (lebih sedikit proliferasi sel). Diketahui bahwa montmorillonit dianggap sebagai lempung yang membengkak, sedangkan Kaolinit adalah lempung yang tidak membengkak (Aksu et al., 2015 ). Mungkin itu menyebabkan lebih banyak kematian sel oleh tiga jenis lempung montmorillonit (NaM, CaM, dan Mont) dibandingkan dengan Kaolinit. Tetapi jika pembengkakan adalah faktor utama yang memengaruhi kematian sel, kita akan melihat kematian sel yang lebih tinggi untuk NaM dibandingkan dengan jenis CaM, karena montmorillonit natrium membengkak lebih banyak dibandingkan dengan montmorillonit kalsium (Nones et al., 2015 ). Selain itu, pembengkakan terjadi segera setelah kontak dengan media berair, yang berarti pembengkakan terjadi bahkan sebelum partikel dimasukkan ke dalam sel (selama proses pengenceran partikel).
Parameter lempung CEC atau ZP juga dievaluasi untuk melihat apakah mereka berdampak pada sel. Tiga jenis lempung montmorillonit (NaM, CaM, dan Mont) memiliki nilai CEC dan ZP yang tinggi (ditunjukkan pada Tabel S1 dalam Informasi Pendukung S1 ). Namun jika CFC kritis, kita akan mengharapkan Mont memiliki dampak tertinggi pada sel. Studi yang menggunakan sampel lempung serupa tidak menemukan bahwa CEC atau ZP berdampak pada viabilitas atau toksisitas sel (Gormley & Addison, 1983 ; Li et al., 2013 ).
Struktur mineralogi, komposisi kimia partikel, dan keberadaan logam berat dianalisis untuk membantu memahami apa yang membuat beberapa lempung lebih beracun. Untuk memperoleh pemahaman yang lebih baik tentang apa yang menyebabkan beberapa toksisitas lempung, persentase kematian sel pada konsentrasi yang berbeda dibandingkan dengan komposisi kimia lempung dan logam berat. Perbandingan ini dibuat untuk setiap lempung menggunakan semua konsentrasi, menggunakan dua jenis uji regresi (linier dan eksponensial). Tabel S3 dalam Informasi Pendukung S1 memberikan ringkasan analisis ini. SiO2 memiliki korelasi kuat dengan kematian sel untuk konsentrasi paparan 50 dan 250 μg mL −1 ( koefisien determinasi R2 adalah ≥0,51 dalam regresi eksponensial ) . Korelasi kuat juga ditemukan untuk Al2O3 tetapi hanya untuk konsentrasi paparan 25, 50, dan 250 μg mL − 1 ( R2 berkisar dari 0,70 hingga 0,79). Konsentrasi CaO menunjukkan korelasi yang sangat kuat dengan kematian sel pada konsentrasi paparan 25–250 μg mL −1 ( R 2 adalah 0,81–0,97). MgO menunjukkan korelasi yang kuat hingga sangat kuat dengan kematian sel, dengan koefisien berkisar antara 0,61 hingga 0,99. Unsur-unsur tambahan yang ditemukan dalam sampel lempung (Fe 2 O 3 , FeO, Na 2 O, atau K 2 O) menunjukkan korelasi yang lemah dengan kematian sel ( R 2 < 0,49). Komposisi kimia montmorillonit menunjukkan bahwa sampel-sampel ini memiliki konsentrasi SiO2 yang lebih tinggi ( 60,4%–70,1%) dibandingkan dengan yang ditemukan di Illite dan Kaolinite (masing-masing 49,3% dan 44,5%). Pengamatan berdasarkan keberadaan kuarsa di antara sampel lempung menunjukkan bahwa Kaolinite dan CaM mengandung jumlah kuarsa yang sama (1%–2%), sedangkan NaM memiliki jumlah kuarsa yang lebih tinggi (5%–10%), dan Illite mengandung jumlah kuarsa tertinggi (10%–15%). Jika keberadaan kuarsa di lempung adalah penyebab utama dampak pada toksisitas sel, kita akan menduga Illite memiliki dampak tertinggi pada kematian sel. Paparan silika kristal, silika murni, atau kuarsa telah ditemukan menginduksi pelepasan sitokin, produksi spesies oksigen reaktif (ROS), serta kematian sel (Borm et al., 2018 ; Kawasaki, 2015 ). Meskipun sebagian besar silikon yang ditemukan dalam mineral lempung tersusun dalam tetrahedra SiO4 yang menjadi ciri khas struktur mineraloginya daripada dalam bentuk kuarsa, penelitian menunjukkan bahwa keberadaan dan kelimpahan silikon berkorelasi dengan toksisitas debu mineral (Guthrie, 1997 ; Hetland et al., 2000 ; Pavan et al., 2020 ; Zeng et al., 2016 ). Paparan terhadap sejumlah besar unsur-unsur ini diketahui menyebabkan silikosis (Bang et al., 2015 ; Carney et al., 2019 ; Mazurek et al., 2015 ), fibrosis paru, dan akhirnya, pneumokoniosis (Hoy & Chambers, 2020 ; Schenker, 2010 ). Beberapa penelitian (Bar-Ziv & Goldberg, 1974 ; Hirsch et al., 1974 ) menemukan Pneumoconiosis Silika pada wanita Badui di Gurun Negev, Israel akibat paparan partikel debu dari peristiwa debu, sementara Mathur dan Choudhary ( 1997 ) menemukan Pneumoconiosis (sindrom paru gurun) di Gurun Thar, India akibat paparan peristiwa debu. Semua penelitian menunjukkan bahwa keberadaan silikon dalam debu merupakan penyebab utama masalah kesehatan ini. Barangkali rasio SiO2 – Al2O3 juga memainkan peran penting dalam menentukan toksisitas dan kematian sel yang disebabkan oleh debu. Kami menemukan bahwa sampel lempung dengan konsentrasi SiO2 yang lebih tinggi dan konsentrasi Al2O3 yang lebih rendah menyebabkan lebih banyak kematian sel; sebaliknya, lempung dengan proporsi SiO2 dan Al2O3 yang sama ( misalnya , Kaolinit ) menyebabkan lebih sedikit kematian sel. Hasil ini konsisten dengan penelitian sebelumnya yang menguji efek SiO2 dan Al2O3 pada kematian sel (Jordan et al., 2009 ; Thibodeau et al., 2004 ; Veranth et al., 2006 ) . Jordan et al. ( 2009 ) menemukan bahwa partikel SiO2 menyebabkan persentase kematian sel dan pelepasan LDH lima kali lebih tinggi daripada partikel Al2O3 dalam sel A549 , sementara Thibodeau et al. ( 2004 ) menemukan bahwa partikel SiO 2 lebih berbahaya bagi makrofag alveolar dibandingkan dengan partikel SiO 2 yang dilapisi aluminium. Perbedaan antara sampel juga ditemukan untuk CaO. Konsentrasi CaO tertinggi untuk CaM dan terendah (tidak ada) untuk Kaolinit. Percobaan in vitro sebelumnya menunjukkan bahwa paparan partikel badai debu atau partikel CaO yang mengandung PM 10 meningkatkan Ca 2+ intraseluler (Brown et al., 2007 ; YH Kim et al., 2003 ), yang menyebabkan sitotoksisitas dan kerusakan oksidatif (Donaldson et al., 2003 ; Geng et al., 2005 ; Veranth et al., 2006 ). Dalam beberapa kasus, toksisitasnya setinggi SiO 2 kristal (Marks et al., 1956 ). Kalsium ditemukan menyebabkan kerusakan oksidatif dan meningkatkan permeabilitas membran sel (Muriel & Sandoval, 2000 ), yang mengubah proses transpor transmembran dengan memodifikasi gradien ion. Peningkatan kadar Ca 2+ intraseluler mengganggu homeostasis intraseluler dan akhirnya dapat menyebabkan cedera sel dan penurunan viabilitas sel (Burlando et al., 1999 ; Geng et al., 2005 ; Sandal et al., 2004 ), yang serupa dengan temuan dalam penelitian saat ini (seperti yang ditunjukkan pada Tabel S3 dalam Informasi Pendukung S1). Bahan kimia lain yang diperiksa adalah Magnesium, yang juga merupakan CaM tertinggi dan terendah untuk Kaolinit. Magnesium (Mg) dianggap sebagai elemen tidak beracun bagi sel; namun, penelitian ini menemukan bahwa peningkatan konsentrasi MgO berdampak kuat pada kematian sel (korelasi R 2 sebesar 0,99 untuk 50 μg mL −1 , Tabel S3 dalam Informasi Pendukung S1 ). Temuan kami serupa dengan temuan Schumacher et al. ( 2014 ), yang menemukan peningkatan kematian sel akibat nekrosis dengan pelepasan IL-8 pada sel di sekitar implan MgO. Konsentrasi tinggi Mg dalam media kultur kemungkinan besar menyebabkan syok osmotik, yang menurut penelitian lain hanya disebabkan ketika konsentrasi Mg >500 μg mL −1 (Ge et al., 2011 ). Ca 2+ dan Mg 2+ adalah ion penting yang berpartisipasi dalam banyak proses metabolisme dalam sel; Namun, sama halnya dengan Schumacher et al. ( 2014 ), dalam penelitian ini, sel-sel tersebut bersentuhan langsung dengan partikel yang mengandung kadar CaO dan MgO yang tinggi. Meskipun potensi membran sel tidak diuji, diduga bahwa peningkatan ion-ion ini mungkin telah mengganggu homeostasis Ca 2+ dan Mg 2+ , yang menyebabkan syok osmotik yang menyebabkan kematian sel.
Logam berat diketahui beracun bagi kesehatan manusia, bahkan pada dosis yang lebih rendah (Tchounwou et al., 2012 ). Enam belas logam berat yang berbeda ditemukan dalam sampel tanah liat yang digunakan. Mayoritas logam berat (V, Ni, Co, Cu, Zn, As, Cs, Tl) memiliki dampak yang lemah hingga tidak ada dampak pada kematian sel, karena nilai korelasinya rendah ( R 2 < 0,45) di seluruh konsentrasi tanah liat dan partikel yang diperiksa, meskipun beberapa logam berat ini memiliki konsentrasi tinggi dalam sampel tanah liat. Kehadiran Mn, Sr, dan Cd, di sisi lain, menunjukkan korelasi positif kuat hingga sangat kuat dengan kematian sel ( R 2 > 0,7 untuk konsentrasi 25–250 μg mL −1 ), sedangkan keberadaan Pb dan Se menunjukkan korelasi positif kuat (0,5 < R 2 < 0,7). Ringkasan perbandingan ini disajikan dalam Tabel S3 di Informasi Pendukung S1 . Ketiga sampel montmorillonit memiliki konsentrasi logam berat yang lebih tinggi dibandingkan dengan yang diukur dalam Illite dan Kaolinit. CaM memiliki konsentrasi tertinggi di semua sampel (838 ± 89 ppm Mn, 327 ± 5 ppm Sr, 0,9 ± 0,05 ppm Cd, dan 0,6 ± 0,3 ppm Se). Keempat logam berat ini, mangan (Mn), selenium (Se), strontium (Sr), dan kadmium (Cd), menunjukkan korelasi positif sedang dengan kematian sel. Mn dan Se merupakan unsur esensial bagi kehidupan dan berperan penting dalam proses metabolisme (Duntas & Benvenga, 2015 ). Namun demikian, konsentrasi tinggi logam berat ekstraseluler ini mengganggu homeostasis sel, yang menyebabkan hasil yang merugikan bagi sel. Misalnya, paparan terhadap Mn diketahui mengurangi proliferasi sel dan viabilitas sel (Reaney & Smith, 2005 ; Reaney et al., 2002 ; Rovetta et al., 2007 ), sementara paparan terhadap Se dapat menyebabkan stres oksidatif, penangkapan sel, dan apoptosis (Galić et al., 2020 ; Mezes & Balogh, 2009 ). Paparan makrofag dan sel paru epitel terhadap konsentrasi ≥0,3 ppm (3 μM) Cd meningkatkan pelepasan beberapa sitokin dan mengurangi viabilitas sel (Hart et al., 1999 ; Låg et al., 2010 ). CaM yang digunakan dalam penelitian ini mengandung konsentrasi Cd yang jauh lebih tinggi daripada yang diukur dalam sampel tanah liat lainnya, yang dapat menjelaskan dampaknya pada viabilitas sel. Konsentrasi Cd yang diukur dalam Illite dan Kaolinite berada di bawah ambang batas toksisitas Cd yang dilaporkan dalam penelitian sebelumnya (Hart et al., 1999 ; Låg et al., 2010 ). Paparan partikel Sr ditemukan dapat meningkatkan ROS serta memicu apoptosis dan berdampak pada viabilitas sel A549 (Ahmad et al., 2022) .). CaM memiliki konsentrasi Sr tertinggi, sementara Kaolinit memiliki yang terendah (Tabel S2 dalam Informasi Pendukung S1 ). Arsenik (Ar) dan Timbal (Pb) termasuk logam berat yang paling beracun (Tchounwou et al., 2012 ). Keduanya ditemukan dalam sampel tanah liat, konsentrasi As berkisar dari 0,7 ± 0,2 ppm (Illite) hingga 9,9 ± 0,1 ppm (NaM) dan konsentrasi Pb berkisar dari 8,9 ± 1,6 ppm (Illite) hingga 46 ± 2,3 ppm (NaM). NaM memiliki kadar As dan Pb yang lebih tinggi daripada CaM. Konsentrasi ini serupa dengan yang ditemukan dalam sampel tanah gurun Cina oleh P.-K. Lee et al. ( 2013 ), tetapi dua kali lipat lebih rendah daripada yang dikumpulkan selama badai debu Cina (P.-K. Lee et al., 2013 ). Baik konsentrasi As maupun Pb tidak memiliki dampak yang kuat terhadap kematian sel ( R 2 <0,5 untuk sebagian besar konsentrasi, Tabel S3 dalam Informasi Pendukung S1 ). Ini mengejutkan karena baik As maupun Pb secara umum dianggap beracun (Jaishankar et al., 2014 ; Ohiagu et al., 2022 ). Dampak yang lebih kuat dari As terhadap kematian sel diharapkan, setidaknya untuk jenis lempung montmorillonit, yang memiliki konsentrasi As yang lebih tinggi. Karena kemampuan ekstraksi As yang lebih tinggi diharapkan dari montmorillonit dibandingkan dengan Kaolinit dan Illite, setidaknya pada nilai pH ∼7 (Manning & Goldberg, 1997 ), pH digunakan untuk media kultur sel. Analisis in vitro sebelumnya menggunakan lini sel yang sama dan konsentrasi partikel yang serupa, menemukan bahwa Pb mengurangi viabilitas sel hingga 50% (Yuan et al., 2019 ), tetapi baik As maupun Pb tidak menunjukkan penurunan signifikan dalam viabilitas sel untuk jenis sel paru epitel lainnya (Honda et al., 2015 ; Yuan et al., 2019 ). Dampak rendah kematian sel dapat dikaitkan dengan temuan dari X. Chen et al. ( 2020 ), yang menyatakan bahwa bioavailabilitas As, Cd, dan Pb dari mineral lempung sangat rendah hingga tingkat yang tidak terdeteksi. Ini menunjukkan bahwa logam berat mungkin tidak larut ke dalam medium dan berdampak pada sel (X. Chen et al., 2020 ; Li et al., 2013 ). Bowman et al. ( 2011 ) menemukan bahwa pelindian racun atau pengikatan nutrisi oleh sifat pertukaran ion partikel tidak akan menyebabkan toksisitas; Namun, kontak langsung antara partikel dan sel tampaknya diperlukan untuk toksisitas sel. Banyak penelitian menyoroti pentingnya kontak langsung antara sel dan partikel, yang sangat penting untuk toksisitas dan kematian sel (Bowman et al., 2011 ; Li et al., 2013 ; Veranth et al., 2004 ). Ardon-Dryer et al. ( 2020) menemukan bahwa sel yang berinteraksi dengan lebih banyak partikel meningkatkan peluang kematian mereka. Namun, alasan yang menyebabkan sel-sel ini mengambil dan berinteraksi dengan partikel-partikel individual atau kelompok partikel kecil, atau apakah sel-sel tersebut mendapatkan beberapa elemen atau logam berat ini per kontak, masih belum jelas.
Meskipun toksisitas logam berat individual dicirikan dengan baik, dampak kombinasi beberapa logam berat pada sel paru epitel masih belum jelas (Choi et al., 2018 ; Honda et al., 2015 ). Misalnya, Se dapat menurunkan toksisitas As pada tingkat seluler (Sun et al., 2014 ), dan CaO, MgO, dan FeO (yang ditemukan dalam sampel tanah liat) adalah stabilisator yang sangat efektif untuk Cd, Cr, As, dan Pb (HT Kim & Lee, 2017 ). Hal ini menyoroti perlunya penelitian tambahan untuk memeriksa dampak partikel debu atmosfer, karena partikel-partikel ini akan memiliki sifat fisikokimia yang berbeda dengan konsentrasi mineral tanah liat dan logam berat yang berbeda yang mungkin mengisyaratkan tingkat toksisitas partikel debu ini. Penelitian juga harus memeriksa apakah sel menyerap unsur-unsur tertentu atau logam berat dari partikel per kontak dan jumlah yang diperlukan untuk menjelaskan dampak toksik yang berbeda.
Apoptosis dan nekrosis diamati pada persentase yang sama ketika partikel terpapar CaM dan Kaolinit (Gambar 5 ). Kami bertanya-tanya mengapa distribusi jalur yang sama diamati bahkan ketika kedua tanah liat memiliki dampak yang berbeda pada jumlah sel yang mati. Diasumsikan bahwa kedua mekanisme kematian dipicu sebagai hasil dari dua jalur yang berbeda. Pertama, keberadaan logam berat atau gangguan homeostasis di media karena komponen partikel meningkatkan ion seperti Ca 2+ dan Mg 2+ , yang dapat menyebabkan stres oksidatif (Rodriguez-Cotto et al., 2015 ; Schumacher et al., 2014 ; Veranth et al., 2006 ), kematian karena apoptosis dan penangkapan sel untuk sel yang bertahan hidup (Ardon-Dryer et al., 2020 ). Jalur kedua adalah kematian akibat nekrosis, yang disebabkan oleh kerusakan fisik dan pecahnya membran akibat kontak langsung dengan partikel, terutama saat konsentrasi partikel meningkat (Almeida-Silva et al., 2022 ; Fubini & Arean, 1999 ). Kontak langsung antara partikel dan sel diamati dalam semua percobaan, yang dapat menjelaskan kesamaan dalam nekrosis. Mungkin konsentrasi yang lebih rendah dari berbagai bahan kimia dan konsentrasi partikel yang rendah tidak cukup untuk memicu nekrosis, tetapi cukup untuk memungkinkan sel mengambil tindakan dan mati melalui apoptosis.
Perlu dicatat bahwa konsentrasi partikel yang digunakan dalam penelitian ini jauh lebih rendah daripada pedoman paparan yang dapat dihirup yang diberikan oleh OSHA, berdasarkan SDS tanah liat (The Clay Mineral Society, 2025 ). Namun bahkan dalam konsentrasi yang digunakan dalam penelitian ini, toksisitas diamati, dan paparan terhadap sampel tanah liat menyebabkan kematian sel yang lebih cepat dan lebih tinggi melalui nekrosis, yang dapat memengaruhi peradangan. Oleh karena itu, mengkarakterisasi toksisitas debu berdasarkan ukuran dan komposisi sangat penting untuk menentukan dampak potensial yang dimiliki badai debu terhadap kesehatan manusia. Meskipun ukuran partikel individu tidak menunjukkan dampak yang kuat, penting untuk memeriksa ukuran partikel (distribusi ukuran) yang ada dalam kejadian debu untuk memahami apakah ada cukup partikel kecil yang dapat memasuki paru-paru. Hasil kami menunjukkan bahwa mineralogi debu merupakan faktor penting dalam menentukan dampaknya terhadap sel. Kotsyfakis dkk. ( 2019 ) menemukan perbedaan dalam dampak badai debu Afrika terhadap mortalitas dan eksaserbasi alergi, yang dikaitkan dengan perbedaan komposisi partikel badai debu. Misalnya, wilayah Sahara kaya akan Illite sementara wilayah Sahel, di selatan Sahara, kaya akan kaolinit. Dampak Badai Debu Asia (ADS) terhadap kesehatan manusia telah dipelajari secara ekstensif (Aghababaeian et al., 2021 ; Lwin et al., 2023 ; Sadeghimoghaddam et al., 2021 ). Namun, dampak badai debu ini terhadap kesehatan manusia berdasarkan studi epidemiologi saling bertentangan. Beberapa studi menunjukkan bahwa komposisi partikel merupakan faktor penting yang berkontribusi terhadap perbedaan ini (H. Lee et al., 2014 ; Zhang et al., 2016 ). Mineralogi badai debu di wilayah tersebut bervariasi secara signifikan dari gurun yang berbeda yang berkontribusi terhadap ADS (Wei et al., 2004 ). Misalnya, tanah Gurun Gobi Mongolia diperkaya dengan mineral lempung illite dibandingkan dengan Gurun Taklamakan (Jeong, 2020 ). Meskipun beberapa studi epidemiologi telah meneliti dampak badai debu terhadap kesehatan di AS (Crooks et al., 2016 ; Herrera-Molina et al., 2024 ; Miao et al., 2022 ; Rublee et al., 2020 ; Schwartz, 1999 ), tidak satu pun dari studi ini yang meneliti mineralogi, komposisi kimia, atau keberadaan mineral lempung atau jenis partikel debu yang ada selama peristiwa debu ini. Studi yang meneliti dampak debu terhadap kesehatan harus mempertimbangkan tidak hanya konsentrasi partikel tetapi juga komposisi ukurannya, mineralogi, komposisi kimia, dan keberadaan logam berat.
Studi ini memberikan wawasan tentang seberapa cepat mineral lempung dapat memicu kematian sel dalam sel paru-paru epitel. Bahkan paparan terhadap konsentrasi rendah mineral lempung, selama badai debu yang mengandung mineral ini, dapat menyebabkan respons imunologis yang dapat meningkatkan permintaan akan perhatian medis, yang dapat membebani sistem perawatan kesehatan. Jika komponen mineralogi badai debu di wilayah tertentu diketahui cukup dini, sistem peringatan dapat memberi tahu penyedia layanan kesehatan tentang kemungkinan peningkatan permintaan rawat inap, yang akan sangat penting bagi populasi yang rentan.
4 Kesimpulan
Karena penggurunan meningkatkan risiko kekeringan dan frekuensi badai debu, jutaan orang di seluruh dunia semakin terpapar menghirup partikel mineral. Namun, penelitian sebelumnya (epidemiologis dan in vitro) telah menunjukkan ketidaksepakatan tentang toksisitas partikel saat mengevaluasi dampaknya di berbagai lokasi. Tujuan dari penelitian ini adalah untuk mengevaluasi dampak dari lima mineral lempung yang umum ditemukan selama peristiwa debu pada sel alveolar epitel A549 menggunakan Analisis Sel Tunggal. Dengan menggunakan pencitraan sel hidup, kami merekam interaksi sel dengan debu selama 48 jam, mendokumentasikan waktu kematian yang tepat, tingkat pembelahan, dan jenis kematian (apoptosis atau nekrosis). Hasil kami menunjukkan bahwa komposisi mineral lempung merupakan faktor penting dalam menentukan toksisitasnya. Peningkatan kematian sel mengikuti tren non-monotonik untuk lempung beracun, dengan tren monotonik untuk lempung yang paling tidak beracun. Tren non-monotonik pada kematian sel terjadi bersamaan dengan penurunan pembelahan sel, yang menunjukkan bahwa sel-sel mengalami penghentian ketika terpapar tanah liat yang sangat beracun (di atas konsentrasi paparan 100 μg mL −1 ). Meskipun demikian, tren serupa dari mekanisme kematian sel diamati untuk sampel tanah liat yang paling banyak dan paling sedikit diperiksa, dengan peningkatan nekrosis dengan peningkatan konsentrasi, dan penurunan apoptosis. Tidak seperti teknik sebelumnya, Analisis Sel Tunggal memberikan wawasan yang berguna tentang waktu kematian sel yang tepat, menunjukkan bahwa peningkatan konsentrasi memicu kematian lebih awal, dengan hampir 50% kematian terjadi 34 hingga 48 jam setelah paparan. Temuan menyoroti fakta bahwa efek partikel badai debu pada sel paru-paru dapat tertunda 1–2 hari setelah kejadian, yang konsisten dengan studi epidemiologi sebelumnya. Studi saat ini membantu untuk mengklarifikasi beberapa mekanisme yang menyebabkan kematian sel setelah paparan debu mineral dan dapat digunakan untuk mengembangkan sistem peringatan dini yang dapat digunakan oleh penyedia layanan kesehatan untuk memprediksi kemungkinan peningkatan permintaan perawatan pernapasan setelah badai debu.




Tinggalkan Balasan