Abstrak
Sejak 2016, sindrom busuk hitam batang telah terjadi pada putting green rumput bengkok merambat ( Agrostis stolonifera L.) di 16 lapangan golf di Jepang. Jamur umum diisolasi dari jaringan simptomatik ini. Analisis filogenetik isolat ini menggunakan metode kemungkinan maksimum berdasarkan urutan rDNA-ITS menunjukkan >95% homologi dengan Candidacolonium agrostis , yang telah dilaporkan sebagai kemungkinan patogen A. stolonifera di Cina. Tiga isolat diinokulasi ke dalam A. stolonifera , dan semua isolat menunjukkan gejala busuk batang, dan jamur dengan karakteristik morfologi yang mirip dengan isolat yang diinokulasi diamati di daerah yang sakit. Respons pertumbuhan suhu dari tiga isolat dikonfirmasi, dengan suhu pertumbuhan optimal 30°C atau 35°C. Temuan ini menunjukkan bahwa penyakit ini disebabkan oleh Candidacolonium sp., tetapi tempat infeksi dan gejala agak berbeda dari penyakit yang disebabkan oleh C. agrostis ; lebih jauh lagi, informasi seperti analisis filogenetik berdasarkan pengurutan beberapa wilayah dan karakteristik morfologi diperlukan untuk mengidentifikasi spesies.
1. PENDAHULUAN
Creeping bentgrass ( Agrostis stolonifera L.) adalah rumput musim dingin yang paling umum digunakan pada green lapangan golf di Jepang. Namun, di bawah iklim musim panas yang panas dan lembab di Jepang, rumput ini menghadapi masalah besar, terutama karena kerusakan yang disebabkan oleh antraknosa, hawar Pythium, dan penyakit Acidovorax (Abe et al., 2024 ). Sejak 2016, putting green A. stolonifera di lapangan golf di Jepang telah dipengaruhi oleh bercak-bercak berbentuk tidak beraturan dan berwarna cokelat pucat hingga cokelat seperti antraknosa yang disebut “busuk hitam batang” di musim panas. Individu yang sakit juga menunjukkan gejala busuk hitam di pangkal tanaman, tetapi tidak ada antraknosa ( Colletotrichum cereale Manns) atau jamur penyerap ( Gaeumannomyces graminis (Saccardo) Arx & DL Olivier) yang diamati di bawah pengamatan mikroskopis, meskipun adanya gejala batang menghitam. Jamur, yang belum dilaporkan di Jepang, sering diisolasi dari jaringan yang sakit. Tujuan dari laporan ini adalah untuk mengidentifikasi jamur dan mengkonfirmasi patogenisitasnya pada A. stolonifera .
2 BAHAN DAN METODE
2.1 Investigasi dan isolasi wabah
Sampel dikumpulkan sebagai bagian dari diagnosis penyakit mengikuti laporan sebelumnya (Abe et al., 2024 ; Hayakawa & Yaguchi, 2000 ), dan gejala penyakit diamati, dan waktu perkembangan penyakit diselidiki. Pengamatan morfologi jaringan yang sakit dan isolat pada media dilakukan dengan mikroskop optik (OLYMPUS BX60) dan dengan mikroskop digital (OLYMPUS DSX1000). Batang berwarna gelap dipotong menjadi bagian-bagian 5-10 mm, permukaannya didesinfeksi dengan etanol 80% selama 2 menit, dan dicuci dengan air steril, direndam dalam natrium hipoklorit 1,5% selama 2 menit, dicuci dengan air steril lagi. Kemudian, bagian-bagian tersebut diletakkan di atas kertas saring steril dan dikeringkan. Bagian batang yang kering dipindahkan ke media agar bebas nutrisi 2% (mengandung 30 ppm kanamisin dan 30 ppm kloramfenikol). Semua operasi ini dilakukan dalam tudung aliran laminar.
2.2 Amplifikasi dan sekuensing PCR
Isolat ditumbuhkan pada media agar sukrosa kentang pada suhu 25°C selama 1 minggu, dan miselia aerial dikikis, dan DNA diekstraksi menggunakan GenCheck® DNA Extraction Reagent. Primer dan kondisi amplifikasi yang digunakan untuk PCR wilayah ITS dan DNA ribosom 5.8S (rDNA-ITS) mengikuti laporan sebelumnya (Vines et al., 2021 ). Produk PCR dimurnikan menggunakan QIAquick® Gel Extraction Kit dan dikirim ke Fasmac Co., Ltd. untuk pengurutan. Urutan diselaraskan menggunakan MUSCLE, dan pohon filogenetik kemungkinan maksimum dibuat menggunakan MEGA11 (Tamura et al., 2021 ).
2.3 Uji patogenisitas
Patogenisitas isolat pada A. stolonifera telah dikonfirmasi. Pot tanpa glasir berdiameter lima belas sentimeter diisi dengan pasir sungai steril dan ditaburi dengan 0,1413 g benih A. stolonifera (cv. Penncross) per pot. Pot dibiarkan tumbuh selama sekitar 1 bulan sebelum pengujian. Metode persiapan inokulum dan inokulasi mengikuti laporan sebelumnya (Hayakawa et al., 2006 ). Setelah inokulasi, pot ditutup dengan kantong plastik dan ditempatkan di ruang pertumbuhan (FLI-2010H, TOKYO RIKAKIKAI CO., LTD.) di bawah siklus berikut: 28°C selama 4 jam (tingkat pencahayaan 1), 30°C selama 4 jam (tingkat pencahayaan 3), 28°C selama 4 jam (tingkat pencahayaan 1), dan 26°C selama 12 jam (tingkat pencahayaan 0). Setelah 1 minggu, kantong plastik dilepaskan, dan patogenisitas isolat pada A. stolonifera diselidiki. Isolasi ulang dan identifikasi dilakukan seperti yang dijelaskan di atas untuk memastikan bahwa postulat Koch terpenuhi.

2.4 Suhu pertumbuhan optimum pada media
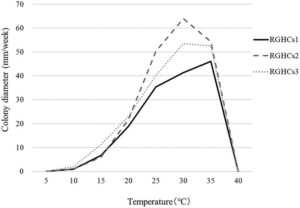
Untuk menyelidiki suhu pertumbuhan optimum pada medium, isolat dikulturkan pada PDA pada suhu 25°C selama 5 hari. Sumbat miselium (berdiameter 5 mm) dikumpulkan menggunakan bor gabus dan ditempatkan di tengah medium PDA segar. Cawan petri ditutup rapat dan diinkubasi pada suhu 5°C, 10°C, 15°C, 20°C, 25°C, 30°C, 35°C, dan 40°C masing-masing selama 7 hari.
3 HASIL DAN PEMBAHASAN
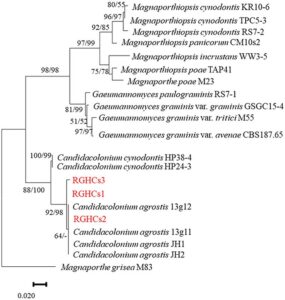
Penyakit ini membentuk bercak-bercak bulat hingga tidak teratur, berwarna cokelat pucat hingga cokelat berukuran 5–30 cm dengan diameter pada putting green A. stolonifera , dengan gejala busuk hitam pada batang (Gambar 1 dan 2 ). Berdasarkan pengamatan mikroskopis, hyphopodia sederhana hingga berlobulus mirip G. graminis diamati dengan kepadatan tinggi pada pelepah daun dan batang. Penyakit ini dikonfirmasi pada 16 lapangan golf antara tahun 2016 dan 2023, dan wabah terkonsentrasi dari Juli hingga September. Disimpulkan bahwa penyakit ini disebabkan oleh patogen dengan suhu optimum untuk perkembangan penyakit pada kisaran suhu tinggi. Tiga isolat (RGHCs1, RGHCs2, dan RGHCs3) diperoleh dari jaringan yang sakit. Urutan nukleotida daerah rDNA-ITS diperoleh, dan nomor aksesi diberikan pada setiap isolat (RGHCs1: LC859861, RGHCs2: LC859862, dan RGHCs3: LC859863). Analisis filogenetik berdasarkan daerah rDNA-ITS menunjukkan bahwa tiga isolat memiliki >95% homologi dengan Candidacolonium agrostis , dilaporkan oleh Geng et al. ( 2023 ), dan membentuk klade yang sama (Gambar 3 ). Uji patogenisitas tiga isolat pada A. stolonifera mereproduksi gejala busuk hitam pada pelepah daun dan batang (Gambar 4 ). Karena hyphopodia dari strain yang diinokulasi diamati di area yang menghitam di bawah pemeriksaan mikroskopis dan juga diisolasi ulang dan diidentifikasi sebagai isolat yang sama, isolat yang diinokulasi dianggap sebagai penyebab utama gejala ini. Respons pertumbuhan suhu dari tiga isolat dikonfirmasi, dengan suhu pertumbuhan optimal 30°C atau 35°C (Gambar 5 ). Tren ini serupa dengan yang dilaporkan oleh Geng et al. ( 2023 ), yang menemukan bahwa patogen memiliki suhu pertumbuhan optimum dalam kisaran suhu tinggi. Berdasarkan hasil ini, patogen tersebut serupa dengan C. agrostis yang dilaporkan oleh Geng et al. ( 2023 ). Meskipun Geng et al. ( 2023 ) melaporkan bahwa akar terinfeksi oleh C. agrostis , yang mengakibatkan gejala seperti bercak musim panas, penyakit yang dijelaskan dalam laporan ini berbeda karena terutama menginfeksi pelepah daun dan batang, yang menyebabkan gejala busuk hitam. Gejala-gejala ini serupa dengan antraknosa dan take-all. Oleh karena itu, penyakit ini dinamakan “busuk hitam batang” karena gejalanya yang khas di Jepang. Investigasi lebih lanjut diperlukan untuk identifikasi spesies, termasuk analisis filogenetik menggunakan beberapa wilayah dan perbandingan patogenisitas dengan galur yang diisolasi di Tiongkok.







Tinggalkan Balasan