ABSTRAK
Protein sutra fungsionalisasi rekombinan FN-silk, termasuk motif adhesi sel dari fibronektin, dapat membentuk jaringan yang cocok untuk kultur 3D sel yang melekat. Jaringan FN-silk tersebut sebelumnya telah terbukti mendukung pertumbuhan dan diferensiasi berbagai jenis sel. Di sini, kami telah mengembangkan metodologi yang mudah digunakan untuk pembuatan jaringan FN-silk yang mengambang bebas dalam pelat 96-sumur dengan sel primer manusia dewasa dan sel punca. Kami menunjukkan bahwa sel punca mesenkimal manusia (hMSC) yang dikultur dalam jaringan FN-silk membentuk kontak sel-sel dan sel-matriks, menghasilkan kultur 3D yang meniru jaringan. Analisis viabilitas dan ekspresi mengungkapkan bahwa hMSC dalam jaringan FN-silk memiliki fase proliferatif awal dengan viabilitas sel yang tinggi dan hipoksia dan apoptosis yang secara signifikan lebih rendah, dibandingkan dengan ketika dikultur sebagai spheroid bebas perancah. Jaringan FN-silk terbukti mendukung diferensiasi hMSC menjadi sel-sel mirip adiposit dengan viabilitas yang terjaga baik selama periode diferensiasi selama 3 minggu, berbeda dengan viabilitas jangka panjang kultur 3D bebas perancah yang sangat buruk. Peningkatan adipogenesis dikonfirmasi oleh pewarnaan tetesan lipid, kuantifikasi trigliserida intraseluler, dan kadar adiponektin yang disekresikan, serta analisis ekspresi beberapa penanda adiposa yang bonafide . Terakhir, kami menunjukkan bahwa hepatosit manusia primer mempertahankan fungsi penting dan penanda fenotipik saat dikultur dalam jaringan FN-silk, fitur yang hilang dengan cepat selama kultur 2D konvensional. Oleh karena itu, kami mengusulkan jaringan FN-silk sebagai perancah yang berharga untuk kultur sel manusia 3D, yang memberikan dukungan untuk proliferasi sel, diferensiasi, dan pemeliharaan fungsionalitas spesifik jaringan yang penting.
1 Pendahuluan
Model In Vitro berbasis sel digunakan secara luas dalam penelitian biomedis untuk aplikasi translasi (Youhanna et al. 2022 ). Namun, model yang digunakan sering kali memiliki relevansi fisiologis yang terbatas. Beberapa contoh model In Vitro yang penting adalah model tumor untuk penelitian kanker dan pengujian obat antikanker (Barbosa et al. 2022 ), model hati untuk mempelajari metabolisme obat dan hepatotoksisitas (Lauschke et al. 2019 ; Yang et al. 2023 ), serta model jaringan adiposa dan sel prekursornya untuk mempelajari adipogenesis dan penyakit terkait seperti obesitas dan diabetes (Armani et al. 2010 ; Ruiz-Ojeda et al. 2016 ). Untuk semua model tersebut, penting untuk menggunakan sumber sel yang tepat serta metode kultur untuk meniru padanan In Vivo sedekat mungkin. Jika tidak, relevansi fisiologis yang berkurang dan kesenjangan translasi yang dihasilkan berkontribusi besar terhadap tingginya tingkat kegagalan dalam pengembangan obat saat ini (Krüger dan Kopp 2023 ; Langhans 2018 ).
Sel primer, yang diisolasi langsung dari jaringan yang diinginkan, adalah sumber sel standar emas untuk memperoleh model yang relevan secara fisiologis. Namun, sel primer sering kali sensitif dan sulit untuk dikulturkan, terutama untuk periode yang lebih lama, yaitu, beberapa hari atau minggu. Akibatnya, meskipun bahan awal memiliki relevansi fisiologis yang tinggi, sel-sel ini dapat dengan cepat mengalami de-diferensiasi, mendapatkan fungsionalitas dan viabilitas yang berkurang, yang dapat menghambat kegunaannya untuk aplikasi translasi. Sumber sel penting lainnya adalah sel punca yang memperbarui diri yang dapat dibedakan menjadi sel-sel khusus yang diinginkan (Zakrzewski et al. 2019 ). Sel punca dapat sangat berguna untuk mempelajari misalnya, perkembangan, jalur diferensiasi, dan penyakit tertentu, serta untuk memodelkan berbagai jaringan atau organ (Clevers 2016 ; Wu dan Izpisua Belmonte 2016 ). Sel punca multipotensi, seperti sel punca mesenkimal (MSC), dapat dibedakan menjadi sejumlah jenis sel terbatas, termasuk osteoblas, kondrosit, dan adiposit (Assis-Ribas et al. 2018 ; Dominici et al. 2006 ).
Selain jenis sel, metode kultur itu sendiri juga memainkan peran penting dalam membentuk fenotipe dan fungsi molekuler. Secara konvensional, sel-sel yang melekat dikultur sebagai lapisan tunggal pada permukaan dua dimensi (2D). Sementara banyak penemuan ilmiah telah dilakukan dengan menggunakan paradigma kultur ini, sel-sel yang dikultur 2D cepat memburuk dan berbeda secara substansial dari lingkungan fisiologis alami di mana sel-sel tumbuh dalam konteks tiga dimensi (3D) dan memiliki kontak dengan sel-sel lain dan matriks ekstraseluler (ECM) di sekitarnya (Jensen dan Teng 2020 ; Langhans 2018 ). Dengan demikian, metode kultur yang lebih kompleks dalam 3D dianggap perlu. Contoh penting yang menyoroti pentingnya metode kultur organotipik adalah hepatosit manusia primer (PHH), jenis sel yang paling umum di hati, yang memainkan peran penting dalam metabolisme obat, untuk mempelajari hepatotoksisitas dan memodelkan jenis penyakit hati lainnya. PHH sebelumnya dilaporkan kehilangan fungsi hati penting dan mengalami de-diferensiasi setelah hanya beberapa jam dalam kultur 2D (Lauschke et al. 2016 ), tetapi dapat dipertahankan selama berminggu-minggu dalam kultur 3D sebagai spheroid yang dirakit sendiri dengan fungsi hati yang dipertahankan (Bell et al. 2016 ).
Kultur sferoid merupakan metode yang digunakan secara luas yang memerlukan perakitan sendiri sel-sel yang tersusun menjadi struktur seperti bola, yang biasanya dibentuk dengan meningkatkan adhesi sel-ke-sel, misalnya, pada pelat perlekatan sangat rendah (Ingelman-Sundberg dan Lauschke 2022 ; Ryu et al. 2019 ). Sel-sel dalam sferoid bebas perancah memiliki kontak sel-ke-sel yang luas dan, tetapi terbatas, kontak sel-matriks yang disediakan semata-mata dari komponen ECM endogen yang diproduksi sendiri oleh sel-sel tersebut. Namun, pembentukan sferoid bebas perancah sering kali memerlukan optimalisasi kondisi kultur untuk memperoleh sferoid yang seragam (Langhans 2018 ). Beberapa tipe sel membentuk struktur longgar, sementara tipe sel lain, khususnya sel yang berproliferasi tinggi, membentuk sferoid yang lebih padat, yang, dengan peningkatan ukuran, akan membatasi difusi oksigen dan nutrisi ke pusat, sehingga menyebabkan hipoksia dan pembentukan inti nekrotik (Langhans 2018 ; Pinto et al. 2020 ). Oleh karena itu, sferoid diklaim mewakili jaringan dengan inti hipoksia alami, seperti model tumor (Chen et al. 2023 ; Langhans 2018 ; Petrova et al. 2018 ; Pinto et al. 2020 ). Namun, sebagian besar jaringan sehat normal mengandung ECM pendukung yang memungkinkan pengaturan yang kurang padat dan memiliki pembuluh darah yang diatur ketat dengan jaringan kapiler yang menyediakan oksigen dan nutrisi yang cukup untuk menjaga jaringan tetap hidup dan berfungsi (Asthana dan Kisaalita 2012 ).
Bahasa Indonesia: Untuk menghindari masalah yang disebutkan sebelumnya yang terkait dengan kultur spheroid sel yang berproliferasi, akan diinginkan untuk memiliki matriks peniru ECM yang memungkinkan kontak sel-matriks dan difusi oksigen dan nutrisi yang cukup ke inti sambil tetap mempertahankan konteks 3D dan kontak sel-sel yang bermanfaat. Pendekatan yang kami jelajahi di sini adalah untuk menggabungkan sel-sel yang dikultur 3D dalam jaringan seperti ECM yang terbuat dari protein sutra yang diproduksi secara rekombinan yang direkayasa untuk mengandung motif pengikatan sel yang mengandung RGD dari fibronektin (FN) (Widhe et al. 2016 ). Protein sutra FN yang dihasilkan adalah 23 kDa, dengan bagian sutra berasal dari urutan protein sutra dragline ampul utama spidroin 1 (Stark et al. 2007 ). FN-sutra dalam larutan merakit diri di antarmuka dalam kondisi fisiologis (Nilebäck et al. 2018 ), yang dapat digunakan untuk membentuk berbagai format FN-sutra seperti serat (Kvick et al. 2021 ), membran (Gustafsson et al. 2020 ; Hjelm et al. 2023 ; Tasiopoulos et al. 2021 ), dan jaringan (Åstrand et al. 2020 ; Collodet et al. 2023 ; Johansson et al. 2019 ) yang cocok sebagai matriks untuk kultur sel dalam berbagai aplikasi.
Kami sebelumnya telah melaporkan bahwa jaringan FN-silk dapat berhasil digunakan untuk membudidayakan beragam jenis sel termasuk misalnya, sel punca pluripoten (Åstrand et al. 2020 ; Fiorenzano et al. 2021 ), MSC (Johansson et al. 2019 ), lini sel kanker payudara, dan sel tumor kanker payudara primer (Collodet et al. 2023 ). Lebih jauh lagi, sel telah terbukti berkembang biak dan menempel pada jaringan FN-silk dengan morfologi sel yang memanjang, titik adhesi fokal yang jelas, dan viabilitas sel yang tinggi untuk periode kultur yang panjang (Johansson et al. 2019 ). Selain itu, diferensiasi sel punca pluripoten yang sukses menjadi garis keturunan neuronal (Åstrand et al. 2020 ) dan organoid otak (Fiorenzano et al. 2021 ; Sozzi et al. 2022 ) yang didukung oleh jaringan FN-silk telah dijelaskan, demikian pula diferensiasi MSC menjadi garis keturunan adipogenik dan osteogenik (Johansson et al. 2019 ; Widhe et al. 2022 ). Analisis reologi jaringan FN-silk yang lebih besar telah menunjukkan bahwa perancah menunjukkan elastisitas tegangan geser yang tinggi dan kapasitas mencolok untuk mempertahankan integritas struktural dalam kondisi beban dinamis (Gkouma et al. 2024 ). Bahkan setelah kultur In Vitro yang lebih lama, hingga 4 bulan, tidak terlihat tanda-tanda degradasi struktur FN-sutra (Johansson et al. 2019 ; Sozzi et al. 2022 ), kemungkinan karena struktur kaya β-sheet dari urutan protein sutra tidak memiliki lokasi khas untuk degradasi proteolitik (Hedhammar et al. 2008 ).
Di sini, kami menyajikan protokol yang diperbarui dan mudah digunakan untuk memproduksi jaringan FN-silk yang mengambang bebas dalam format 96-well untuk penanganan kultur 3D sel manusia yang melekat secara sederhana dalam beberapa replikasi. Di sini kami telah mengkarakterisasi sel yang tumbuh dalam jaringan tersebut berkenaan dengan morfologi, viabilitas sel, dan diferensiasi. Jaringan FN-silk yang mengambang bebas memberikan viabilitas sel punca yang baik selama ekspansi serta periode kultur yang lebih lama yang dibutuhkan untuk diferensiasi. Selain itu, kami menunjukkan bahwa format FN-silk baru ini dapat meningkatkan pelestarian fenotipe dan fungsi spesifik sel manusia primer dalam kultur jangka panjang, dengan menggunakan PHH sebagai contoh.
2 Hasil dan Pembahasan
2.1 Jaringan FN-Silk Dengan Sel Membentuk Kultur 3D Mengambang Bebas
Jaringan FN-sutra dibuat dengan memasukkan gelembung udara ke dalam larutan FN-sutra. Hal ini menghasilkan pembentukan busa dengan membran FN-sutra yang sangat tipis di sekitar setiap gelembung udara (Gambar 1a ). Seiring waktu, membran FN-sutra ini pecah dan menggulung menjadi serat tipis yang menciptakan jaringan 3D. Jaringan FN-sutra yang dihasilkan meniru serat interstisial ECM karena dimensi yang serupa (Gambar 1a ), mekanika (Gkouma et al. 2024 ), dan dekorasi dengan motif adhesi sel yang berasal dari fibronektin (Johansson et al. 2019 ). Sel yang melekat dapat langsung diintegrasikan ke dalam jaringan hanya dengan menambahkan suspensi sel ke FN-sutra yang larut sebelum berbusa. Integrasi sel bersamaan ini selama perakitan FN-sutra memberikan distribusi sel yang homogen di seluruh perancah (Collodet et al. 2023 ; Johansson et al. 2019 ). Selain itu, FN-silk dapat dengan mudah dikombinasikan dengan komponen ECM alami lainnya, seperti laminin, dengan memasukkannya ke dalam suspensi FN-silk/sel selama pembusaan (Åstrand et al. 2020 ). Di sini kami telah menggunakan prinsip ini untuk mengembangkan protokol baru untuk kultur sel 3D dalam jaringan FN-silk yang mengambang bebas di pelat 96-sumur (Gambar 1b ).

Untuk mengkarakterisasi morfologi makroskopis dan mikroskopis, jaringan FN-sutra dengan sel punca mesenkimal manusia (hMSC) disiapkan dan dikultur selama 7 hari. Seperti yang terlihat dari gambar mikroskop stereo (Gambar 1c , yang sesuai untuk mMSC dalam Informasi Pendukung S1: Gambar S1b ), busa FN-sutra dengan hMSC secara bertahap ditransformasikan seiring waktu. Pada Hari ke-1, FN-sutra muncul sebagai busa mengambang, masih dengan beberapa gelembung yang dikelilingi oleh membran FN-sutra tipis (Gambar 1c ). Saat semakin banyak membran FN-sutra yang pecah, serat tipis diamati, terbentuk dari membran yang pecah dan tergulung, dan bersama-sama menghasilkan jaringan fibrilar (Hari ke-2–3, diilustrasikan dalam Gambar 1a ). Seiring waktu, saat sel terus tumbuh, kultur 3D dengan jaringan FN-sutra menjadi lebih berbentuk bulat (Gambar 1c , Hari ke-4–7). Waktu yang dibutuhkan untuk transformasi ini bervariasi dengan kondisi kultur yang berbeda seperti dengan jenis sel, jumlah penyemaian sel, dan jumlah perjalanan sel (yaitu, laju pembelahan sel). Sebaliknya, ketika hMSC dikultur sebagai spheroid bebas perancah (Informasi Pendukung S1: Gambar S1 ), struktur padat terbentuk dari awal (hari 1) dan menjadi lebih kecil dan tampak lebih padat seiring waktu (Hari 3 dan Hari 7) (Informasi Pendukung S1: Gambar S2 ). Pada Hari 7, kultur 3D yang didukung FN-sutra lebih besar dan tampak memiliki struktur internal yang kurang padat, dibandingkan dengan spheroid bebas perancah yang disemai dengan jumlah sel yang sama (Gambar 1d ). Kami berhipotesis bahwa struktur yang kurang padat ini kemungkinan memungkinkan difusi oksigen dan nutrisi yang lebih baik ke inti dalam, dan memberikan representasi yang lebih baik dari morfologi jaringan alami, dibandingkan dengan spheroid bebas perancah yang lebih padat. Dimensi akhir jaringan FN-sutra tampaknya ditentukan oleh beberapa faktor. Pertama-tama, jumlah sel yang disemai dan jumlah FN-silk yang digunakan, tetapi juga ukuran dan bentuk vial (dalam kasus ini 96 pelat berbentuk U) tempat busa dibuat dan distabilkan, memengaruhi hasilnya. Sifat jenis sel, misalnya, laju pertumbuhan, morfologi, dan kecenderungan adhesi pada serat FN-silk juga tampaknya menentukan dimensi yang dihasilkan. Untuk beberapa jenis sel, misalnya, mMSC, kami telah mengamati perilaku perubahan bentuk kultur jaringan FN-silk (Informasi Pendukung S1: Gambar S3b ). Ini mungkin dapat digunakan dalam aplikasi di mana material perlu beradaptasi dengan rongga tertentu atau dalam sistem biologis yang lebih kompleks (Mirzababaei et al. 2024). Secara keseluruhan, kultur 3D yang dihasilkan dalam jaringan FN-silk memang sedikit bervariasi dalam hal detail, meskipun ukuran dan bentuk keseluruhannya dapat diprediksi. Kami menganggap hal ini lebih mendekati kondisi biologis, dibandingkan dengan dimensi pasti perancah prafabrikasi.
2.2 Pilihan Protokol untuk Penambahan Sel dan Penghapusan Gelembung Udara
Strategi utama kami adalah menghadirkan sel-sel dalam campuran FN-silk selama pembusaan, untuk segera mendapatkan sel-sel yang terdistribusi dengan baik dalam kultur akhir. Namun, sel-sel juga dapat ditambahkan ke FN-silk langsung setelah pembusaan jika diinginkan, misalnya, untuk sel-sel yang sangat sensitif. Ini dapat dilakukan dengan membuang medium setelah pelepasan busa awal, dan menaburkan sel-sel di atas busa dalam volume medium kecil (misalnya, 5 µL), diikuti dengan inkubasi untuk memungkinkan sel-sel menempel dengan benar sebelum menambahkan medium baru. Untuk MSC yang dianalisis di sini, prosedur pembusaan tampaknya tidak berbahaya dari perspektif viabilitas, mengingat viabilitas sel yang baik untuk hMSC yang ditambahkan sebelum pembusaan, yang dijelaskan dalam Bagian 2.4 . Selain itu, pewarnaan Hidup/Mati yang membandingkan mMSC yang disemai sebelum dan sesudah pembusaan (Informasi Pendukung S1: Gambar S3b ) tidak menunjukkan perbedaan yang jelas dalam kematian sel. Mungkin, penambahan sel setelah pembusaan dapat menyebabkan distribusi sel yang lebih heterogen dalam kultur 3D, atau penangkapan sel yang kurang efisien ke dalam jaringan, yang terakhir dapat diatasi dengan meningkatkan jumlah penyemaian.
Busa sutra FN secara alami berubah menjadi jaringan ketika membran pecah dan melepaskan gelembung udara, suatu proses yang biasanya memakan waktu 2-3 hari untuk diselesaikan. Khususnya untuk kultur jangka pendek, di mana struktur awal penting, mungkin diinginkan bahwa gelembung menghilang sesegera mungkin. Dengan demikian, kami telah menyelidiki berbagai cara untuk melepaskan gelembung udara, dan dengan demikian mempercepat pembentukan struktur jaringan akhir. Salah satu strategi adalah melakukan langkah pencucian (dengan misalnya, PBS) diikuti oleh penggantian media selama hari-hari kultur pertama, yang mendorong penghilangan, atau setidaknya penyusutan, gelembung udara dalam jaringan (Informasi Pendukung S1: Gambar S4a ). Ini adalah metode langsung yang dapat dengan mudah diimplementasikan. Kami juga telah melihat indikasi bahwa pengocokan ringan (95 rpm) selama inkubasi menghasilkan beberapa penghilangan gelembung udara (Informasi Pendukung S1: Gambar S4b ). Selain itu, seperti yang dilaporkan sebelumnya oleh Collodet et al. untuk busa FN-silk dengan garis sel kanker payudara yang dibuat dalam pelat 24-sumur, gelembung udara dapat dihilangkan dengan menerapkan perbedaan tekanan pada busa menggunakan tutup cetak 3D dan sistem aspirasi Vacusafe (Collodet et al. 2023 ). Mengulangi pendekatan ini pada busa dengan mMSC menunjukkan beberapa efek pada penghilangan gelembung udara, dan juga menghasilkan jaringan yang lebih homogen, tetapi lebih datar (Informasi Pendukung S1: Gambar S4c ). Teknik untuk penghilangan gelembung udara yang dijelaskan di sini bersifat opsional, dan tidak disertakan dalam eksperimen yang disajikan di sini.
2.3 Sel yang Tumbuh di Jaringan FN-Silk Menunjukkan Morfologi Memanjang Sepanjang Serat FN-Silk
Untuk menganalisis morfologi internal lebih lanjut, hMSC dikultur dalam jaringan FN-silk dan sebagai spheroid untuk berbagai titik waktu sebelum fiksasi dan pewarnaan untuk F-actin dan nuklei. Untuk memvisualisasikan FN-silk, sebagian kecil FN-silk berlabel fluoresensi disertakan dalam jaringan. Pencitraan dengan mikroskopi confocal menunjukkan bahwa jaringan FN-silk tampaknya sebagian besar terdiri dari serat dan lembaran tipis, dan bahwa sel-sel tumbuh dengan morfologi memanjang sepanjang FN-silk, tetapi masih terhubung satu sama lain (Gambar 2a ). Ini menunjukkan adanya kontak sel-matriks dan sel-sel dalam kultur jaringan FN-silk, mirip dengan sel yang tumbuh di lingkungan ECM alami. Selain itu, masih ada beberapa ruang tersisa untuk ekspansi sel lebih lanjut selama 2 hari pertama kultur. Sekitar Hari ke-3, kultur dalam FN-silk menunjukkan konfluensi sel yang tinggi, dengan lebih sedikit ruang kosong yang tersisa (Gambar 2a , panel kanan). Sebaliknya, spheroid telah membentuk struktur sel padat pada Hari 1, tampaknya dengan sel yang lebih bulat dibandingkan dengan jaringan, karena tidak ada sel memanjang yang dapat terlihat di bagian dalam kultur (Gambar 2b ). Hal ini sesuai dengan laporan sebelumnya yang menunjukkan bahwa spheroid hMSC bebas perancah sebagian besar memiliki sel bulat dan tidak beraturan di bagian dalam, dan beberapa sel pipih dan memanjang di permukaan (Bartosh et al. 2010 ; Sart et al. 2014 ).
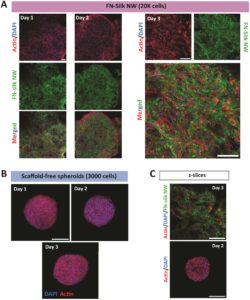
Keuntungan praktis yang penting dari jaringan FN-silk dibandingkan dengan spheroid bebas perancah konvensional adalah penanganan yang disederhanakan selama kultur. Perubahan medium secara lengkap dapat dilakukan dengan relatif mudah dalam pelat kultur dasar datar standar tanpa merusak kultur. Hal ini biasanya sangat sulit untuk spheroid bebas perancah karena ukurannya yang kecil dan kerapuhannya, dan memerlukan penggunaan misalnya, perubahan medium setengah volume, pelat khusus yang mahal atau metode lain untuk memudahkan penanganan. Selain itu, pembentukan kultur 3D dengan pendekatan jaringan FN-silk tidak bergantung pada jenis sel seperti pada metode bebas perancah, di mana beberapa jenis sel membentuk spheroid kompak sementara jenis sel lainnya dapat membentuk agregat yang sangat longgar yang hampir tidak dapat menyatu. Baik MSC tikus maupun manusia, dengan jumlah lintasan yang bervariasi (22–36 untuk mMSC, 3–9 untuk hMSC) dan kepadatan penyemaian (10.000–20.000) telah berhasil diintegrasikan ke dalam jaringan FN-sutra dan membentuk kultur 3D yang koheren, meskipun dengan sedikit variasi pada kepadatan kultur tersebut.
2.4 Jaringan FN-Silk Mendukung Proliferasi dan Viabilitas Tinggi
Viabilitas hMSC yang dikultur dalam jaringan FN-silk dinilai dan dibandingkan dengan spheroid bebas perancah menggunakan uji aktivitas metabolik CellTiter-Glo, yang secara khusus dikembangkan untuk kultur 3D, dan pewarnaan fluoresensi hidup/mati. Analisis 3D CellTiter-Glo (Gambar 3a ) menunjukkan bahwa aktivitas metabolik hMSC yang dikultur dalam jaringan FN-silk meningkat dari Hari ke-1 hingga Hari ke-3, diikuti oleh dataran tinggi atau sedikit penurunan untuk jaringan yang disemai dengan 10.000 atau 20.000 sel, masing-masing. Ini menunjukkan fase proliferatif selama hari-hari pertama, yang melambat ketika kepadatan sel tinggi tercapai dalam jaringan FN-silk sekitar Hari ke-3. Ini sejalan dengan mikrograf yang dijelaskan (Gambar 2 ), di mana ruang yang tersedia untuk pertumbuhan sel diamati pada Hari ke-1 dan ke-2, sementara konfluensi yang lebih tinggi terlihat pada Hari ke-3. Sebaliknya, spheroid bebas perancah memiliki aktivitas metabolik yang relatif konstan selama 4 hari pertama kultur, baik untuk 3000 dan 10.000 sel/sumur, yang menunjukkan aktivitas proliferatif yang rendah atau tidak ada dan penurunan viabilitas sel tanpa adanya FN-silk. Perubahan metabolik serupa selama kultur 3D diamati dengan sel punca mesenkimal tikus (mMSC) (Informasi Pendukung S1: Gambar 3a ). Di sini, peningkatan empat kali lipat dalam konsentrasi ATP diamati dari Hari ke-1 hingga Hari ke-4 untuk mMSC yang tumbuh dalam jaringan FN-sutra, sementara spheroid malah menunjukkan penurunan yang nyata dalam aktivitas metabolisme, bahkan ketika hanya 3000 sel per sumur yang digunakan.
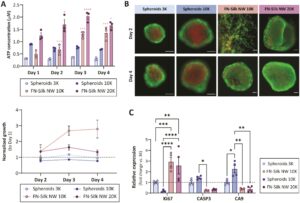
Khususnya, aktivitas metabolisme hMSC setelah penyemaian 10.000 sel per jaringan FN-silk secara signifikan lebih rendah (* p < 0,05) pada hari ke-1 dibandingkan dengan spheroid dari jumlah sel yang sama. Pengamatan ini menunjukkan bahwa beberapa sel mungkin hilang selama langkah pembusaan. Sebaliknya, untuk mMSC, aktivitas metabolisme dalam jaringan FN-silk lebih tinggi (* p < 0,05) pada Hari ke-1 dibandingkan dengan spheroid yang disemai dengan jumlah sel yang sama. Perbedaan antara jenis sel yang berbeda ini kemungkinan besar disebabkan oleh tingkat proliferasi mMSC yang lebih tinggi dalam jaringan atau sifat khusus jenis sel lainnya, seperti kecenderungan untuk melekat, atau komponen media yang berbeda yang dapat memengaruhi efisiensi penangkapan sel dalam jaringan FN-silk.
Sebagai pelengkap pengukuran aktivitas metabolik, pewarnaan Hidup/mati dilakukan pada beberapa titik waktu setelah penyemaian. Di sini juga, viabilitas sel yang unggul terlihat pada jaringan FN-silk dibandingkan dengan spheroid (Gambar 3b ). Sementara spheroid bebas perancah menunjukkan inti dengan sel mati pada Hari ke-2, terutama pada jumlah penyemaian yang lebih tinggi, kultur yang didukung FN-silk menunjukkan viabilitas tinggi dengan hanya beberapa sel mati yang ada pada Hari ke-2 dan Hari ke-4, terlepas dari jumlah penyemaian awal. Tiga dimensi kultur membuat pencitraan menjadi menantang, karena tidak mungkin untuk fokus pada semua sel pada saat yang sama. Namun, setelah analisis mikroskopi yang cermat dengan fokus yang berbeda, tidak adanya inti nekrotik dalam jaringan sutra FN terlihat jelas, terlepas dari hari kultur maupun kepadatan kultur, yang menunjukkan bahwa bahkan dalam kultur jaringan sutra FN yang lebih padat, pasokan oksigen dan nutrisi harus mencukupi juga ke sel-sel bagian dalam, yang seharusnya disediakan oleh keberadaan serat sutra FN di seluruh kultur 3D.
Untuk menyelidiki perbedaan dalam viabilitas sel dalam jaringan FN-silk dan spheroid lebih dekat, qPCR dilakukan dengan penanda untuk apoptosis, hipoksia dan proliferasi pada Hari kultur ke-2 dan ke-3 (Gambar 3c ). Hasilnya menunjukkan ekspresi yang signifikan lebih tinggi untuk penanda proliferasi Ki67 untuk sel dalam jaringan FN-silk dibandingkan dengan spheroid bebas perancah. Selain itu, ekspresi penanda apoptosis CASP3 dan penanda hipoksia CA9 secara signifikan lebih tinggi ( p ≤ 0,05 dan 0,01 berturut-turut) dalam spheroid bebas perancah yang awalnya ditanami dengan 10.000 sel dibandingkan dengan kultur FN-silk. Dengan demikian, hasil ini lebih lanjut mendukung hipotesis kami bahwa struktur 3D yang kurang padat yang disediakan oleh FN-silk, mungkin bersama dengan sifat jaringan FN-silk yang mengambang bebas, membantu meningkatkan pasokan oksigen, meningkatkan akses ke nutrisi dalam media kultur, dan memfasilitasi pertukaran karbon dioksida dan limbah seluler. Akibatnya, viabilitas di seluruh kultur 3D ditingkatkan dalam jaringan FN-silk. Alasan peningkatan viabilitas sel yang terlihat dalam jaringan FN-silk dibandingkan dengan spheroid bebas perancah kemungkinan besar adalah aksesibilitas oksigen dan nutrisi yang lebih baik ke inti dalam kultur yang telah ditunjukkan sebelumnya (Sozzi et al. 2022 ).
Sifat-sifat bermanfaat yang ditemukan sejauh ini mendorong kami untuk terus menyelidiki dua kemungkinan aplikasi jaringan FN-sutra yang mengambang bebas, yaitu diferensiasi sel punca dan kultur hepatosit.
2.5 Jaringan FN-Silk Mendukung Diferensiasi Adipogenik hMSC
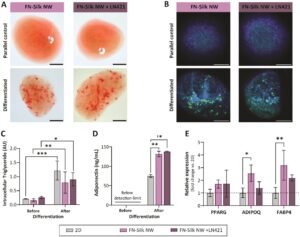
Untuk mengevaluasi apakah format kultur jaringan FN-silk yang disajikan dapat mendukung diferensiasi sel punca manusia, kami memutuskan untuk menguji apakah hMSC multipoten yang dikultur dalam jaringan FN-silk dapat dibedakan menjadi adiposit dengan mengkultur jaringan dalam medium diferensiasi adipogenik. Karena laminin dengan rantai α4, seperti LN411 dan LN421, telah terbukti meningkat selama diferensiasi adipogenik dan hadir dalam ECM yang mengelilingi adiposit dewasa (Noro et al. 2013 ; Vaicik et al. 2014 ), kami memutuskan untuk memasukkan LN421 dalam jaringan FN-silk, sebagai kondisi tambahan, untuk menyelidiki apakah kehadirannya akan memiliki efek positif pada proses diferensiasi. Penambahan laminin sebelumnya telah terbukti tidak memengaruhi kemampuan FN-silk untuk membentuk jaringan dengan sel-sel terintegrasi (Åstrand et al. 2020 ). Kami pertama-tama menentukan waktu kultur yang diperlukan bagi sel untuk mencapai kepadatan yang tepat dalam kultur jaringan FN-silk. Untuk kultur 2D, konfluensi 80%–90%, yang direkomendasikan oleh produsen medium diferensiasi (PromoCell) untuk induksi adipogenesis, digunakan. Untuk kultur 3D, lebih menantang untuk menentukan konfluensi. Oleh karena itu, kami malah menggunakan hasil CellTiter-Glo 3D, bersama dengan pewarnaan F-actin dan DAPI dari hMSC yang tumbuh dalam jaringan. Terbukti dari data ini, sel-sel terisi di seluruh jaringan FN-silk pada Hari ke-3 (Gambar 2 ), yang menunjukkan kontak sel-ke-sel yang tepat. Selain itu, sel-sel mencapai puncak aktivitas metabolik sekitar Hari ke-3 (Gambar 3a ), yang menunjukkan konfluensi yang tinggi. Berdasarkan hal ini, diferensiasi dimulai pada Hari ke-3 (Gambar 4 dan Informasi Pendukung S1: Gambar S5 ) atau Hari ke-4 (Informasi Pendukung S1: Gambar S6a ) untuk kultur FN-silk yang disemai dengan 20.000 sel. Namun, sifat-sifat seperti laju proliferasi dapat bervariasi antara kelompok sel dan lintasan, yang berarti bahwa titik awal untuk induksi diferensiasi mungkin memerlukan penyesuaian.
Setelah periode diferensiasi yang panjang selama 3 minggu, empat jenis analisis digunakan untuk menilai apakah hMSC telah berhasil didiferensiasi menjadi adiposit dalam jaringan FN-silk dan kontrol 2D; pewarnaan tetesan lipid, kuantifikasi trigliserida, kuantifikasi adiponektin yang disekresikan dengan ELISA, dan analisis ekspresi penanda adipogenik. Selain itu, viabilitas kultur 3D dinilai menggunakan CellTiter-Glo 3D dan pewarnaan Hidup/Mati (Informasi Pendukung S1: Gambar S5 ). Analisis CellTiter-Glo menunjukkan bahwa kurang dari 5% aktivitas metabolik spheroid (3000 hMSC) tetap ada setelah 20 hari diferensiasi dibandingkan dengan awal diferensiasi, sementara jumlah yang sesuai untuk jaringan di atas 25%. Pewarnaan Hidup/Mati mengonfirmasi bahwa sel-sel dalam spheroid sebagian besar mati, sementara sel-sel dalam jaringan FN-silk masih memiliki viabilitas yang relatif baik juga pada akhir periode diferensiasi. Karena viabilitas yang sangat rendah selama waktu kultur yang dibutuhkan, dan kesulitan dalam penanganan selama kultur dan analisis, spheroid bebas perancah dikeluarkan dari percobaan diferensiasi lebih lanjut.
Adiposit dapat dengan mudah dibedakan secara morfologis dengan adanya tetesan lipid intraseluler untuk penyimpanan trigliserida. Pewarnaan tetesan lipid menggunakan pewarna lipid Oil Red O (Gambar 4a ) dan Bodipy (Gambar 4b ) dengan demikian dilakukan pada sampel yang berdiferensiasi dan pada kontrol paralel yang dikultur dalam media pertumbuhan. Tetesan lipid diamati dalam sel yang didukung FN-silk setelah diferensiasi, tetapi tidak pada kontrol paralel. Tetesan tersebut terdeteksi di seluruh struktur 3D dalam berbagai ukuran dan jumlah. Penampakan serupa diamati untuk jaringan FN-silk dengan LN421 tambahan (Gambar 4a,b , Informasi Pendukung S1: Gambar S6a ). Sel yang berdiferensiasi pada 2D juga memiliki beberapa tetesan lipid, meskipun ukurannya tampak lebih kecil, dan hanya ada di beberapa area lapisan tunggal (Informasi Pendukung S1: Gambar S6b,c ).
Untuk mengukur lebih lanjut keberadaan trigliserida intraseluler, uji AdipoRed digunakan untuk menganalisis kadar trigliserida dalam suspensi sel dari kultur tripsinasi dalam jaringan FN-sutra dan 2D (Gambar 4c ). Hasilnya menunjukkan peningkatan signifikan dalam kadar trigliserida setelah diferensiasi sel yang dikultur baik dalam jaringan FN-sutra maupun sebagai lapisan tunggal, dibandingkan dengan sebelum diferensiasi. Tidak ada perbedaan signifikan yang diamati antara format kultur yang berbeda, atau dengan penambahan LN421. Namun, perbandingan antara format kultur harus dianggap semi-kuantitatif karena penyesuaian protokol diperlukan untuk melepaskan sel dari jaringan FN-sutra, yang dapat menambah ketidakpastian pada nilai yang diukur. Hasilnya masih menunjukkan peningkatan kadar trigliserida setelah diferensiasi adipogenik dalam format kultur yang diselidiki, mendukung keberadaan adiposit yang dijelaskan di atas.
Ciri penting lain dari adiposit dewasa adalah kemampuannya untuk mengeluarkan hormon Adiponektin, yang dapat diukur dari kultur supernatan. Sampel yang dikumpulkan sebelum diferensiasi berada di bawah tingkat deteksi, sedangkan peningkatan yang nyata dapat dideteksi untuk semua kondisi kultur setelah diferensiasi adipogenik (Gambar 4d ). Karena adiponektin diproduksi secara spesifik oleh jaringan adiposa (Martella et al. 2014 ), keberadaan adiponektin yang disekresikan menunjukkan bahwa diferensiasi adipogenik telah terjadi untuk semua format. Meskipun jumlah total sel yang ada dalam setiap format kultur tidak dikontrol, konsentrasi adiponektin yang secara signifikan lebih tinggi yang terdeteksi dalam supernatan dari kultur FN-silk yang terdiferensiasi, dibandingkan dengan lapisan tunggal ( p ≤ 0,01), merupakan indikasi diferensiasi yang berhasil dalam jaringan FN-silk, dengan atau tanpa LN421.
Akhirnya, analisis ekspresi mRNA menggunakan qPCR, mendeteksi penanda adipogenik PPARG, ADIPOQ dan FABP4 dalam sel yang berdiferensiasi dalam jaringan FN-silk atau sebagai lapisan tunggal (Gambar 4e ). Ekspresi ADIPOQ dan FABP4 secara signifikan lebih tinggi untuk sel dalam jaringan FN-silk tanpa LN421 dibandingkan dengan kontrol 2D ( masing-masing p ≤ 0,05 dan p ≤ 0,01). Timbulnya gen-gen ini merupakan tanda yang jelas dari diferensiasi adipogenik, dan hasilnya juga menunjukkan bahwa proses diferensiasi lebih efisien dalam kultur jaringan FN-silk, dibandingkan dengan lapisan tunggal standar.
Secara keseluruhan, temuan kami menunjukkan bahwa protokol jaringan FN-silk yang dikembangkan dapat mendukung diferensiasi adipogenik hMSC. Selain itu, diferensiasi tampaknya lebih efisien dibandingkan dengan kultur 2D konvensional dan memberikan viabilitas yang jauh lebih tinggi dibandingkan dengan spheroid bebas perancah.
2.6 Jaringan FN-Silk Mendukung Pemeliharaan Jangka Panjang Kultur Fungsional 3D Besar Hepatosit Manusia Primer
Berikutnya, kami menilai kultur hepatosit manusia primer (PHH) dalam jaringan FN-silk, sebagai representasi dari tipe sel manusia primer yang sangat sensitif. Dengan pendekatan ini, kami juga ingin menyelidiki apakah kultur 3D dalam FN-silk dapat membantu melestarikan fitur kunci hepatosit yang cepat hilang selama kultur 2D standar PHH (Lauschke et al. 2016 ). Kami mengevaluasi PHH baik secara morfologis maupun fungsional selama 7 hari dalam kultur dan membandingkan kinerjanya dengan lapisan tunggal 2D standar dan kultur sferoid bebas perancah 3D yang berkarakterisasi dengan baik (Bell et al. 2017 ; 2018; Vorrink et al. 2017 ). Titik waktu 7 hari dipilih karena investigasi sebelumnya menggunakan PHH telah menunjukkan bahwa 7 hari dalam kultur diperlukan untuk agregasi menjadi spheroid (Bell et al. 2017 , 2018 ; Vorrink et al. 2017 ), meskipun jaringan FN-sutra terbentuk segera dan umumnya mencapai keadaan stabil tanpa gelembung yang tersisa beberapa hari setelah penyemaian (lihat bagian 2.3 dan 2.4 ). Kultur PHH dalam FN-sutra (~ 15.000 sel/jaringan) menghasilkan jaringan yang longgar dan saling berhubungan dengan ukuran yang konsisten, memungkinkan difusi nutrisi dan oksigen yang efisien ke semua sel. Setelah 1 minggu dalam kultur, gugus sel yang terbentuk menunjukkan morfologi homogen dengan batas sel yang jelas dan tidak ada nekrosis yang nyata (Gambar 5a ).
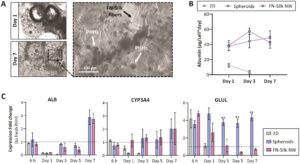
Selama kultur, sel-sel di kedua jaringan FN-sutra dan spheroid bebas perancah mengalami pemadatan karena peningkatan kontak sel-ke-sel, yang berkorelasi dengan peningkatan fungsionalitas seperti yang dilaporkan sebelumnya (Oliva-Vilarnau et al. 2020 ). Fungsionalitas spesifik hepatosit dinilai dengan mengukur sekresi albumin, yang tetap stabil untuk sel-sel di kedua jaringan FN-sutra dan spheroid bebas perancah selama periode kultur 7 hari (Gambar 5b ). Sebaliknya, hepatosit yang dikultur dalam satu lapis 2D dengan cepat mengalami de-diferensiasi, sebagaimana dibuktikan oleh penurunan tajam dalam sekresi albumin setelah 24 jam kultur.
Kami selanjutnya mengevaluasi tingkat ekspresi mRNA dari penanda fungsional utama, termasuk faktor hati yang disekresikan ( ALB ), enzim metabolisme obat (CYP3A4), dan gen glutamin sintetase peka oksigen (GLUL) (Halpern et al. 2017 ; Tonon et al. 2019 ). PHH dalam jaringan FN-sutra menunjukkan pola ekspresi yang sama dengan spheroid bebas perancah untuk ALB dan CYP3A4 selama kultur 7 hari (Gambar 5c ). Namun, ekspresi GLUL secara signifikan lebih rendah untuk PHH dalam jaringan FN-sutra sejak Hari ke-3, saat jaringan stabil dan gelembung udara dari busa hilang. Yang penting, ekspresi GLUL diekspresikan secara tinggi hanya pada hepatosit perisentral (Ben-Moshe dan Itzkovitz 2019 ), yang menunjukkan bahwa sel-sel dalam spheroid bebas perancah mengalami tekanan oksigen parsial (pO₂) yang lebih rendah dibandingkan dengan sel-sel dalam jaringan FN-silk, yang mempertahankan pasokan nutrisi yang cukup meskipun ukurannya jauh lebih besar. Hal ini mengejutkan, karena spheroid hati yang terdiri dari lebih dari 10.000 sel biasanya menunjukkan penurunan cepat dalam kesehatan sel dan pembentukan inti nekrotik, kemungkinan karena terbatasnya pasokan oksigen dan nutrisi. Akibatnya, hasil ini menunjukkan bahwa jaringan FN-silk mendukung pembentukan struktur 3D yang lebih besar di mana PHH tetap teroksigenasi dengan baik selama 7 hari, kemungkinan karena strukturnya yang mudah diakses, longgar, dan mengambang. Sistem ini mempertahankan fenotipe seluler asli pada tingkat yang lebih tinggi dibandingkan dengan kultur monolayer konvensional, dan sel-sel primer yang dikultur mempertahankan fungsionalitas fisiologisnya mirip dengan kondisi In Vivo. Selain itu, dengan memberikan peluang untuk mengarahkan fenotipe hepatosit ke arah identitas perisentral, jaringan FN-sutra mungkin berguna untuk menilai distribusi fungsi hepatosit di berbagai zona (Wesseler et al. 2023 ).
3 Kesimpulan
Di sini kami menunjukkan viabilitas sel, proliferasi, dan diferensiasi yang tinggi dari berbagai jenis sel dalam kultur 3D yang mengambang bebas yang didukung oleh jaringan FN-silk. Secara khusus, jaringan ini terbukti mendukung diferensiasi sel induk manusia dalam 3D dan terbukti cocok untuk kultur jangka panjang hepatosit manusia primer dengan fenotipe dan fungsi molekuler yang matang.
Dibandingkan dengan spheroid bebas perancah, prosedur untuk membuat jaringan FN-silk dengan sel terintegrasi memerlukan beberapa langkah tambahan (pipetting, inkubasi, penambahan media, dan pemindahan ke sumur baru), yang memerlukan sedikit waktu ekstra selama fase persiapan dan mungkin memerlukan beberapa pelatihan praktis untuk hasil yang dapat direproduksi. Namun, setelah terbentuk, kultur jaringan FN-silk stabil dan mudah ditangani selama penggantian media, dsb. Analisis lebih lanjut, seperti prosedur pewarnaan, penyisipan, dan sebagainya, dengan demikian jauh lebih mudah dibandingkan saat bekerja dengan spheroid bebas perancah. Di sini, kami menggunakan pelat 96 sumur untuk kultur 3D, yang disiapkan menggunakan multipipet 8 saluran. Protokol ini juga telah diadaptasi ke pelat 384 sumur, tetapi kultur 3D yang lebih kecil dari itu sulit disiapkan dengan jaringan FN-silk, karena prosedur ini memerlukan pembentukan gelembung udara. Agar kultur jaringan FN-silk mencapai titik pertemuan yang sesuai, rasio sel tertentu perlu disemai, bahkan untuk volume kultur yang lebih kecil. Namun, sel dalam jaringan FN-silk yang mengambang bebas memiliki akses yang baik ke media dan oksigen, yang menjamin kelangsungan hidup juga untuk kepadatan penyemaian yang lebih tinggi daripada yang biasanya digunakan untuk spheroid bebas perancah, yang terletak di dasar sumur.
Secara keseluruhan, penelitian kami menunjukkan bahwa jaringan FN-silk memungkinkan kultur dengan hasil tinggi dalam pelat yang tersedia secara komersial, menghasilkan konstruksi jaringan rekayasa 3D yang bebas dan layak. Dengan demikian, penelitian ini mendukung penerapan dan kegunaan jaringan FN-silk yang luas baik dalam hal diferensiasi sel punca, maupun dalam mempertahankan fungsi seluler sel primer khusus dalam pengaturan 3D, yang mana penting untuk menjaga viabilitas tinggi di seluruh kultur, menghindari hipoksia dan pembentukan inti nekrotik.
4 Bahan dan Metode
Rincian lengkap tersedia dalam informasi tambahan, termasuk Tabel Tambahan 1 dan Informasi Pendukung S1: Gambar S1–S6 .
4.1 Format Budaya
4.1.1 Kultur Jaringan Sutra FN
Jaringan FN-silk disiapkan (Gambar 1 ) dengan mencampur FN-silk yang dapat larut (3 mg/mL dalam PBS, batch penelitian dengan kemurnian 90%–95%, Spiber Technologies) dengan suspensi sel yang baru disiapkan. Untuk menghindari mikrosfer/agregat sutra, larutan FN-silk disentrifugasi pada kecepatan maksimum (∼20.000 RCF) selama 3 menit sebelum menambahkan sel. Konsentrasi akhir FN-silk sebesar 2 mg/mL dan konsentrasi sel sebesar 2000, 3000 atau 4000 sel/µL digunakan dalam campuran untuk mendapatkan 10.000, 15.000 atau 20.000 sel per busa. Untuk jaringan yang akan digunakan dalam studi morfologi dengan pencitraan mikroskopis fluoresensi, 5% FN-silk yang diberi label sebelumnya dengan DyLight-488 ditambahkan ke dalam campuran. Untuk jaringan dalam percobaan diferensiasi, laminin rekombinan manusia 421 (LN421, BioLamina) ditambahkan ke konsentrasi akhir 10 µg/mL dalam campuran sel sutra. Media kultur digunakan untuk pengenceran. Satu tetes kecil campuran sel sutra FN 5 µL ditambahkan ke setiap sumur dalam satu kolom pelat 96 sumur dengan sambungan sangat rendah (ULA) U-bottom (Nunclon Sphera 174929) menggunakan pipet saluran tunggal. Setiap tetes kemudian diubah menjadi busa sutra FN padat dengan sel terintegrasi dengan pipet cepat menggunakan pipet multisaluran (sekitar 30 sapuan, sekitar 2–3 sapuan/detik). Prosedur pembusaan ini diulang untuk setiap kolom untuk membuat jumlah busa yang diinginkan. Busa kemudian distabilkan selama 10–20 menit dalam inkubator sel. Setelah stabilisasi, 150–180 µL medium ditambahkan ke sisi setiap sumur untuk melepaskan busa dari sumur. Busa yang mengambang bebas kemudian dipindahkan dengan sendok langsung ke sumur baru di pelat 96 sumur dengan dasar datar berisi medium atau dikultur semalaman dan dipindahkan keesokan harinya. Selama beberapa hari berikutnya di inkubator sel, gelembung-gelembung itu pecah secara bertahap dan busa-busa itu berubah menjadi jaringan FN-sutra. Penggantian medium untuk jaringan FN-sutra dilakukan setiap 2–3 hari.
4.1.2 Kultur Kontrol Spheroid dan 2D
Spheroid MSC dibentuk dengan menyemai pelat ULA 96-well (Nunclon Sphera U-bottom atau Akura InSphero) dengan 3000 atau 10.000 sel/well dalam medium 100 atau 70 µL tergantung pada jenis pelat. Spheroid PHH dengan 1500 sel dibentuk dalam pelat ULA 96-well (Corning) seperti yang dijelaskan sebelumnya (Bell et al. 2016 ). Setelah spheroid PHH teragregasi secara memadai, FBS dihentikan dan spheroid dikultur dalam medium kultur bebas serum. Penggantian medium untuk semua spheroid dilakukan setiap 2–3 hari.
Sebagai kontrol 2D, hMSC dan PHH disemai sebagai lapisan tunggal dalam pelat multiwell TCT. Untuk hMSC, kepadatan penyemaian 10.000–15.000 sel/cm 2 digunakan dalam berbagai format pelat (pelat 6-, 24- atau 96-well) yang dilapisi dengan LN421 (10 µg/mL) atau fibronectin (sigma F1141-1MG, 50 µg/mL). PHH disemai dan dikultur dalam 2D dengan menanam 80.000 sel/cm 2 pada pelat 48-well.
4.2 Diferensiasi Adipogenik
hMSC (passage 3 atau 4) disemai ke jaringan FN-silk dengan atau tanpa penambahan laminin rekombinan manusia 421 (10 µg/mL, BioLamina), atau sebagai lapisan tunggal dan spheroid, seperti dijelaskan di bagian 4.1 . Jaringan FN-silk disemai dengan 20.000 sel, lapisan tunggal dengan 10.000–15.000 sel/cm 2 di pelat TCT yang dilapisi dengan LN421 (10 µg/mL). Spheroid dengan 10.000 atau 3000 sel dalam 70 µL/sumur disiapkan di pelat Akura (InSphero CS-PB15) sesuai dengan petunjuk pabrik.
Diferensiasi adipogenik diinduksi pada sekitar 80-90% konfluensi untuk lapisan tunggal, dan pada Hari ke-3 atau ke-4 untuk kultur 3D, dengan mengubah media pertumbuhan menjadi Media Diferensiasi Adipogenik Sel Punca Mesenkimal 2 (PromoCell C-28016). Sel dikultur dalam media diferensiasi dengan perubahan media setiap hari kedua hingga ketiga hingga 3 minggu.
4.3 Analisis Data dan Statistik
Hasil disajikan sebagai mean ± SEM kecuali dinyatakan lain. Analisis statistik dilakukan menggunakan Prism 9 (GraphPad, AS). Untuk perbandingan antara dua kelompok, uji-t heteroskedastik dua sisi tidak berpasangan dilakukan dengan n ≥ 3 sampel per kelompok. Untuk semua kasus lainnya, ANOVA 2 arah digunakan. Semua data disertakan, tanpa outlier yang dihapus. Signifikansi statistik ditetapkan sebagai p ≤ 0,05.




Tinggalkan Balasan